随着煤和石油等不可再生能源的日益枯竭,同时在“碳达峰”与“碳中和”可持续发展的目标下,作为清洁能源的天然气受到了广泛的关注。甲烷干重整反应(DRM)可以将两种温室气体( 和
和 )直接转化为合成气(主要成分为CO和
)直接转化为合成气(主要成分为CO和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。
(1)已知: 、CO和
、CO和 的燃烧热(ΔH)分别为
的燃烧热(ΔH)分别为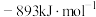 、
、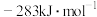 和
和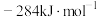 。写出甲烷干重整反应的热化学方程式:
。写出甲烷干重整反应的热化学方程式:___________ 。
(2)甲烷干重整过程中可能存在反应:
R1: (主反应)
(主反应)
R2:
R3: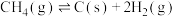
R4: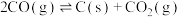
R5: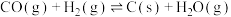
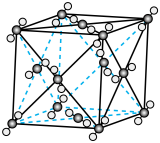
①下图表示R1反应中___________ (填化学式)固体的晶胞结构。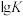 (K为各反应的平衡常数)与温度的关系如图所示。
(K为各反应的平衡常数)与温度的关系如图所示。___________ (填“升高温度”或“降低温度”),简述判断的理由:___________ 。
(3)在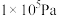 、进料配比
、进料配比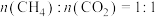 、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、
、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。___________ ℃。
②在最佳温度、p压强下,向某2L的恒容密闭容器中加入2mol 和2mol
和2mol  ,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4
,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4 ,
, 的转化率为90%,则此时R1反应的压强平衡常数
的转化率为90%,则此时R1反应的压强平衡常数
___________ (保留两位有效数字,压强平衡常数用各组分的平衡分压代替物质的量浓度进行计算,平衡分压=物质的量分数×平衡总压强)。
(4)恒容绝热条件下仅发生主反应时,下列情况能说明该反应达到平衡状态的有___________(填标号)。
(5)合成气可以用于生成甲醇,在容积为2L的恒容密闭容器中加入2mol 和1mol CO,发生反应
和1mol CO,发生反应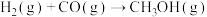 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。
___________  ;15min时改变的条件不可能是
;15min时改变的条件不可能是___________ (填标号)。
A.充入 B.充入CO C.通入惰性气体
B.充入CO C.通入惰性气体
 和
和 )直接转化为合成气(主要成分为CO和
)直接转化为合成气(主要成分为CO和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。(1)已知:
 、CO和
、CO和 的燃烧热(ΔH)分别为
的燃烧热(ΔH)分别为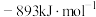 、
、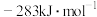 和
和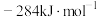 。写出甲烷干重整反应的热化学方程式:
。写出甲烷干重整反应的热化学方程式:(2)甲烷干重整过程中可能存在反应:
R1:
 (主反应)
(主反应)R2:

R3:
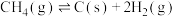
R4:
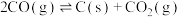
R5:
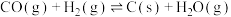
①下图表示R1反应中
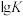 (K为各反应的平衡常数)与温度的关系如图所示。
(K为各反应的平衡常数)与温度的关系如图所示。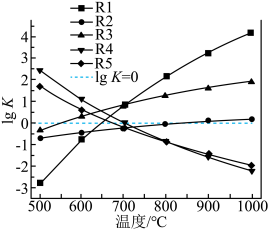
(3)在
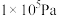 、进料配比
、进料配比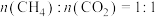 、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、
、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。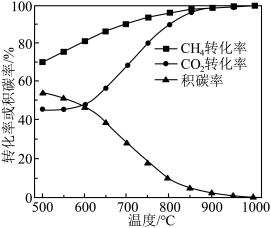
②在最佳温度、p压强下,向某2L的恒容密闭容器中加入2mol
 和2mol
和2mol  ,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4
,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4 ,
, 的转化率为90%,则此时R1反应的压强平衡常数
的转化率为90%,则此时R1反应的压强平衡常数
(4)恒容绝热条件下仅发生主反应时,下列情况能说明该反应达到平衡状态的有___________(填标号)。
A. 和 和 的转化率相等 的转化率相等 | B.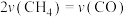 |
C. 的体积分数保持不变 的体积分数保持不变 | D.体系的温度不再变化 |
(5)合成气可以用于生成甲醇,在容积为2L的恒容密闭容器中加入2mol
 和1mol CO,发生反应
和1mol CO,发生反应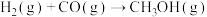 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。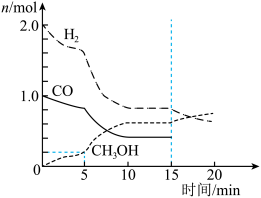

 ;15min时改变的条件不可能是
;15min时改变的条件不可能是A.充入
 B.充入CO C.通入惰性气体
B.充入CO C.通入惰性气体
更新时间:2024-05-23 15:22:44
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】我国自主研发的“蓝鲸一号”在中国南海神狐海域完成可燃冰连续试采,并得到中共中央国务院公开致电祝贺。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是_______________________________ (回答一条即可)。
(2)甲烷自热重整是一种先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应如下:
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______ (填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g) CO(g)+3H2(g) 的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g) 的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
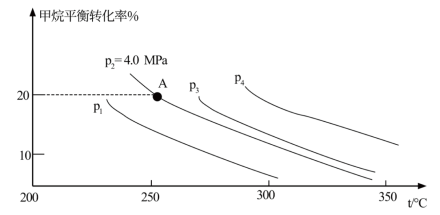
该反应在图中A点的平衡常数Kp=________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________ 。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________ 。
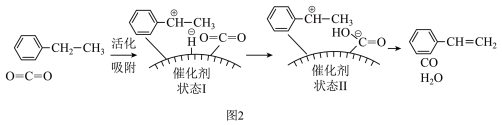
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和环境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。
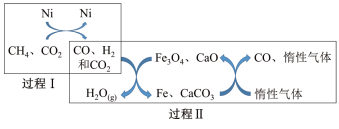
①过程II中第二步反应的化学方程式为_________ 。
②过程II的催化剂是______ ,只有过程I投料比
_______ ,催化剂组成才会保持不变。
(1)“可燃冰”作为能源的优点是
(2)甲烷自热重整是一种先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应如下:
| 反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
| 甲烷氧化 | CH4(g)+ O2(g) O2(g) CO(g)+2H2O(g) CO(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g) CO2(g)+2H2(g) CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸气重整 | CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | +158. 6 | 243.9 |
①在初始阶段,甲烷蒸汽重整的反应速率
②反应CH4(g)+H2O(g)
 CO(g)+3H2(g) 的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g) 的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
该反应在图中A点的平衡常数Kp=
③从能量角度分析,甲烷自热重整方法的先进之处在于
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和环境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。

①过程II中第二步反应的化学方程式为
②过程II的催化剂是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】氮氧化物(NOx)是常见的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。因此,研究氮氧化物(NOx)的无害化处理对治理大气污染、建设生态文明具有重要意义。请按要求回答下列问题:
(1)一氧化二氮是一种强大的温室气体,可用CO(g)在Co*的催化作用下还原N2O(g)以除去污染,反应的化学方程式为CO(g)+N2O(g)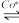 CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。
CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。
第一步:Co*(s)+N2O(g) CoO*(s)+N2(g) ΔH=+15.9kJ/mol;
CoO*(s)+N2(g) ΔH=+15.9kJ/mol;
第二步:___________ (填写第二步反应的热化学方程式)。
(2)汽车尾气中的NO可以和CO在催化转换器中发生反应,以减少尾气污染。某温度时,向2L恒容密闭体系中通入2molCO和1molNO气体,发生反应2CO(g)+2NO(g) N2(g)+2CO2(g),下列能说明反应达到平衡状态的是
N2(g)+2CO2(g),下列能说明反应达到平衡状态的是___________ (填序号)。
a.2v正(NO)=v逆(N2)
b.体系中混合气体密度不再改变
c.CO与NO转化率的比值不再改变
d.该温度下,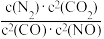 的值不再改变
的值不再改变
(3)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1∶1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:___________ (填“Cat-1”或“Cat-2”)。
②催化剂在Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是___________ 。
(4)用H2也可还原NO气体,其反应为2H2(g)+2NO(g) N2(g)+2H2O(g) ΔH=-752kJ/mol。
N2(g)+2H2O(g) ΔH=-752kJ/mol。
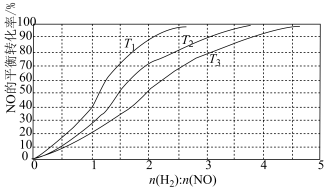
为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:___________ ﹔判断理由是___________ 。
②T1温度下,充入H2、NO分别为3mol、3mol,容器内的压强为wPa,反应进行到6min时达平衡,0~6min内N2的平均反应速率为___________ mol·L-1·min-1,该反应的平衡常数Kp=___________ (写出计算表达式)。
(1)一氧化二氮是一种强大的温室气体,可用CO(g)在Co*的催化作用下还原N2O(g)以除去污染,反应的化学方程式为CO(g)+N2O(g)
 CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。
CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。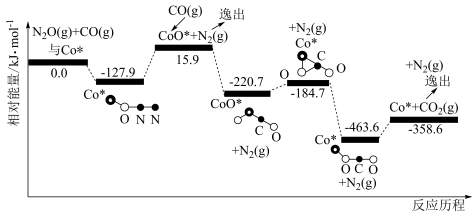
第一步:Co*(s)+N2O(g)
 CoO*(s)+N2(g) ΔH=+15.9kJ/mol;
CoO*(s)+N2(g) ΔH=+15.9kJ/mol;第二步:
(2)汽车尾气中的NO可以和CO在催化转换器中发生反应,以减少尾气污染。某温度时,向2L恒容密闭体系中通入2molCO和1molNO气体,发生反应2CO(g)+2NO(g)
 N2(g)+2CO2(g),下列能说明反应达到平衡状态的是
N2(g)+2CO2(g),下列能说明反应达到平衡状态的是a.2v正(NO)=v逆(N2)
b.体系中混合气体密度不再改变
c.CO与NO转化率的比值不再改变
d.该温度下,
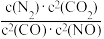 的值不再改变
的值不再改变(3)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1∶1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
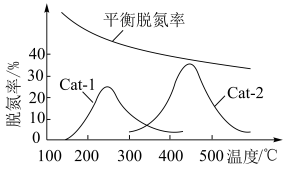
②催化剂在Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是
(4)用H2也可还原NO气体,其反应为2H2(g)+2NO(g)
 N2(g)+2H2O(g) ΔH=-752kJ/mol。
N2(g)+2H2O(g) ΔH=-752kJ/mol。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:
②T1温度下,充入H2、NO分别为3mol、3mol,容器内的压强为wPa,反应进行到6min时达平衡,0~6min内N2的平均反应速率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
(1)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,
氢氟酸电离的热化学方程式为________________________ 。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是____ 。
A.c(H+) B.c(H+)·c(OH-) C.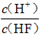 D.
D.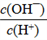
(3)向Na2CO3溶液通入过量H2S,反应的离子方程式为______________ 。
(4)25℃时,在20mL 0.1mol/L氢氟酸中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____________ 。
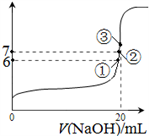
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中, c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)< c(Na+)=0.1mol/L
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验 证明之:_______________________ 。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,每生成1mol HF转移________ mol电子。
(7)已知BiCl3水解产物中有 BiOCl生成。写出水解反应方程式___________________________ ,为防止其水解,如何配制 BiCl3溶液?_________________________________________________ 。
| 化学式 | HF | H2CO3 | H2S |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,
氢氟酸电离的热化学方程式为
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是
A.c(H+) B.c(H+)·c(OH-) C.
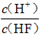 D.
D.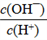
(3)向Na2CO3溶液通入过量H2S,反应的离子方程式为
(4)25℃时,在20mL 0.1mol/L氢氟酸中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中, c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)< c(Na+)=0.1mol/L
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,每生成1mol HF转移
(7)已知BiCl3水解产物中有 BiOCl生成。写出水解反应方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】甲烷和水蒸气催化制氢主要有如下两个反应:
①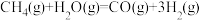 ΔH=+206kJ/mol
ΔH=+206kJ/mol
②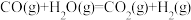 ΔH=-41kJ/mol
ΔH=-41kJ/mol
恒定压强为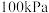 时,将n(CH4)∶n(H2O)=1∶3的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
时,将n(CH4)∶n(H2O)=1∶3的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
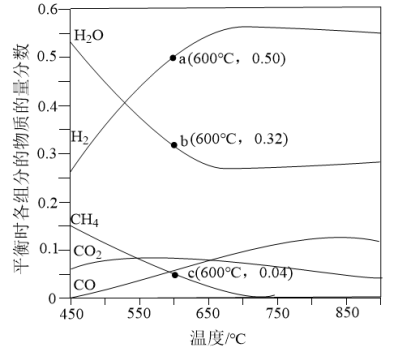
回答下列问题:
(1)写出 与
与 生成
生成 和
和 的热化学方程式:
的热化学方程式:_______ 。
(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是_______ (填标号)。
A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快
B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快
C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
D.加入合适的催化剂,降低反应温度也能实现平衡转化率不变
(3)系统中 的含量,在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
的含量,在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
①低于700℃,_______ ;
②高于700℃,_______ 。
(4)已知投料比为n(CH4)∶n(H2O)=1∶3的混合气体,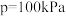 。600℃时,
。600℃时, 的平衡转化率为
的平衡转化率为_______ ,反应①的平衡常数的计算式为
_______ ( 是以分压表示的平衡常数,分压=总压×物质的量分数)。
是以分压表示的平衡常数,分压=总压×物质的量分数)。
①
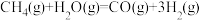 ΔH=+206kJ/mol
ΔH=+206kJ/mol②
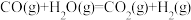 ΔH=-41kJ/mol
ΔH=-41kJ/mol恒定压强为
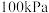 时,将n(CH4)∶n(H2O)=1∶3的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
时,将n(CH4)∶n(H2O)=1∶3的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
回答下列问题:
(1)写出
 与
与 生成
生成 和
和 的热化学方程式:
的热化学方程式:(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是
A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快
B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快
C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
D.加入合适的催化剂,降低反应温度也能实现平衡转化率不变
(3)系统中
 的含量,在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
的含量,在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:①低于700℃,
②高于700℃,
(4)已知投料比为n(CH4)∶n(H2O)=1∶3的混合气体,
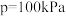 。600℃时,
。600℃时, 的平衡转化率为
的平衡转化率为
 是以分压表示的平衡常数,分压=总压×物质的量分数)。
是以分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:__ 。
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=___ 。
②在该温度下反应的平衡常数K=___ 。
③关于上述反应,下列叙述正确的是___ (填字母)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:
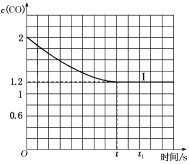
若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ___ (不要求标出CO的终点坐标)。
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:
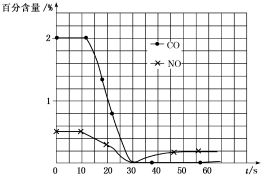
请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是___ 。
(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=
②在该温度下反应的平衡常数K=
③关于上述反应,下列叙述正确的是
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:

若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:

请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】NH3是一种重要的化工原料。
(1)液氨是重要的非水溶剂。和水类似,液氨的电离平衡为 。
。
①写出(NH4)2SO4与KNH2在液氨中恰好完全中和时的化学方程式:__________ 。
②以KNH2的液氨溶液为电解液,通过电解可得高纯氢气(原理如图所示)。阴极反应式为___________ 。理论上生成1molN2的同时,电解液减少的质量为____________ g。 。该反应常温下能自发进行的原因是
。该反应常温下能自发进行的原因是___________ 。
(3)现有两个容积相等的恒容容器实验室合成氨气:
a.向恒温(320℃)的容器1中通入一定量的H2和N2,NH3的产率随时间变化关系如图所示。 时刻达到平衡。此后保持体系恒温(320℃),在
时刻达到平衡。此后保持体系恒温(320℃),在 时刻重新达到平衡。
时刻重新达到平衡。
请在图中补充画出容器2从投料后到 时刻的NH3的产率随时间变化关系曲线
时刻的NH3的产率随时间变化关系曲线___________ 。
(4)NH3热分解也可制得H2:
 ,将一定量NH3(g)置于恒压密闭容器中,不同温度(T)下平衡混合物中N2物质的量分数随压强的变化曲线如图所示。
,将一定量NH3(g)置于恒压密闭容器中,不同温度(T)下平衡混合物中N2物质的量分数随压强的变化曲线如图所示。
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②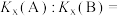
____________ [对于反应 ,
,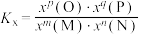 ,x为物质的量分数]。
,x为物质的量分数]。
③NH3热分解反应速率方程为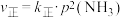 ,式中
,式中 为正反应的速率常数(只与温度有关)。将C点增大压强后,平衡发生移动,直至达到新的平衡,正反应速率的变化情况为
为正反应的速率常数(只与温度有关)。将C点增大压强后,平衡发生移动,直至达到新的平衡,正反应速率的变化情况为__________ (填字母)。
a.逐渐减小直至不变 b.逐渐增大直至不变
c.先减小,后逐渐增大直至不变 d.先增大,后逐渐减小直至不变
(1)液氨是重要的非水溶剂。和水类似,液氨的电离平衡为
 。
。①写出(NH4)2SO4与KNH2在液氨中恰好完全中和时的化学方程式:
②以KNH2的液氨溶液为电解液,通过电解可得高纯氢气(原理如图所示)。阴极反应式为
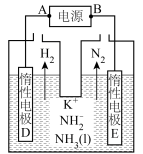
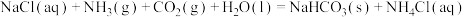 。该反应常温下能自发进行的原因是
。该反应常温下能自发进行的原因是(3)现有两个容积相等的恒容容器实验室合成氨气:
a.向恒温(320℃)的容器1中通入一定量的H2和N2,NH3的产率随时间变化关系如图所示。
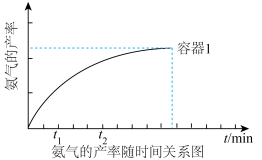
 时刻达到平衡。此后保持体系恒温(320℃),在
时刻达到平衡。此后保持体系恒温(320℃),在 时刻重新达到平衡。
时刻重新达到平衡。请在图中补充画出容器2从投料后到
 时刻的NH3的产率随时间变化关系曲线
时刻的NH3的产率随时间变化关系曲线(4)NH3热分解也可制得H2:
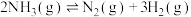
 ,将一定量NH3(g)置于恒压密闭容器中,不同温度(T)下平衡混合物中N2物质的量分数随压强的变化曲线如图所示。
,将一定量NH3(g)置于恒压密闭容器中,不同温度(T)下平衡混合物中N2物质的量分数随压强的变化曲线如图所示。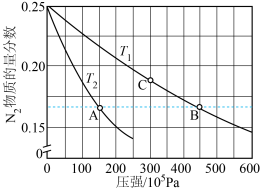

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②
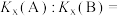
 ,
,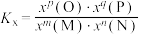 ,x为物质的量分数]。
,x为物质的量分数]。③NH3热分解反应速率方程为
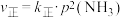 ,式中
,式中 为正反应的速率常数(只与温度有关)。将C点增大压强后,平衡发生移动,直至达到新的平衡,正反应速率的变化情况为
为正反应的速率常数(只与温度有关)。将C点增大压强后,平衡发生移动,直至达到新的平衡,正反应速率的变化情况为a.逐渐减小直至不变 b.逐渐增大直至不变
c.先减小,后逐渐增大直至不变 d.先增大,后逐渐减小直至不变
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】 循环再利用制备甲烷、甲醇等有机燃料,变废为宝历来是化学重要的研究领域。为了减少
循环再利用制备甲烷、甲醇等有机燃料,变废为宝历来是化学重要的研究领域。为了减少 的排放,可用下列方法把
的排放,可用下列方法把 转化成燃料,试回答下列问题:
转化成燃料,试回答下列问题:
a.
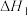
b.
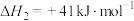
(1)已知c.
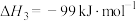 ,则
,则
___________  ;反应a在
;反应a在___________ (选填“高温”、“低温”或“任意温度”)下,易自发进行。
(2)向刚性容器中充入一定量的 和
和 ,在不同催化剂(Cat.1,Cat.2)下经相同反应时间,
,在不同催化剂(Cat.1,Cat.2)下经相同反应时间, 的转化率和甲醇的选择性[甲醇的选择性
的转化率和甲醇的选择性[甲醇的选择性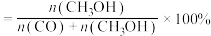 ]随温度的变化如图:
]随温度的变化如图:
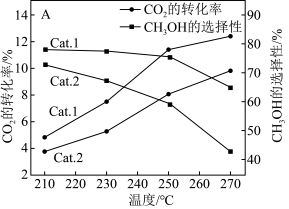
①由图可知,催化效果Cat.1___________ Cat.2(填“>”“<”或“=”)。
②在210~270℃间, 的选择性随温度的升高而下降,请写出一条可能原因
的选择性随温度的升高而下降,请写出一条可能原因___________ 。
(3)一定条件下,向刚性容器中充入物质的量之比为1:3的 和
和 发生上述反应。
发生上述反应。
①有利于提高甲醇平衡产率的条件是___________ (填标号)。
A.高温高压 B.低温高压 C.高温低压 D.低温低压
②达到平衡时 的转化率为20%,
的转化率为20%, 的选择性为75%,则
的选择性为75%,则 的转化率为
的转化率为___________ ;反应b的压强平衡常数
___________ 。(压强平衡常数为用分压表示的化学平衡常数,分压=总压×物质的量分数)
 循环再利用制备甲烷、甲醇等有机燃料,变废为宝历来是化学重要的研究领域。为了减少
循环再利用制备甲烷、甲醇等有机燃料,变废为宝历来是化学重要的研究领域。为了减少 的排放,可用下列方法把
的排放,可用下列方法把 转化成燃料,试回答下列问题:
转化成燃料,试回答下列问题:a.

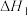
b.

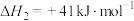
(1)已知c.

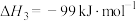 ,则
,则
 ;反应a在
;反应a在(2)向刚性容器中充入一定量的
 和
和 ,在不同催化剂(Cat.1,Cat.2)下经相同反应时间,
,在不同催化剂(Cat.1,Cat.2)下经相同反应时间, 的转化率和甲醇的选择性[甲醇的选择性
的转化率和甲醇的选择性[甲醇的选择性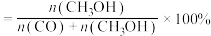 ]随温度的变化如图:
]随温度的变化如图:
①由图可知,催化效果Cat.1
②在210~270℃间,
 的选择性随温度的升高而下降,请写出一条可能原因
的选择性随温度的升高而下降,请写出一条可能原因(3)一定条件下,向刚性容器中充入物质的量之比为1:3的
 和
和 发生上述反应。
发生上述反应。①有利于提高甲醇平衡产率的条件是
A.高温高压 B.低温高压 C.高温低压 D.低温低压
②达到平衡时
 的转化率为20%,
的转化率为20%, 的选择性为75%,则
的选择性为75%,则 的转化率为
的转化率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】I.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知:C(s)+O2(g)=CO2(g) △H1=—393.5kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H2=—241.8kJ·mol-1
O2(g)=H2O(g) △H2=—241.8kJ·mol-1
CO(g)+ O2(g)=CO2(g) △H3=—283.0kJ·mol-1
O2(g)=CO2(g) △H3=—283.0kJ·mol-1
则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的△H=____ 。
II.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应为4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) △H=—198kJ·mol-1。
CH3OCH3(g)+H2O(g) △H=—198kJ·mol-1。
(2)如图所示能正确反映平衡常数K随温度变化关系的曲线为____ (填曲线标记字母)。

(3)在一定温度下,向2.0L固定容积的密闭容器中充入2molH2和1molCO,经过一段时间后,反应4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见表:
①0~20min的平均反应速率v(CO)=____ mol·L-1·min-1。
②达到平衡时,H2的转化率为____ 。
③在上述温度下,该反应的平衡常数K=____ 。
④能表明该反应达到平衡状态的是____ (填字母)。
A.CO的转化率等于H2O的产率 B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变 D.混合气体的密度不变
⑤在上述温度下,向平衡后的2L容器中再充入0.4molH2和0.4molCH3OCH3(g),则化学平衡____ (填“向左”“向右”或“不”)移动。
(1)已知:C(s)+O2(g)=CO2(g) △H1=—393.5kJ·mol-1
H2(g)+
 O2(g)=H2O(g) △H2=—241.8kJ·mol-1
O2(g)=H2O(g) △H2=—241.8kJ·mol-1CO(g)+
 O2(g)=CO2(g) △H3=—283.0kJ·mol-1
O2(g)=CO2(g) △H3=—283.0kJ·mol-1则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的△H=
II.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应为4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) △H=—198kJ·mol-1。
CH3OCH3(g)+H2O(g) △H=—198kJ·mol-1。(2)如图所示能正确反映平衡常数K随温度变化关系的曲线为

(3)在一定温度下,向2.0L固定容积的密闭容器中充入2molH2和1molCO,经过一段时间后,反应4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见表:| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
| n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
| n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20min的平均反应速率v(CO)=
②达到平衡时,H2的转化率为
③在上述温度下,该反应的平衡常数K=
④能表明该反应达到平衡状态的是
A.CO的转化率等于H2O的产率 B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变 D.混合气体的密度不变
⑤在上述温度下,向平衡后的2L容器中再充入0.4molH2和0.4molCH3OCH3(g),则化学平衡
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】苯乙烯是用于生产苯乙烯系列树脂、丁苯橡胶、离子交换树脂及医药品的原料之一,可通过乙苯的分解制备。
(1)标准状态时,由指定单质生成 物质的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用
物质的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用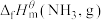 表示。规定
表示。规定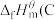 ,石墨
,石墨 和
和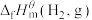 为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如下表:
为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如下表:
乙苯分解反应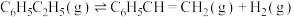 的
的
_______  ,该反应在
,该反应在___________ (填标号)下有利于自发进行。
a.高温 b.低温 c.任何温度
(2)向密闭容器中充入 气态乙苯发生反应
气态乙苯发生反应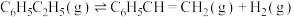 ,其平衡转化率随温度和压强变化的情况如图所示。
,其平衡转化率随温度和压强变化的情况如图所示。
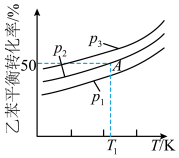
① 由大到小的顺序是
由大到小的顺序是___________ 。
②A点对应的条件下,H2的体积分数为___________ (保留三位有效数字)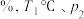 下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数
下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数 某组分的物质的量
某组分的物质的量 总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]
总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]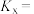
___________ ; 与压强平衡常数
与压强平衡常数 (以分压装示,分压=总压×物质的量分数,
(以分压装示,分压=总压×物质的量分数, 表示总压)的关系为
表示总压)的关系为
___________ (用含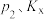 的式子表示)。
的式子表示)。
③向 点平衡体系中加入
点平衡体系中加入 可提高平衡转化率,欲将平衡转化率提高至
可提高平衡转化率,欲将平衡转化率提高至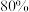 ,需要向反应器中充入
,需要向反应器中充入___________ 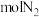 作为稀释气。
作为稀释气。
(1)标准状态时,由指定单质生成
 物质的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用
物质的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用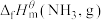 表示。规定
表示。规定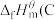 ,石墨
,石墨 和
和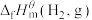 为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如下表:
为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如下表:| 物质 | 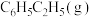 |  |
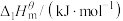 | +29.8 | +147.5 |
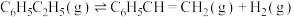 的
的
 ,该反应在
,该反应在a.高温 b.低温 c.任何温度
(2)向密闭容器中充入
 气态乙苯发生反应
气态乙苯发生反应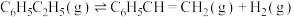 ,其平衡转化率随温度和压强变化的情况如图所示。
,其平衡转化率随温度和压强变化的情况如图所示。
①
 由大到小的顺序是
由大到小的顺序是②A点对应的条件下,H2的体积分数为
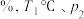 下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数
下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数 某组分的物质的量
某组分的物质的量 总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]
总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]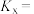
 与压强平衡常数
与压强平衡常数 (以分压装示,分压=总压×物质的量分数,
(以分压装示,分压=总压×物质的量分数, 表示总压)的关系为
表示总压)的关系为
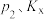 的式子表示)。
的式子表示)。③向
 点平衡体系中加入
点平衡体系中加入 可提高平衡转化率,欲将平衡转化率提高至
可提高平衡转化率,欲将平衡转化率提高至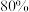 ,需要向反应器中充入
,需要向反应器中充入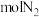 作为稀释气。
作为稀释气。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】锗(Ge)是门捷列夫在1871年所预言的元素“亚硅”,高纯度的锗已成为目前重要的半导体材料,其化合物在治疗癌症方面也有着独特的功效。下图是以锗锌矿(主要成分为 、ZnS,另外含有少量的
、ZnS,另外含有少量的 等)为主要原料生产高纯度锗的工艺流程:
等)为主要原料生产高纯度锗的工艺流程:
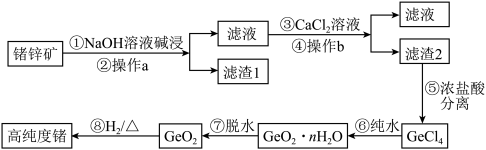
已知: 可溶于强碱溶液,生成锗酸盐。
可溶于强碱溶液,生成锗酸盐。 的熔点为
的熔点为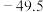 ℃,沸点为84℃,在水中或酸的稀溶液中易水解。
℃,沸点为84℃,在水中或酸的稀溶液中易水解。
(1)Ge位于ⅣA族,属于_______ 区, 晶体所属类别是
晶体所属类别是_______ 。
(2)步骤①NaOH溶液碱浸时发生的离子反应方程式为_______ 。
(3)步骤③沉锗过程中,当温度为90℃,pH为14时,加料量(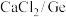 质量比)对沉锗的影响如表所示,选择最佳加料量为
质量比)对沉锗的影响如表所示,选择最佳加料量为_______ (填“10-15”“15-20”或“20-25”)。
(4)步骤⑤中选择浓盐酸而不选择稀盐酸的原因是_______ 。
(5)步骤⑥的化学反应方程式为_______ 。
(6)Ge元素的单质及其化合物都具有独特的优异性能。请回答下列问题:
①量子化学计算显示含锗化合物 具有良好的光电化学性能。
具有良好的光电化学性能。 是
是 的量子化学计算模型,
的量子化学计算模型, 的晶体结构如图所示,若设定图中体心钙离子的分数坐标为
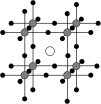
的晶体结构如图所示,若设定图中体心钙离子的分数坐标为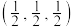 ,则分数坐标为
,则分数坐标为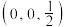 的离子是
的离子是_______ 。
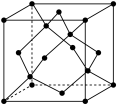
②晶体Ge是优良的半导体,可作高频率电流的检波和交流电的整流用。如图为Ge单晶的晶胞,设Ge原子半径为r pm,其中晶胞体对角线长度为8r pm,阿伏加德罗常数的值为 ,则该锗晶体的密度计算式为(不需化简)
,则该锗晶体的密度计算式为(不需化简)
_______ 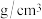 。(已知相对原子量:Ge 73)
。(已知相对原子量:Ge 73)
 、ZnS,另外含有少量的
、ZnS,另外含有少量的 等)为主要原料生产高纯度锗的工艺流程:
等)为主要原料生产高纯度锗的工艺流程:
已知:
 可溶于强碱溶液,生成锗酸盐。
可溶于强碱溶液,生成锗酸盐。 的熔点为
的熔点为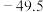 ℃,沸点为84℃,在水中或酸的稀溶液中易水解。
℃,沸点为84℃,在水中或酸的稀溶液中易水解。(1)Ge位于ⅣA族,属于
 晶体所属类别是
晶体所属类别是(2)步骤①NaOH溶液碱浸时发生的离子反应方程式为
(3)步骤③沉锗过程中,当温度为90℃,pH为14时,加料量(
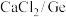 质量比)对沉锗的影响如表所示,选择最佳加料量为
质量比)对沉锗的影响如表所示,选择最佳加料量为| 编号 | 加料量(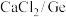 ) ) | 母液体积(mL) | 过滤后滤液含锗(mg/L) | 过滤后滤液pH | 锗沉淀率(%) |
| 1 | 10 | 500 | 76 | 8 | 93.67 |
| 2 | 15 | 500 | 20 | 8 | 98.15 |
| 3 | 20 | 500 | 2 | 11 | 99.78 |
| 4 | 25 | 500 | 1.5 | 12 | 99.85 |
(5)步骤⑥的化学反应方程式为
(6)Ge元素的单质及其化合物都具有独特的优异性能。请回答下列问题:
①量子化学计算显示含锗化合物
 具有良好的光电化学性能。
具有良好的光电化学性能。 是
是 的量子化学计算模型,
的量子化学计算模型, 的晶体结构如图所示,若设定图中体心钙离子的分数坐标为
的晶体结构如图所示,若设定图中体心钙离子的分数坐标为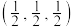 ,则分数坐标为
,则分数坐标为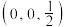 的离子是
的离子是
②晶体Ge是优良的半导体,可作高频率电流的检波和交流电的整流用。如图为Ge单晶的晶胞,设Ge原子半径为r pm,其中晶胞体对角线长度为8r pm,阿伏加德罗常数的值为
 ,则该锗晶体的密度计算式为(不需化简)
,则该锗晶体的密度计算式为(不需化简)
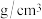 。(已知相对原子量:Ge 73)
。(已知相对原子量:Ge 73)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】 是生产含钼催化剂的重要原料,能溶于氨水和强碱。以钼精矿(主要成分是
是生产含钼催化剂的重要原料,能溶于氨水和强碱。以钼精矿(主要成分是 ,还含有
,还含有 、
、 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 和
和 发生反应;
发生反应; 元素转化为
元素转化为 、
、 、
、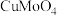 ;
;
②“氨浸”时, 元素以
元素以 的形式进入滤液1中,而
的形式进入滤液1中,而 元素进入滤渣1中;
元素进入滤渣1中;
③ 。
。
回答下列问题:
(1)尾气的成分有 和
和_______ (填化学式)。
(2)“滤渣1”的主要成分是 和
和_______ (填化学式)。
(3)写出“除杂”时反应的离子方程式_______ 。除杂后测得溶液中 ,列式计算并判断
,列式计算并判断 是否沉淀完全
是否沉淀完全_______ 。
(4)“酸沉”时加入 的作用是
的作用是_______ 。
(5)写出四钼酸铵[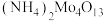 ]发生“焙解”的化学方程式
]发生“焙解”的化学方程式_______ 。
(6) 的结构和
的结构和 相似,如图
相似,如图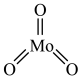 ,易升华,则
,易升华,则 晶体类型为
晶体类型为_______ 。 晶体有多种晶胞,正交相
晶体有多种晶胞,正交相 具有独特的层状结构,层与层之间的作用力为范德华力,根据结构和作用力预测正交相
具有独特的层状结构,层与层之间的作用力为范德华力,根据结构和作用力预测正交相 晶体在日常生活中可用作
晶体在日常生活中可用作_______ 。
(7)工业上还可以在碱性环境下用 溶液和
溶液和 反应制备钼酸盐,同时生成副产品硫酸盐,写出该反应的离子方程式
反应制备钼酸盐,同时生成副产品硫酸盐,写出该反应的离子方程式_______ 。
 是生产含钼催化剂的重要原料,能溶于氨水和强碱。以钼精矿(主要成分是
是生产含钼催化剂的重要原料,能溶于氨水和强碱。以钼精矿(主要成分是 ,还含有
,还含有 、
、 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图所示:
的工艺流程如图所示: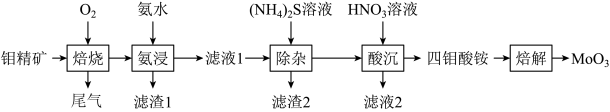
 和
和 发生反应;
发生反应; 元素转化为
元素转化为 、
、 、
、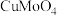 ;
;②“氨浸”时,
 元素以
元素以 的形式进入滤液1中,而
的形式进入滤液1中,而 元素进入滤渣1中;
元素进入滤渣1中;③
 。
。回答下列问题:
(1)尾气的成分有
 和
和(2)“滤渣1”的主要成分是
 和
和(3)写出“除杂”时反应的离子方程式
 ,列式计算并判断
,列式计算并判断 是否沉淀完全
是否沉淀完全(4)“酸沉”时加入
 的作用是
的作用是(5)写出四钼酸铵[
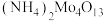 ]发生“焙解”的化学方程式
]发生“焙解”的化学方程式(6)
 的结构和
的结构和 相似,如图
相似,如图 ,易升华,则
,易升华,则 晶体类型为
晶体类型为 晶体有多种晶胞,正交相
晶体有多种晶胞,正交相 具有独特的层状结构,层与层之间的作用力为范德华力,根据结构和作用力预测正交相
具有独特的层状结构,层与层之间的作用力为范德华力,根据结构和作用力预测正交相 晶体在日常生活中可用作
晶体在日常生活中可用作(7)工业上还可以在碱性环境下用
 溶液和
溶液和 反应制备钼酸盐,同时生成副产品硫酸盐,写出该反应的离子方程式
反应制备钼酸盐,同时生成副产品硫酸盐,写出该反应的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】苯乙烯是生产塑料和合成橡胶的重要有机原料,可由乙苯催化脱氢获得。
(1)科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):
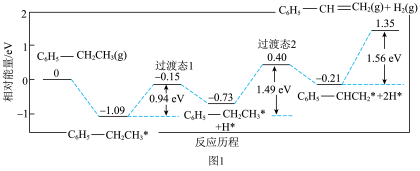
乙苯脱氢制苯乙烯反应的焓变
___________ (填“>”“<”或“=”)0,为提高乙苯的平衡转化率,应选择的反应条件为___________ (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
(2)有研究者发现,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图2:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图2:
①该过程的总反应的化学方程式为___________ 。
② 属于
属于___________ (填“极性”或“非极性”)分子;干冰中每个 分子周围有
分子周围有___________ 个紧邻分子。
③从资源综合利用角度分析, 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是___________ 。
(3)100kPa恒压下,将2mol乙苯蒸气通入体积可变的密闭容器中发生乙苯脱氢制苯乙烯反应。
① ℃时,反应经过10min达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为
℃时,反应经过10min达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为________ ,0~10min内的平均反应速率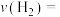
_______ 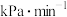 ,该温度下的
,该温度下的
_______ kPa。
② ℃时,若再向体系中通入氮气,此时
℃时,若再向体系中通入氮气,此时
___________ (填“增大”“减小”或“不变”)。
(1)科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):

乙苯脱氢制苯乙烯反应的焓变

A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
(2)有研究者发现,在
 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图2:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图2:
①该过程的总反应的化学方程式为
②
 属于
属于 分子周围有
分子周围有③从资源综合利用角度分析,
 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是(3)100kPa恒压下,将2mol乙苯蒸气通入体积可变的密闭容器中发生乙苯脱氢制苯乙烯反应。
①
 ℃时,反应经过10min达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为
℃时,反应经过10min达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为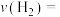
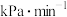 ,该温度下的
,该温度下的
②
 ℃时,若再向体系中通入氮气,此时
℃时,若再向体系中通入氮气,此时
您最近一年使用:0次



