A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______ (填元素符号),其中C原子的核外电子排布式为__________ 。
(2)单质A有两种同素异形体,其中沸点高的是_____ (填分子式),原因是_______ ;A和B的氢化物所属的晶体类型分别为______ 和______ 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为______ ,中心原子的杂化轨道类型为______ 。
(4)化合物D2A的立体构型为___ ,中心原子的价层电子对数为______ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_________ 。
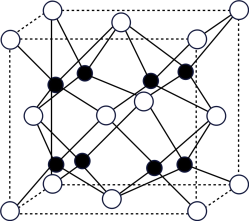
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为______ :晶胞中A原子的配位数为_________ ;列式计算晶体F的密度(g.cm-3)_____ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为
(4)化合物D2A的立体构型为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为

2015·全国·高考真题 查看更多[32]
2015年全国普通高等学校招生统一考试化学(新课标II卷)2016届广东省仲元中学高三11月月考理科综合化学试卷2016届重庆市第一中学高三上12月月考理综化学试卷2016届宁夏六盘山中学高三上第一次模拟理综化学试卷2017届江西省九江市十校高三第二次联考理科综合化学试卷新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题宁夏六盘山高级中学2017届高三第五次模拟考试理科综合化学试题宁夏石嘴山市第三中学2018届高三9月月考化学试题河北省正定中学2017届高三上学期第三次月考化学试题四川省南充高级中学2018届高三上学期第四次检测理综化学试题山西省临猗县临晋中学2017-2018学年高二下学期期末考试化学试题西藏自治区日喀则市南木林高级中学2019届高三第一次月考理综化学试题河北省唐山市第十一中学2018-2019学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷山西省应县第一中学校2018-2019学年高二下学期期中考试化学试题云南省玉溪一中2020届高三上学期期中考试理综化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题四川省成都市双流棠湖中学2019-2020学年高二下学期第二次月考化学试题2020届浙江省杭州学军中学高三教学质量监测卷化学试题湖南省长沙市礼雅中学2020届高三下学期三月份网络教学质量监测理科综合化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广东省广州市华南师范大学附属中学2020届高三教学质量监测卷理科综合化学试题广东省深圳外国语学校2021届高三上学期11月月考化学试题四川省成都市北大成都附属实验学校2021届高三上学期12月月考理科综合化学试题广东省2021届高三“六校联盟”第三次联考化学试题四川省成都龙泉中学2021届高三下学期4月月考理科综合化学试题吉林省松原市实验高级中学2021届高三5月月考化学试题(已下线)2020年海南卷化学高考真题变式题15-19山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题内蒙古通辽市/科左中旗民族职专·实验高中2023-2024学年高三上学期第二次月考化学试卷
更新时间:2019-01-30 18:14:09
|
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】金属锡及其化合物在生产和科研中应用广泛。回答下列问题:
(1)某种含锡的有机金属化合物的结构如图所示。已知烷基配位体以C、N整合形式键合于Sn原子。_______ ,在周期表中的位置为_______ ,C、Si、Cl电负性由大到小的顺序为_______ 。
②该化合物中共有_______ 种杂化方式;提供电子对形成配位键的原子是_______ 。
(2)一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图。A中Fe、Sn位置互换即为B。_______ ,晶胞中Sn的配位数与Cu的配位数之比为_______ 。
②立方体A、B棱长均为a pm,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。晶胞中部分原子的分数坐标为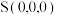 、
、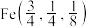 ,则晶胞中Sn原子的分数坐标为
,则晶胞中Sn原子的分数坐标为_______ ;晶胞中Sn原子和Cu原子间的最短距离为_______ pm。
(1)某种含锡的有机金属化合物的结构如图所示。已知烷基配位体以C、N整合形式键合于Sn原子。
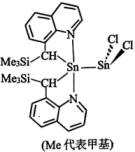
②该化合物中共有
(2)一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图。A中Fe、Sn位置互换即为B。

②立方体A、B棱长均为a pm,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。晶胞中部分原子的分数坐标为
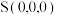 、
、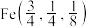 ,则晶胞中Sn原子的分数坐标为
,则晶胞中Sn原子的分数坐标为
您最近一年使用:0次
【推荐2】近年来,我国航天事业发展迅猛,这与材料技术的进步密切相关。如新型储氢材料、陶瓷基复合材料氮化硼(BN)、太阳能电池材料砷化镓(GaAs)等,请按要求回答问题:
(1)基态砷原子的核外电子排布式为_______ ,其电子占据的最高能层符号是_______ ,占据最高能级的电子所在的原子轨道为_______ 形。
(2)硼氢化钠(NaBH4,其中氢元素显-1价)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气: NaBH4+ 2H2O=NaBO2+ 4H2↑。上述方程式中所涉及的非金属元素的电负性由大到小的顺序为_______ ;与硼处于同一周期的元素中,第一电离能大于硼的元素有_______ 种。硼原子在成键时,能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子的价电子的轨道表示式_______ ,该过程形成的原子光谱为_______ 光谱(填“吸收”或“发射”)。
(3)简单金属氢化物也是具有良好发展前景的储氢材料。在LiH中,离子半径: Li+_______ H-(填“>”“=”或“<”,原因是_______ 。
(4)铜、锌两种元素位于元素周期表的_______ 区,两元素的第一电离能(I1)、第二电离能(I2)数据如表所示:
铜的I1小于锌,I2却大于锌的主要原因是_______ 。
(1)基态砷原子的核外电子排布式为
(2)硼氢化钠(NaBH4,其中氢元素显-1价)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气: NaBH4+ 2H2O=NaBO2+ 4H2↑。上述方程式中所涉及的非金属元素的电负性由大到小的顺序为
(3)简单金属氢化物也是具有良好发展前景的储氢材料。在LiH中,离子半径: Li+
(4)铜、锌两种元素位于元素周期表的
| 电离能/(kJ·mol-1) | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
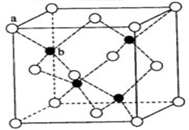
【推荐3】硫化锌荧光材料的研究从1868年法国化学家Sidot发现至今已有近150年的历史。其中立方硫化锌的晶胞如图所示。请回答下列问题:
(1)锌元素在周期表中的位于第______ 周期_____ 族, 属于_____ 区;
(2)基态锌原子的价电子排布式为_________ ;
(3)一般锌元素常表现为+2 价的原因是_____ ;
(4)立方硫化锌晶体的每个晶胞中含有_____ 个锌离子, 其配位数为_____ ;含有_____ 个硫离子,其配位数为_____ ;
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________ g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_____ pm(列式表示)。

(1)锌元素在周期表中的位于第
(2)基态锌原子的价电子排布式为
(3)一般锌元素常表现为+2 价的原因是
(4)立方硫化锌晶体的每个晶胞中含有
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】卤族元素的单质和化合物在生产生活中有重要的用途。
(1)溴原子的核外电子排布式为[Ar]__________ ,有_____ 个未成对电子。
(2)在一定浓度的 HF 溶液中,氟化氢是以缔合形式(HF)2 存在的。使氟化氢分子缔合的作用力是____________ 。
(3)根据下表数据,分析熔点和硬度变化的原因:________________ 。
(4)HIO3 的酸性_____ (填“强于”或“弱于”)HIO4,原因是_________________ 。
(5)ClO2中心氯原子的杂化类型为________ ,ClO3的空间构型为__________ 。
(6)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是 CaF2 的晶胞,其中原子坐标参数 A 处为(0,0,0);B 处为( ,
, ,0);C 处为(1,1,1)。则 D 处微粒的坐标参数为
,0);C 处为(1,1,1)。则 D 处微粒的坐标参数为__________ 。

②晶胞参数:描述晶胞的大小和形状。已知 CaF2 晶体的密度为 c g•cm3,则晶胞中 Ca2+与离它最近的 F之间的距离为_________ nm(设 NA 为阿伏伽德罗常数的值,用含 c、NA 的式子表示)。
(1)溴原子的核外电子排布式为[Ar]
(2)在一定浓度的 HF 溶液中,氟化氢是以缔合形式(HF)2 存在的。使氟化氢分子缔合的作用力是
(3)根据下表数据,分析熔点和硬度变化的原因:

(4)HIO3 的酸性
(5)ClO2中心氯原子的杂化类型为
(6)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是 CaF2 的晶胞,其中原子坐标参数 A 处为(0,0,0);B 处为(
 ,
, ,0);C 处为(1,1,1)。则 D 处微粒的坐标参数为
,0);C 处为(1,1,1)。则 D 处微粒的坐标参数为
②晶胞参数:描述晶胞的大小和形状。已知 CaF2 晶体的密度为 c g•cm3,则晶胞中 Ca2+与离它最近的 F之间的距离为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)黑磷是新型材料,具有类似石墨一样的片层结构(如图),层与层之间以_____ 结合。从结构上可以看出单层磷烯并非平面结构,但其导电性却优于石墨烯的原因是________________ 。

(2)四(三苯基膦)钯分子结构如下图:
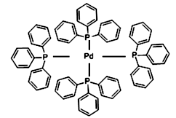

该物质可用于上图所示物质A的合成:物质A中碳原子杂化轨道类型为__________ ;
(3)PCl5是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子.(该晶体的晶胞如图所示).熔体中P-Cl的键长只有198 nm和206 nm两种,写这两种离子的化学式为______________________ ;正四面体形阳离子中键角_____ PCl3的键角(填> 或<或=),原因是______________________________________ .
(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因___________________________ 。
(1)黑磷是新型材料,具有类似石墨一样的片层结构(如图),层与层之间以

(2)四(三苯基膦)钯分子结构如下图:


该物质可用于上图所示物质A的合成:物质A中碳原子杂化轨道类型为
(3)PCl5是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子.(该晶体的晶胞如图所示).熔体中P-Cl的键长只有198 nm和206 nm两种,写这两种离子的化学式为

(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】【化学—物质结构与性质】
电石(CaC2)发生如下反应合成尿素[CO(NH2)2],可进一步合成三聚氰胺。

(1)CO(NH2)2分子中含有σ键的个数为______ 。CaCN2中阴离子为CN22-,与CN22-离子互为等电子体的分子的化学式为_______ ,可推知CN22-的空间构型为_________ 。
(2)三聚氰胺在动物体内可转化为三聚氰酸( ),三聚氰酸分子中N原子采取
),三聚氰酸分子中N原子采取______ 杂化。三聚氰胺与三聚氰酸的分子相互之间通过________ 结合,在肾脏内易形成结石。
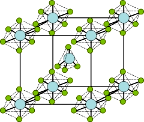
(3)下图是电石的晶胞示意图,则一个晶胞中含有___ 个Ca2+离子,研究表明,C22-的存在使晶胞呈长方体,该晶胞中一个Ca2+周围距离相等且最近的C22-有___ 个。
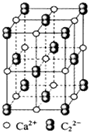
电石(CaC2)发生如下反应合成尿素[CO(NH2)2],可进一步合成三聚氰胺。

(1)CO(NH2)2分子中含有σ键的个数为
(2)三聚氰胺在动物体内可转化为三聚氰酸(
 ),三聚氰酸分子中N原子采取
),三聚氰酸分子中N原子采取(3)下图是电石的晶胞示意图,则一个晶胞中含有

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】硫和碳及其化合物广泛存在于自然界中,并被人们广泛利用。回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生____ ,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________ 。硫所在周期中,第一电离能最大的元素是___________ 。(填元素符号)
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式__________________ 。
(3)H2S中S原子的杂化类型是__________ ;H2S的VSEPR模型名称为_________ ;H2S的键角约为94°,H2O的键角为105°,其原因是___________________________ 。
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有________ 个配位键,___________ 个氢键。
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是_________________________________ 。
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为____ 个,已知石墨的密度为pg·cm-1,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为____ cm。
(1)当基态原子的电子吸收能量后,电子会发生
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式
(3)H2S中S原子的杂化类型是
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】第四周期的元素砷(As)和镍(Ni)具有广泛的应用。回答下列问题:
(1)基态As原子的核外电子排布式为___________ ,As、Ni的第一电离能:I1(As)___________ I1(Ni)(填“大于”“小于”或“等于”)。
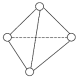
(2)砷单质的气态分子构型如图所示,在其中4条棱上各插入1个硫原子,形成As4S4,俗称雄黄,则雄黄可能有___________ 种不同的结构;0.5 mol As4S4中含有___________ mol As—S键。
(3)亚砷酸(H3AsO3)形成的盐可用作长效杀虫剂和除草剂, 的空间构型为
的空间构型为___________ ;磷和砷同主族,亚磷酸(H3PO3)中心原子磷配位数为4,则亚磷酸为___________ 元酸。
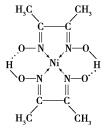
(4)一种Ni2+配合物的结构如图所示,该配合物中的配位数为___________ ,C原子的杂化方式为___________ 。
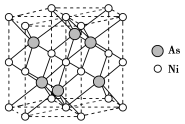
(5)As和Ni形成的一种晶体晶胞中原子堆积方式如图所示,晶体中As原子围成的空间构型为___________ (填 “三角形”“四面体”或“八面体”),图中六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数为NA,则该晶体的密度ρ=___________ g·cm−3。
(1)基态As原子的核外电子排布式为
(2)砷单质的气态分子构型如图所示,在其中4条棱上各插入1个硫原子,形成As4S4,俗称雄黄,则雄黄可能有

(3)亚砷酸(H3AsO3)形成的盐可用作长效杀虫剂和除草剂,
 的空间构型为
的空间构型为(4)一种Ni2+配合物的结构如图所示,该配合物中的配位数为

(5)As和Ni形成的一种晶体晶胞中原子堆积方式如图所示,晶体中As原子围成的空间构型为

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】某绿色农药结构简式为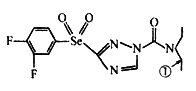 ,回答下列问题。
,回答下列问题。
(1)N元素的基态原子核外有_____ 种空间运动状态的电子,该农药组成元素中,第一电离能较大的前三种元素是(按由大到小顺序排列)________ (用元素符号回答,下同),基态硒原子的价层电子排布式为___________ 。
(2)该物质中,中心原子杂化轨道类型为sp2的原子有_____ ,分子中编号为① 的碳原子和与其成键的另外几个原子构成的空间结构为_________ 。
(3)碳、氢、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。三种物质的沸点高低顺序为CH42H63OH,其原因是________ ,三种物质中属于极性分子的物质是______ , 与CH4互为等电子体的一种微粒是_________ 。
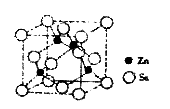
(4)硒化锌的晶胞结构如图所示,则硒的配位数为________ ,若晶胞边长为d pm ,设阿伏伽德罗常数的值为NA,则硒化锌的密度为______ (不必化简)。
 ,回答下列问题。
,回答下列问题。(1)N元素的基态原子核外有
(2)该物质中,中心原子杂化轨道类型为sp2的原子有
(3)碳、氢、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。三种物质的沸点高低顺序为CH42H63OH,其原因是
(4)硒化锌的晶胞结构如图所示,则硒的配位数为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】碳元素在生产生活中具有非常重要的作用,在新物质的制备中也发挥了举足轻重的作用。
(1)与碳同周期,且基态原子的核外未成对电子数相等的元素是______ (写出元素符号)。
(2)石墨烯是目前人们制造的新物质,该物质是由单层碳原子六边形平铺而成的,像一张纸一样(如图甲),石墨烯中碳原子的杂化方式为________ ;常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是___________________ 。

(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O形成的最小环上O原子数目是____________ 。
(4)图丙是C60的晶胞模型(一个小黑点代表一个C60分子),图中显示出的C60分子数为14个。实际上一个C60晶胞中含有________ 个C60分子。
(1)与碳同周期,且基态原子的核外未成对电子数相等的元素是
(2)石墨烯是目前人们制造的新物质,该物质是由单层碳原子六边形平铺而成的,像一张纸一样(如图甲),石墨烯中碳原子的杂化方式为

(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O形成的最小环上O原子数目是
(4)图丙是C60的晶胞模型(一个小黑点代表一个C60分子),图中显示出的C60分子数为14个。实际上一个C60晶胞中含有
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】世界上最早发现并使用锌的是中国,明朝末年《天工开物》一书中有关于炼锌技术的记载。回答下列问题
(1)硫酸锌溶于过量的氨水可形成配合物[Zn(NH3)4]SO4。
①配合物[Zn(NH3)4]SO4中,[Zn(NH3)4]2+的名称是____________ 。
② 中,中心原子的轨道杂化类型为
中,中心原子的轨道杂化类型为____________ 。
③NH3极易溶于水,除了因为它们都是极性分子外还因为____________ 。
(2)Zn2+的4s和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]2-的空间构型为____________ 。
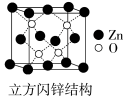
(3)氧化锌的结构有多种,其中一种立方闪锌矿的结构如图所示,若该晶胞的边长为anm,NA为阿伏加 德罗常数的值则立方闪锌矿晶体的密度为____________ g•cm-3。
(1)硫酸锌溶于过量的氨水可形成配合物[Zn(NH3)4]SO4。
①配合物[Zn(NH3)4]SO4中,[Zn(NH3)4]2+的名称是
②
 中,中心原子的轨道杂化类型为
中,中心原子的轨道杂化类型为③NH3极易溶于水,除了因为它们都是极性分子外还因为
(2)Zn2+的4s和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]2-的空间构型为
(3)氧化锌的结构有多种,其中一种立方闪锌矿的结构如图所示,若该晶胞的边长为anm,NA为阿伏加 德罗常数的值则立方闪锌矿晶体的密度为

您最近一年使用:0次



