2017届江西省九江市十校高三第二次联考理科综合化学试卷
江西
高三
二模
2017-03-28
437次
整体难度:
适中
考查范围:
认识化学科学、有机化学基础、化学与STSE、化学反应原理、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
| A.福尔马林可浸制标本,因其可使蛋白质变性的性质 |
| B.向牛奶中加入果汁会产生沉淀,这是因为发生了酸碱中和反应 |
| C.将地沟油制成肥皂,可以提高资源的利用率 |
| D.用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |
A.0.5 mol Cu与足量的S反应转移电子数为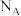 |
B.在粗铜精炼的实验中,阳极质量减小6.4g,则电解过程中转移电子数为0.2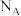 |
C.2 g D2O和H218O的混合物中含有的中子数为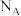 |
D.46 g 有机物C2H6O中含有极性共价键的数目一定为7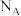 |
| A.4种 | B.8种 | C.12种 | D.16种 |
【知识点】 同分异构体的数目的确定解读 羧酸酯化反应解读
序号 | 操作和现象 | 结论 |
A | 取少量BaSO4固体于试管中,加入足量的盐酸,沉淀不溶解。 | BaSO4不溶于盐酸,且可以用盐酸 和BaCl2溶液检验SO42- |
B | 往乙醇中加入适量浓硫酸制备乙烯, 并将产生的气体直接通入酸性高锰酸钾溶液中,溶液紫红 并将产生的气体直接通入酸性高锰酸钾溶液中,溶液紫红 色褪去 色褪去 | 证明乙烯能被酸性高锰酸钾氧化 |
C | 常温下,测得饱和NaA溶液的pH大于饱和NaB溶液 | 常温下水解程度:A﹣>B﹣ |
D | 在分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,且上层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| A.A | B.B | C.C | D.D |
【知识点】 盐类水解的应用 乙醇与强氧化剂的反应解读 常见阴离子的检验解读
二、未知 添加题型下试题
 和
和 为原料的新型电池的工作原理如图所示。下列说法错误的是
为原料的新型电池的工作原理如图所示。下列说法错误的是
A.电池的负极反应为 |
B.电池放电时 从b极区移向a极区 从b极区移向a极区 |
| C.电子从电极a经外电路流向电极b |
D.放电一段时间后,正负两极生成的 和消耗的 和消耗的 的量相等 的量相等 |
三、单选题 添加题型下试题
| A.W元素最高价氧化物对应的水化物化学式为H2WO3 |
| B.元素Y和W的非金属性强弱比较:Y<W |
| C.原子半径由小到大的顺序为:Y<X<Z<W |
| D.X能分别与Y、W形成AB2型的化合物 |
【知识点】 元素金属性与非金属性递变规律的理解及应用解读


| A.a点时溶液的pH<1 |
| B.a点到b点的过程中,溶液的导电能力减弱 |
C.ab段上的点(不包括a点)均满足关系式:c (NH4+)+c(Na+)<2c(SO42-) (NH4+)+c(Na+)<2c(SO42-) |
| D.b点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+)> c(H+)> c(OH-) |
四、解答题 添加题型下试题
 2Fe2O3 +8FeCl3。回答下列问题:
2Fe2O3 +8FeCl3。回答下列问题: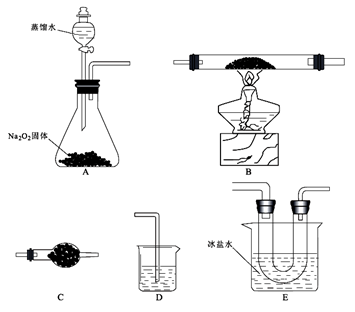
(1)仪器C的名称
(2)E装置的作用是
(3)反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为
(4)待B中充分反应后,停止加热,仍继续通入氧气直至反应管冷却。则停止加热前是否需要先将D中导管口移出水面,为什么?
(5)设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱:
②利用E装置U形管里的固体,配成溶液,制得某种胶体,写出制备该胶体的化学方程式
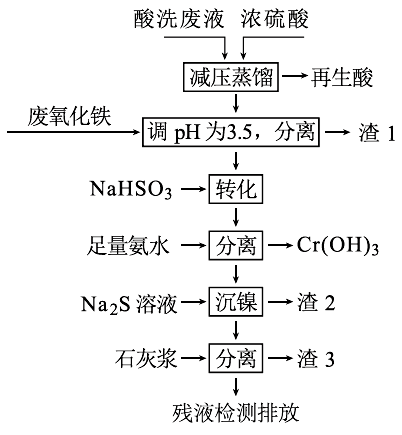
已知:
金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3
 [Ni(NH3)6]2+
[Ni(NH3)6]2+(1)再生酸中含有HNO3,采取减压蒸馏的目的为
(2)滤渣1的主要成份为:
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和
(6)经检测,最后的残液中c(Ca2+)=0.001 mol•L-1,则残液中F-浓度为
(1)①氯胺(NH2Cl)的电子式为

②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为
(2)用焦炭还原NO的反应为:2NO(g)+C(s)
 N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该反应为
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)=
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)
 N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)
②A、B、C三点中NO2的转化率最高的是
③计算C点时该反应的压强平衡常数Kp(C)=
【知识点】 化学反应热的计算 盖斯定律及其有关计算 化学平衡的有关计算
五、填空题 添加题型下试题
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为
(4)化合物D2A的立体构型为
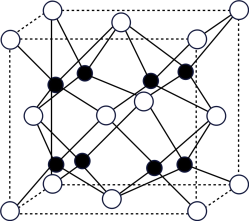
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为
六、解答题 添加题型下试题
12. 以重要的化工原料A(C2H2)合成有机物E和 的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
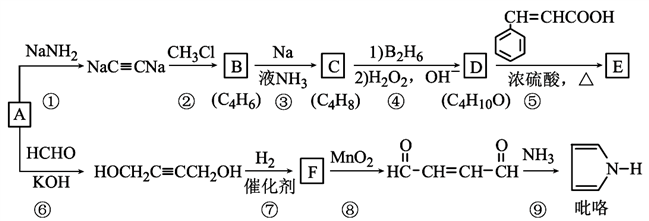
(1)B的系统命名是
(2)⑤的反应类型是
(3)反应⑧产物与新制Cu(OH)2的化学方程式为
(4)符合下列条件肉桂酸( )的同分异构体共
)的同分异构体共
(5)参照上述合成路线,设计一条由丙炔和甲醛为起始原料制备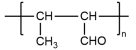 的合成路线
的合成路线
试卷分析
试卷题型(共 12题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 胶体的性质和应用 油脂在碱性条件下水解 蛋白质的变性 化学科学对人类文明发展的意义 | |
| 2 | 0.65 | 阿伏加德罗常数的应用 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 电解池有关计算 | |
| 3 | 0.65 | 同分异构体的数目的确定 羧酸酯化反应 | |
| 4 | 0.4 | 盐类水解的应用 乙醇与强氧化剂的反应 常见阴离子的检验 | |
| 6 | 0.65 | 元素金属性与非金属性递变规律的理解及应用 | |
| 7 | 0.4 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、未知 | |||
| 5 | 0.4 | 新型电池 | 未知 |
| 三、解答题 | |||
| 8 | 0.4 | 综合实验设计与评价 | 实验探究题 |
| 9 | 0.4 | 离子方程式的书写 与氧化剂、还原剂有关的计算 溶度积常数相关计算 物质分离、提纯综合应用 | 工业流程题 |
| 10 | 0.65 | 化学反应热的计算 盖斯定律及其有关计算 化学平衡的有关计算 | 原理综合题 |
| 12 | 0.4 | 烯烃、炔烃的命名 根据要求书写同分异构体 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |
| 四、填空题 | |||
| 11 | 0.4 | 电子排布式 价层电子对互斥理论 杂化轨道理论 晶胞的有关计算 | |



