氮气化学性质很稳定,可以通过氮的固定将空气中的氮气转化氮的化合物。氮的化合物可用于进一步合成化肥、炸药以及合成树脂等。
(1)写出氮分子的电子式______________。
(2)人工合成氨反应为N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol,在一定条件下的恒容密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填序号)。
2NH3(g) △H=-92.4kJ/mol,在一定条件下的恒容密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填序号)。
E.增加H2的浓度
(3)氨的接触氧化制取硝酸的过程中,900℃时,氨氧化反应阶段可能发生的反应有
反应Ⅲ的△H3=____________(用△H1、△H2表示);反应Ⅱ的平衡常数的表达式K2=__________;
该温度下K3的计算结果为__________。
(4)催化反硝法可用于治理水中硝酸盐的污染。催化反硝法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。反应的离子方程式为____________________________;其平均反应速率为v(NO3-)______________mol/(L•min)。
(5)实验室用下图所示装置制取NH3。若将收集NH3的试管改为集气瓶且瓶口向上排空气法收集NH3,并确保不污染环境,请画出其气体收集装置和尾气吸收装置,标出所用试剂(自选)名称。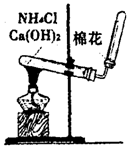
(1)写出氮分子的电子式______________。
(2)人工合成氨反应为N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ/mol,在一定条件下的恒容密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填序号)。
2NH3(g) △H=-92.4kJ/mol,在一定条件下的恒容密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填序号)。| A.分离出NH3 |
| B.加入催化剂 |
| C.升高温度 |
| D.增加N2的浓度 |
E.增加H2的浓度
(3)氨的接触氧化制取硝酸的过程中,900℃时,氨氧化反应阶段可能发生的反应有
| 编号 | 热化学方程式 | 平衡常数 |
| Ⅰ | 4NH3(g)+5O2(g) 4NO(g)+6H2O (g) △H1 4NO(g)+6H2O (g) △H1 | K1=1×1053 |
| Ⅱ | 4NH3(g)+3O2(g) 2N2(g)+6H2O (g) △H2 2N2(g)+6H2O (g) △H2 | K2=1×1065 |
| Ⅲ | 2NO(g) N2(g)+O2(g) △H3 N2(g)+O2(g) △H3 | K3 |
反应Ⅲ的△H3=____________(用△H1、△H2表示);反应Ⅱ的平衡常数的表达式K2=__________;
该温度下K3的计算结果为__________。
(4)催化反硝法可用于治理水中硝酸盐的污染。催化反硝法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。反应的离子方程式为____________________________;其平均反应速率为v(NO3-)______________mol/(L•min)。
(5)实验室用下图所示装置制取NH3。若将收集NH3的试管改为集气瓶且瓶口向上排空气法收集NH3,并确保不污染环境,请画出其气体收集装置和尾气吸收装置,标出所用试剂(自选)名称。

更新时间:2016-12-09 08:16:40
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】H2O2在Fe2+、Cu2+的存在下生成具有强氧化性的•OH(羟基自由基),•OH可将有机物氧化降解。
(1)Cu2+H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)═CuOOH+(aq)+H+(aq)△H1=a kJ•mol﹣1
CuOOH+(aq)═Cu+(aq)+•OH(aq)+1/2O2(g)△H2=b kJ•mol﹣1
2CuOOH+(aq)═2Cu+(aq)+H2O2(aq)+O2(g)△H3=c kJ•mol﹣1
则H2O2(aq)═2•OH(aq)△H=_____ kJ•mol﹣1。
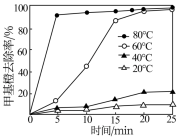
(2)为探究温度对Cu2+H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除速率增大,其原因是_____ 。
(3)为探究Fe2+Cu2+H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+Cu2+H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为_____ 。
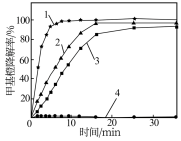
实验条件:200 mL甲基橙模拟废水(1.5 g•L﹣1,pH=3.0),温度60℃、V(H2O2)=2.0 mL
1﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
2﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
3﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
4﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
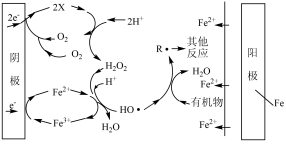
(4)EFH2O2FeOx法可用于水体中有机污染物降解,其反应机理如下图所示。阳极的电极反应式为_____ ,X微粒的化学式为_____ ,阴极附近Fe2+参与反应的离子方程式为_____ 。
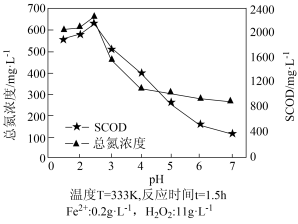
(5)SCOD是指溶解性化学需氧量,是衡量水中有机物质含量多少的指标。水体SCOD越大,说明其有机物含量越高。用Fe2+H2O2法氧化破解啤酒工业污泥中的微生物,释放出有机物和氮等。测得不同初始pH下污泥经氧化破解后上层清液中的SCOD及总氮浓度如上图所示。当pH>2.5时,总氮浓度、SCOD均降低,其原因可能是_____ 。
(1)Cu2+H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)═CuOOH+(aq)+H+(aq)△H1=a kJ•mol﹣1
CuOOH+(aq)═Cu+(aq)+•OH(aq)+1/2O2(g)△H2=b kJ•mol﹣1
2CuOOH+(aq)═2Cu+(aq)+H2O2(aq)+O2(g)△H3=c kJ•mol﹣1
则H2O2(aq)═2•OH(aq)△H=

(2)为探究温度对Cu2+H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除速率增大,其原因是
(3)为探究Fe2+Cu2+H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+Cu2+H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为

实验条件:200 mL甲基橙模拟废水(1.5 g•L﹣1,pH=3.0),温度60℃、V(H2O2)=2.0 mL
1﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
2﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
3﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
4﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
(4)EFH2O2FeOx法可用于水体中有机污染物降解,其反应机理如下图所示。阳极的电极反应式为


(5)SCOD是指溶解性化学需氧量,是衡量水中有机物质含量多少的指标。水体SCOD越大,说明其有机物含量越高。用Fe2+H2O2法氧化破解啤酒工业污泥中的微生物,释放出有机物和氮等。测得不同初始pH下污泥经氧化破解后上层清液中的SCOD及总氮浓度如上图所示。当pH>2.5时,总氮浓度、SCOD均降低,其原因可能是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
已知:①CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为__________________________ ;
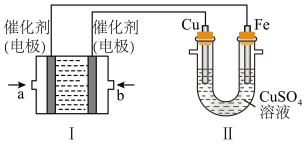
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。_____ (填“CH4”或“O2”),b处电极上发生的电极反应式是______________ ;
②电镀结束后,装置Ⅰ中KOH溶液的浓度________ (填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________ ;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________ ;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗氧气________ L(标准状况下)。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
已知:①CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
②电镀结束后,装置Ⅰ中KOH溶液的浓度
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗氧气
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】已知下列热化学方程式,回答下列各问:
① C(s)+1/2O2(g)=CO(g) ΔH =—110.4 kJ/mol
② C(s)+ O2(g)=CO2(g) ΔH =—393.5 kJ/mol
(1)C的燃烧热为______ kJ/mol 。
(2)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧热的热化学方程式__________________________________________________ 。
(3)工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OCH3(g)+H2O(g) = 2CH3OH(g) ΔH2=+23.4 kJ·mol-1
则2CO2(g)+6H2(g) = CH3OCH3(g)+3H2O(g) ΔH3=________ kJ·mol-1。
(4)在恒温(500K)、体积为1.0L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 + 3H2 2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为
2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为___________________________________ 。
① C(s)+1/2O2(g)=CO(g) ΔH =—110.4 kJ/mol
② C(s)+ O2(g)=CO2(g) ΔH =—393.5 kJ/mol
(1)C的燃烧热为
(2)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧热的热化学方程式
(3)工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OCH3(g)+H2O(g) = 2CH3OH(g) ΔH2=+23.4 kJ·mol-1
则2CO2(g)+6H2(g) = CH3OCH3(g)+3H2O(g) ΔH3=
(4)在恒温(500K)、体积为1.0L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 + 3H2
 2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为
2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】按要求回答下列问题:
(1)硝基苯甲酸乙酯在 存在下发生水解反应:
存在下发生水解反应: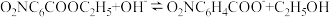 两种反应物的初始浓度均为
两种反应物的初始浓度均为 ,
,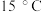 时测得
时测得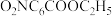 的转化率
的转化率 随时间变化的数据如表所示。
随时间变化的数据如表所示。
列式计算该反应在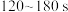 与
与 区间的平均反应速率
区间的平均反应速率__________ 、__________ ;比较两者大小可得出的结论是____________ 。
(2)煤燃烧排放的烟气含有 和
和 ,形成酸雨、污染大气,采用
,形成酸雨、污染大气,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有 和
和 的烟气,反应温度
的烟气,反应温度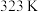 ,
, 溶液浓度为
溶液浓度为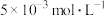 。反应一段时间后溶液中离子浓度的分析结果如下表。
。反应一段时间后溶液中离子浓度的分析结果如下表。
由实验结果可知,脱硫反应速率_________ 脱硝反应速率(填“大于”或“小于”)。原因是除了 和
和 在烟气中的初始浓度不同,还可能是
在烟气中的初始浓度不同,还可能是________ 。
(3)写出 与硫酸反应的化学方程式
与硫酸反应的化学方程式____________ 。为提高反应速率,除适当增加硫酸浓度外,还可采取的措施有_______________ 。
(1)硝基苯甲酸乙酯在
 存在下发生水解反应:
存在下发生水解反应: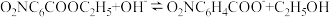 两种反应物的初始浓度均为
两种反应物的初始浓度均为 ,
,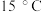 时测得
时测得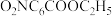 的转化率
的转化率 随时间变化的数据如表所示。
随时间变化的数据如表所示。| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
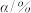 | 0 | 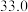 | 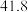 |  |  | 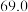 | 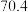 | 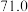 | 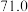 |
列式计算该反应在
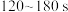 与
与 区间的平均反应速率
区间的平均反应速率(2)煤燃烧排放的烟气含有
 和
和 ,形成酸雨、污染大气,采用
,形成酸雨、污染大气,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有 和
和 的烟气,反应温度
的烟气,反应温度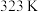 ,
, 溶液浓度为
溶液浓度为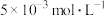 。反应一段时间后溶液中离子浓度的分析结果如下表。
。反应一段时间后溶液中离子浓度的分析结果如下表。| 离子 |  |  |  |  |  |
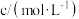 | 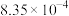 |  | 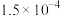 | 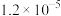 |  |
由实验结果可知,脱硫反应速率
 和
和 在烟气中的初始浓度不同,还可能是
在烟气中的初始浓度不同,还可能是(3)写出
 与硫酸反应的化学方程式
与硫酸反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】某可逆反应在不同反应时间各物质的物质的量的变化情况如下图所示。
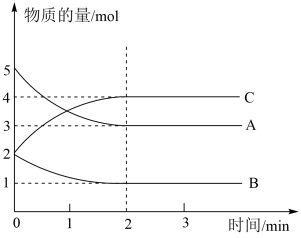
回答下列问题:
(1)该反应的反应物是________ ,生成物是________ ,化学方程式为_____________________ 。
(2)反应开始至2 min时,能否用C的浓度变化来计算反应速率?为什么?________________________________________________________________________ 。
(3)2 min后,A、B、C的物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了______________ 状态。

回答下列问题:
(1)该反应的反应物是
(2)反应开始至2 min时,能否用C的浓度变化来计算反应速率?为什么?
(3)2 min后,A、B、C的物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:
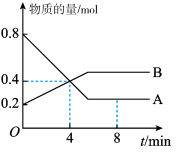
①该反应的化学方程式为_____________ 。
②反应开始至4 min时,B的平均反应速率为_______ ,A的转化率为_________ 。
③4 min时,反应是否达到平衡状态?_____ (填“是”或“否”),8 min时,v (正)______ v (逆) (填“>”、“<”或“=”)
(2)下图表示在密闭容器中反应:2SO2(g) + O2(g) 2SO3(g) △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是
2SO3(g) △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是____________ 。

①该反应的化学方程式为
②反应开始至4 min时,B的平均反应速率为
③4 min时,反应是否达到平衡状态?
(2)下图表示在密闭容器中反应:2SO2(g) + O2(g)
 2SO3(g) △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是
2SO3(g) △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。Deacon发明的直接氧化法:4HCl(g)+O2(g)  2Cl2(g)+2H2O(g) ∆H <0.回答下列问题:
2Cl2(g)+2H2O(g) ∆H <0.回答下列问题:
(1)该反应平衡常数表达式为_____
(2)下列措施中,能提高中O2转化率的有
(3)恒温恒容时,下列能作为反应达到平衡判据的是_____
A.HCl和O2的转化率之比为4:1 B.气体的压强不变 C.K不变 D.2v正(O2)=v逆(Cl2) E.容器内气体的密度不变 F.容器内气体的平均相对分子质量不变
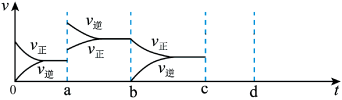
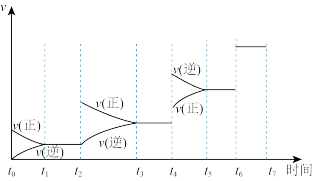
(4)恒容条件下,反应达到平衡后改变某一条件,反应速率(v)与时间(t)的关系如图所示,t4~t5引起变化的原因可能是___________ ; H2O(g)的浓度最高的时间段是___________ ;t6引起变化的原因可能是___________ 。
 2Cl2(g)+2H2O(g) ∆H <0.回答下列问题:
2Cl2(g)+2H2O(g) ∆H <0.回答下列问题:(1)该反应平衡常数表达式为
(2)下列措施中,能提高中O2转化率的有
| A.使用过量HCl | B.升高温度 | C.增大压强 | D.使用催化剂 |
A.HCl和O2的转化率之比为4:1 B.气体的压强不变 C.K不变 D.2v正(O2)=v逆(Cl2) E.容器内气体的密度不变 F.容器内气体的平均相对分子质量不变
(4)恒容条件下,反应达到平衡后改变某一条件,反应速率(v)与时间(t)的关系如图所示,t4~t5引起变化的原因可能是

您最近一年使用:0次
【推荐2】下列反应在210℃达到平衡:
①PCl5(g) PCl3(g)+Cl2(g) ΔH>0,K=1;
PCl3(g)+Cl2(g) ΔH>0,K=1;
②CO(g)+Cl2(g) COCl2(g) ΔH<0,K=5×104;
COCl2(g) ΔH<0,K=5×104;
③COCl2(g) CO(g)+Cl2(g);
CO(g)+Cl2(g);
(1)根据反应①的平衡常数K表达式,下列等式必定成立的是____ 。
A.c(PCl5)=c(PCl3)=c(Cl2)=1 B.c(PCl5)=c(PCl3)∙c(Cl2)=1
C.c(PCl5)=c(PCl3)∙c(Cl2)
反应②和反应③的平衡常数K表达式________ (填“相同”或“不同”)。
(2)降低Cl2的浓度,反应③的K值________ (填“增大”“减小”或“不变”)。
(3)要使反应①和反应②的K值相等,应采取的措施是________ 。
A.反应①②同时升温 B.反应①②同时降温
C.反应①降温,反应②维持在210℃
①PCl5(g)
 PCl3(g)+Cl2(g) ΔH>0,K=1;
PCl3(g)+Cl2(g) ΔH>0,K=1;②CO(g)+Cl2(g)
 COCl2(g) ΔH<0,K=5×104;
COCl2(g) ΔH<0,K=5×104;③COCl2(g)
 CO(g)+Cl2(g);
CO(g)+Cl2(g);(1)根据反应①的平衡常数K表达式,下列等式必定成立的是
A.c(PCl5)=c(PCl3)=c(Cl2)=1 B.c(PCl5)=c(PCl3)∙c(Cl2)=1
C.c(PCl5)=c(PCl3)∙c(Cl2)
反应②和反应③的平衡常数K表达式
(2)降低Cl2的浓度,反应③的K值
(3)要使反应①和反应②的K值相等,应采取的措施是
A.反应①②同时升温 B.反应①②同时降温
C.反应①降温,反应②维持在210℃
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
请回答下列问题:
(1)该反应的平衡常数表达式K =_________________ 。
(2)该反应为________ 反应(填“吸热”或“放热”)。
(3)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01 mol/L,c(H2O)=0.03 mol/L, c(CO2)=0.01mol/L,c(H2)=0.05mol/L ,则反应开始时,H2O的消耗速率比生成速率___ (填“大”、“小”或“不能确定”)。
(4)830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为_______ ,H2的转化率为_______ 。
 CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下: | t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的平衡常数表达式K =
(2)该反应为
(3)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01 mol/L,c(H2O)=0.03 mol/L, c(CO2)=0.01mol/L,c(H2)=0.05mol/L ,则反应开始时,H2O的消耗速率比生成速率
(4)830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为
您最近一年使用:0次
【推荐1】工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列说法能说明上述反应向正反应方向进行的是
2NH3(g),下列说法能说明上述反应向正反应方向进行的是____________________ (填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2 h时放出的热量为_________________ kJ。
②此温度下该反应的化学平衡常数K=_________________ (保留两位小数)。
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________________ 方向移动(填“正反应”或“逆反应”或“不移动”)。
④有甲、乙两个完全相同的容器,向甲容器中加入1 mol N2(g)和6mol H2(g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2 mol NH3(g)和3mol H2(g),达到平衡时的热效应(放热或吸热)为4Q。则甲容器中H2的转化率为________________ 。
 2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)
 2NH3(g),下列说法能说明上述反应向正反应方向进行的是
2NH3(g),下列说法能说明上述反应向正反应方向进行的是①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为
②此温度下该反应的化学平衡常数K=
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向
④有甲、乙两个完全相同的容器,向甲容器中加入1 mol N2(g)和6mol H2(g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2 mol NH3(g)和3mol H2(g),达到平衡时的热效应(放热或吸热)为4Q。则甲容器中H2的转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】 和CO是常见的环境污染性气体。
和CO是常见的环境污染性气体。
(1)对于反应 来说,“
来说,“ ”可作为此反应的催化剂。其总反应分两步进行,第一步为
”可作为此反应的催化剂。其总反应分两步进行,第一步为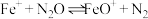 ,则第二步反应为
,则第二步反应为_______ 。已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能_______ (填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应: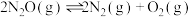 ,容器Ⅰ、Ⅱ、Ⅲ中
,容器Ⅰ、Ⅱ、Ⅲ中 的平衡转化率如图乙所示。
的平衡转化率如图乙所示。

①该反应的
_______ (填“ ”或“
”或“ ”)0。
”)0。
②若容器Ⅰ的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器Ⅰ中用 表示的反应速率为
表示的反应速率为_______ 。B点对应的平衡常数
_______ (保留两位有效数字)。
③若容器Ⅳ的体积为1L,反应在370℃下进行,则起始时反应_______ (填“向正反应方向”“向逆反应方向”或“不”)进行。
 和CO是常见的环境污染性气体。
和CO是常见的环境污染性气体。(1)对于反应
 来说,“
来说,“ ”可作为此反应的催化剂。其总反应分两步进行,第一步为
”可作为此反应的催化剂。其总反应分两步进行,第一步为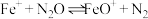 ,则第二步反应为
,则第二步反应为(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:
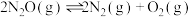 ,容器Ⅰ、Ⅱ、Ⅲ中
,容器Ⅰ、Ⅱ、Ⅲ中 的平衡转化率如图乙所示。
的平衡转化率如图乙所示。
①该反应的

 ”或“
”或“ ”)0。
”)0。②若容器Ⅰ的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器Ⅰ中用
 表示的反应速率为
表示的反应速率为
③若容器Ⅳ的体积为1L,反应在370℃下进行,则起始时反应
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氨是最重要的氮肥,也是产量最大的化工产品之一。
(1)在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1_______ K2 (填“ ”、“
”、“ ”或“
”或“ ”);
”);
②400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为_______ 。当测得NH3、N2和H2物质的量分别为2mol、2mol和1mol时,则该反应的v(N2)正_______ v(N2)逆(填“>”、“<”或“=”)。
(2)可用作合成氨的催化剂有很多,如Os、Fe、Pt、Mn、Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如下:

注:方框内包含微粒种类及个数、微粒的相对总能量(括号里的数字单位:eV)其中,TS表示过渡态,*表示吸附态。
①请写出N2参与化学吸附的反应方程式:_______ ;
②以上历程须克服的最大势垒为_______ kJ·mol-1(计算结果保留2位小数)。(已知:1eV=1.6×10-22 kJ)
(3)标准平衡常数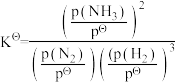 ,其中pΘ为标准压强(1×105 Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,平衡分压=平衡体积分数×总压。若N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,N2的平衡转化率为ω,则KΘ=
,其中pΘ为标准压强(1×105 Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,平衡分压=平衡体积分数×总压。若N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,N2的平衡转化率为ω,则KΘ=_______ (用含ω的表达式表示)。
(1)在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
 ”、“
”、“ ”或“
”或“ ”);
”);②400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为(2)可用作合成氨的催化剂有很多,如Os、Fe、Pt、Mn、Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如下:

注:方框内包含微粒种类及个数、微粒的相对总能量(括号里的数字单位:eV)其中,TS表示过渡态,*表示吸附态。
①请写出N2参与化学吸附的反应方程式:
②以上历程须克服的最大势垒为
(3)标准平衡常数
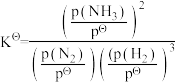 ,其中pΘ为标准压强(1×105 Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,平衡分压=平衡体积分数×总压。若N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,N2的平衡转化率为ω,则KΘ=
,其中pΘ为标准压强(1×105 Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,平衡分压=平衡体积分数×总压。若N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,N2的平衡转化率为ω,则KΘ=
您最近一年使用:0次



