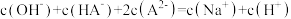25℃时,用0.1000mol·L-1NaOH溶液滴定20mL0.1000mol·L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示。下列说法正确的是
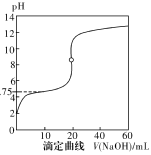

| A.当滴入40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| B.当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+) |
| C.当滴入NaOH溶液20mL时c(OH-)>c(H+)+c(HA) |
| D.当滴定到pH=4.75时,c(A-)=c(HA) |
更新时间:2016-12-09 09:37:50
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】用0.1000 mol-1的NaOH溶液分别滴定0.1000 mol/L、20.00mLHX、HY、HZ三种酸溶液。溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是


| A.HX为一元强酸,电离常数Ka(HY)>Ka(HZ) |
| B.a.b.c三点中,b点所对应的水溶液里阴离子的物质的量浓度最大 |
| C.d点所对应的水溶液里,c(OH-)约为0.02 mol/L |
| D.滴定时可使用酚酞作指示剂 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,将NaOH溶液滴加到等物质的量浓度的HX、HY两种酸溶液中,混合溶液的pH与离子浓度的关系如图所示。下列说法错误的是

| A.HX的酸性比HY强 |
| B.Ka(HY)的数量级为10-4 |
| C.b点溶液中c(Y-)一定大于a点溶液中c(X-) |
| D.a、b两点溶液中c(Na+)的差值为c(X-)-c(Y-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
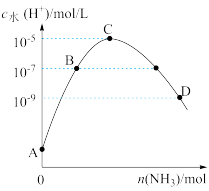
【推荐1】25℃条件下,向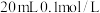 的盐酸中不断通
的盐酸中不断通 ,该过程中水电离出的氢离子浓度
,该过程中水电离出的氢离子浓度 水
水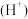 与通入
与通入 的物质的量关系如图,下列说法不正确的是( )。
的物质的量关系如图,下列说法不正确的是( )。
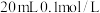 的盐酸中不断通
的盐酸中不断通 ,该过程中水电离出的氢离子浓度
,该过程中水电离出的氢离子浓度 水
水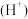 与通入
与通入 的物质的量关系如图,下列说法不正确的是( )。
的物质的量关系如图,下列说法不正确的是( )。
A. 点的纵坐标为 点的纵坐标为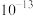 |
B. 点溶液中 点溶液中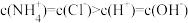 |
C. 点溶液中 点溶液中 |
D. 点溶液的 点溶液的 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,向一定浓度二元弱酸H2A溶液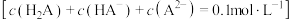 中滴加NaOH溶液,滴加过程中
中滴加NaOH溶液,滴加过程中 的分布系数[如
的分布系数[如 的分布系数
的分布系数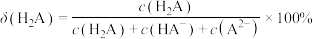 ]与溶液pH的关系如图所示。
]与溶液pH的关系如图所示。
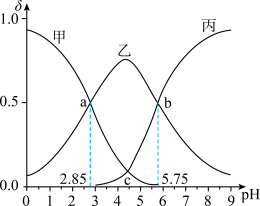
下列说法正确的是
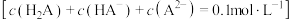 中滴加NaOH溶液,滴加过程中
中滴加NaOH溶液,滴加过程中 的分布系数[如
的分布系数[如 的分布系数
的分布系数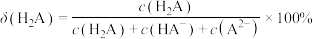 ]与溶液pH的关系如图所示。
]与溶液pH的关系如图所示。
下列说法正确的是
A.曲线乙代表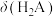 与pH的关系 与pH的关系 |
| B.第一次滴定突跃点可以选择酚酞作指示剂 |
C.a点溶液中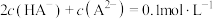 |
D.常温下,c点溶液中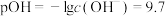 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】已知肼(N2H4)在水中的电离与NH3相似,常温下,向N2H4的水溶液中滴加某种浓度的盐酸,测得溶液的pH与离子浓度的关系如图所示,下列说法不正确的是
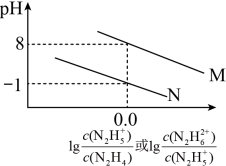

| A.N2H4在水溶液中的第二步电离平衡常数Kb2为10-15 |
| B.N2H5Cl溶液中c(H+)>c(OH-) |
C.反应N2H +N2H4 +N2H4 2N2H 2N2H 的平衡常数为109 的平衡常数为109 |
D.N2H5Cl2溶液中存在:c(Cl-)=c(N2H )+c(N2H )+c(N2H )+c(H+) )+c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】已知:H3PO4的电离是分步进行的,室温下Ka1=7.6×10-3,Ka2=6.3×10-8,Ka3=4.4×10-13。下列说法不正确 的是
| 实验 | 实验操作 |
| 1 | 向0.1 mol·L-1的H3PO4溶液中通入HCl气体至pH=1(忽略溶液体积的变化) |
| 2 | 浓度均为0.1 mol·L-1的H3PO4溶液和NaOH溶液按照体积比1∶2混合 |
| 3 | 向足量的NaH2PO4溶液滴入少量Na2CO3溶液有气泡产生 |
| 4 | 在H3PO4溶液中逐滴加入NaOH溶液至pH=11 |
| A.实验1溶液中大约有7.6%的H3PO4电离 |
B.实验2溶液中存在:c(H+) + c(H2PO )+2c(H3PO4) =c(PO )+2c(H3PO4) =c(PO )+ c(OH-) )+ c(OH-) |
C.实验3反应的离子方程式为:CO +2H2PO +2H2PO = 2HPO = 2HPO +CO2↑+H2O +CO2↑+H2O |
D.实验4溶液中存在:c(PO )> c(HPO )> c(HPO ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,0.2mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法不正确的是
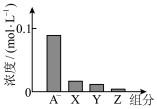

| A.c(OH-)>c(H+) |
| B.c(OH-)=c(H+)+c(HA) |
| C.该溶液对水的电离有促进作用 |
| D.该混合溶液中:c(A-)+c(Y)=0.2mol·L-1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】常温下,向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是
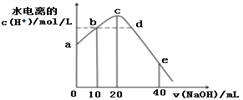

| A.从a到c,对醋酸的电离既有促进作用也有抑制作用 |
| B.b、d两点溶液的pH相同 |
| C.e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) = 0.01mol/L |
| D.从b→d的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点 |
您最近一年使用:0次


 、III代表
、III代表 ,横坐标表示加入NaOH溶液的体积)。根据图示判断下列说法不正确的是
,横坐标表示加入NaOH溶液的体积)。根据图示判断下列说法不正确的是
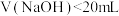
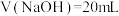 ,溶液中离子浓度的大小:
,溶液中离子浓度的大小: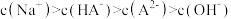
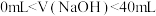 ,一定有:
,一定有: