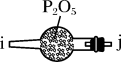
氯化锶晶体在工业上常用作铝的缓蚀剂。工业上一般用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl2·6H2O)的过程为:
已知:Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
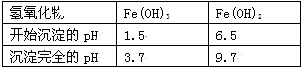
Ⅱ. 有关氢氧化物开始沉淀和完全沉淀的pH如下表:
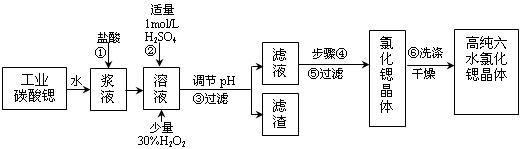
(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是______________________ 。碳酸锶与盐酸反应的化学方程式为______________________ 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为__________ 。能否用新制氯水代替双氧水__________ (填“能”或“否”)。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至__________ ;宜用的试剂为__________ 。
A.1.5 B.4 C.9.7
D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体 G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是_______________________ (填化学式)。
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是_____________________ 。
(6)步骤⑥中,洗涤氯化锶晶体最好选用_____________ 。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液

已知:Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ. 有关氢氧化物开始沉淀和完全沉淀的pH如下表:

(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为
(3)在步骤②-③的过程中,将溶液的pH值由1调节至
A.1.5 B.4 C.9.7
D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体 G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是
(6)步骤⑥中,洗涤氯化锶晶体最好选用
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
更新时间:2016/12/09 16:01:37
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
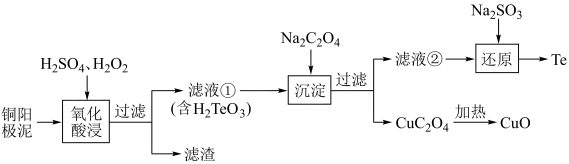
【推荐1】工业上常用铜阳极泥[主要成分是碲化亚铜(Cu2Te),含少量的Ag、Au]回收碲和氧化铜,其工艺流程如图:
②CuC2O4的Ksp为2.2×108
(1)Cu位于元素周期表第_______ 周期第_______ 族。TeO 的空间构型为
的空间构型为_______ 。
(2)“氧化酸浸”步骤的氧化产物为_______ ,“滤渣”的成分是_______ 。该步H2O2的实际用量通常比理论用量更大,原因可能是_______ 。
(3)“沉淀”步骤,若要使Cu2+完全沉淀(离子浓度小于1×10-5mol/L),应控制C2O 的浓度不低于
的浓度不低于________ 。
(4)“还原”步骤反应的离子方程式为_______ 。
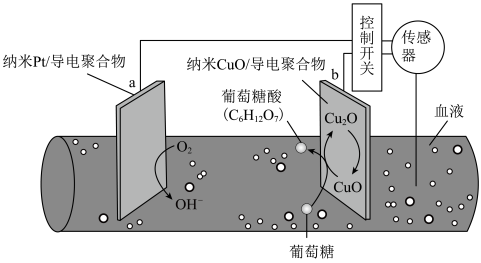
(5)CuO可催化消耗血糖,从而控制血糖浓度。一种可植入体内的微型电池工作原理如图所示,当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作。(血糖浓度以葡萄糖浓度计)________ 。
②CuC2O4的Ksp为2.2×108
(1)Cu位于元素周期表第
 的空间构型为
的空间构型为(2)“氧化酸浸”步骤的氧化产物为
(3)“沉淀”步骤,若要使Cu2+完全沉淀(离子浓度小于1×10-5mol/L),应控制C2O
 的浓度不低于
的浓度不低于(4)“还原”步骤反应的离子方程式为
(5)CuO可催化消耗血糖,从而控制血糖浓度。一种可植入体内的微型电池工作原理如图所示,当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作。(血糖浓度以葡萄糖浓度计)
您最近一年使用:0次
【推荐2】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废铝片制备七铝十二钙的工艺如图:
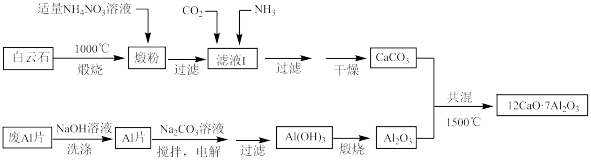
(1)煅粉主要含CaO和____ 。
(2)用NaOH溶液可除去废Al片表面的氧化膜,写出反应的离子方程式为____ 。
(3)写出1500℃共混的化学反应方程式____ 。
(4)用适量的NH4NO3溶液浸取煅粉后,恢复到25℃时镁化合物几乎不溶,若滤液I中c(Mg2+)小于5×10-6 mol·L-1,则溶液pH大于____ (Mg(OH)2的Ksp=5×10-12)。

(1)煅粉主要含CaO和
(2)用NaOH溶液可除去废Al片表面的氧化膜,写出反应的离子方程式为
(3)写出1500℃共混的化学反应方程式
(4)用适量的NH4NO3溶液浸取煅粉后,恢复到25℃时镁化合物几乎不溶,若滤液I中c(Mg2+)小于5×10-6 mol·L-1,则溶液pH大于
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
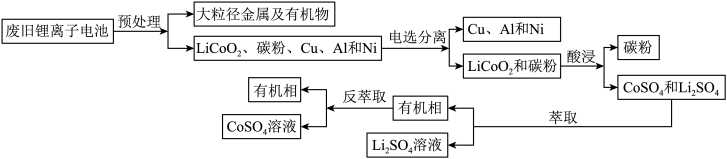
【推荐3】二次电池锂离子电池广泛应用于手机和电脑等电子产品中。某常见锂离子电池放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。2018年中国回收了全球可回收锂离子电池总量的69%。但现阶段我国废旧电池回收仍属于劳动密集型产业,效率仍需提高。一种回收该锂离子电池中的锂和钴的流程:
已知:① Na2S2O3是一种中等强度的还原剂,遇强酸分解
② Li2CO3溶解度随温度升高而减小
(1)关于该锂离子电池说法不正确的是_______________________________
A.锂离子电池中无金属锂,充放电过程中,Li+在两个电极之间往返嵌入和脱嵌
B.集中预处理时,为防止短时间内快速放电引起燃烧甚至爆炸,应先进行放电处理
C.充电时若转移0.01 mol电子,石墨电极将减重0.07g
D.充电时,阳极的电极反应式为LiCoO2-xe-===Li1-xCoO2+xLi+
(2)LiCoO2是一种具有强氧化性的难溶复合金属氧化物,且Co3+在常温、pH=0.5条件下即开始水解。LiCoO2可溶于硫酸得CoSO4。用硫酸酸浸时,需要加入Na2S2O3作助溶剂,从化学反应原理的角度解释原因:_______________________________ ,写出浸出CoSO4的离子反应方程式:__________________
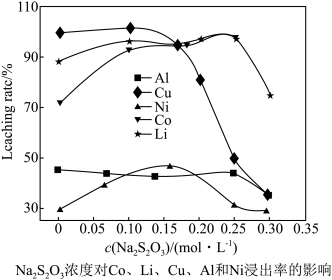
(3)控制氢离子浓度为4mol/L,反应温度90℃,测得相同时间内离子的浸出率与Na2S2O3溶液的变化关系如图。则酸浸时应选用浓度为_______ mol/L的Na2S2O3溶液。Na2S2O3溶液浓度增至0.3mol/L时,LiCoO2的浸出率明显下降,可能的原因是_________________ (用化学方程式结合文字说明)
(4)整个回收工艺中,可循环使用的物质是_____________________
(5)已知15℃左右Li2CO3的Ksp为3.210-2,该温度下Li2CO3的溶解度约为_____ g。将萃取后的Li2SO4溶液加热至95℃,加入饱和Na2CO3溶液,反应10min,________________ (填操作)得Li2CO3粉末。

已知:① Na2S2O3是一种中等强度的还原剂,遇强酸分解
② Li2CO3溶解度随温度升高而减小
(1)关于该锂离子电池说法不正确的是
A.锂离子电池中无金属锂,充放电过程中,Li+在两个电极之间往返嵌入和脱嵌
B.集中预处理时,为防止短时间内快速放电引起燃烧甚至爆炸,应先进行放电处理
C.充电时若转移0.01 mol电子,石墨电极将减重0.07g
D.充电时,阳极的电极反应式为LiCoO2-xe-===Li1-xCoO2+xLi+
(2)LiCoO2是一种具有强氧化性的难溶复合金属氧化物,且Co3+在常温、pH=0.5条件下即开始水解。LiCoO2可溶于硫酸得CoSO4。用硫酸酸浸时,需要加入Na2S2O3作助溶剂,从化学反应原理的角度解释原因:

(3)控制氢离子浓度为4mol/L,反应温度90℃,测得相同时间内离子的浸出率与Na2S2O3溶液的变化关系如图。则酸浸时应选用浓度为
(4)整个回收工艺中,可循环使用的物质是
(5)已知15℃左右Li2CO3的Ksp为3.210-2,该温度下Li2CO3的溶解度约为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。
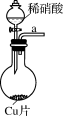
Ⅰ.实验室中利用如图甲装置(部分装置省略)制备KClO和NaClO,探究其氧化还原性质。

回答下列问题:
(1)盛放 粉末的仪器名称是
粉末的仪器名称是_______ ,a中的试剂为_______ 。
(2)写出 的电子式
的电子式_______ 。
(3)d的作用是_______ ,可选用试剂_______ (填标号)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.稀
溶液 D.稀
(4)反应结束后,取出b中试管,经冷却结晶,_______ ,洗涤,干燥,得到 晶体。
晶体。
(5)取少量 和
和 溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加淀粉溶液振荡,静置后溶液显蓝色。可知该条件下
溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加淀粉溶液振荡,静置后溶液显蓝色。可知该条件下 的氧化能力
的氧化能力_______  (填“大于”或“小于”)。
(填“大于”或“小于”)。
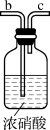
(6)一位同学设计了一套用浓盐酸和高锰酸钾固体制取少量氯气并能比较氯气与碘单质氧化性强弱的微型装置,如图乙所示。能说明氯气的氧化性强于碘单质的实验现象是_______ 。
Ⅱ.是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(7) ,中Cl的化合价为
,中Cl的化合价为_______ 。
(8)“反应”步骤中生成 的化学原理为如下反应:
的化学原理为如下反应:

请将上述方程式补充完整。_______
(9)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 和
和 ,要加入的试剂分别为
,要加入的试剂分别为_______ 、_______ (填化学式)。
(10)“尾气吸收”是吸收“电解”过程排出的少量 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为_______ ,该反应中氧化产物是_______ 。
Ⅰ.实验室中利用如图甲装置(部分装置省略)制备KClO和NaClO,探究其氧化还原性质。

回答下列问题:
(1)盛放
 粉末的仪器名称是
粉末的仪器名称是(2)写出
 的电子式
的电子式(3)d的作用是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.稀
溶液 D.稀
(4)反应结束后,取出b中试管,经冷却结晶,
 晶体。
晶体。(5)取少量
 和
和 溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加淀粉溶液振荡,静置后溶液显蓝色。可知该条件下
溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加淀粉溶液振荡,静置后溶液显蓝色。可知该条件下 的氧化能力
的氧化能力 (填“大于”或“小于”)。
(填“大于”或“小于”)。(6)一位同学设计了一套用浓盐酸和高锰酸钾固体制取少量氯气并能比较氯气与碘单质氧化性强弱的微型装置,如图乙所示。能说明氯气的氧化性强于碘单质的实验现象是
Ⅱ.是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(7)
 ,中Cl的化合价为
,中Cl的化合价为(8)“反应”步骤中生成
 的化学原理为如下反应:
的化学原理为如下反应:
请将上述方程式补充完整。
(9)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 和
和 ,要加入的试剂分别为
,要加入的试剂分别为(10)“尾气吸收”是吸收“电解”过程排出的少量
 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
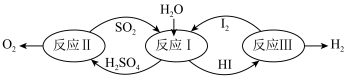
(1)已知:






反应I的热化学方程式:_______ 。
(2)反应I所得产物的溶液在碘过量时会自发分成两层。分离两层溶液的实验操作是_______ 。
(3)研究发现,通过电解方法实现反应I,既可减少碘的加入量,也可减少溶液后续纯化过程的能耗。写出通过电解法实现反应I时,阳极的电极反应式:_______ 。
(4)碘硫循环过程中反应I所制备出的HI浓度较低,必须对HI溶液进行浓缩。电解电渗析浓缩HI溶液的原理如下图所示,初始时阳极液和阴极液相同,溶液组成均为n(HI):n(H2O):n(I2)=1:6.8:2。
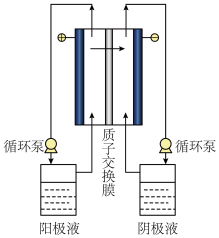
①电渗析过程中,阳极液中I2的浓度会_______ (填“增大”或“减小”)。
②结合化学用语,解释阴极区进行HI浓缩的原理_______ 。
(5)某科研小组采用双极膜电渗析法制备高浓度氢碘酸,工作原理如下图所示。

已知:双极膜在直流电场作用下可将水解离,在双极膜的两侧分别得到H+和OH-。
①X极是_______ (填“阳极”或“阴极”)。
②电解后,_______ 室获得较浓的氢碘酸(填“a”、“b”或“c”)。

(1)已知:






反应I的热化学方程式:
(2)反应I所得产物的溶液在碘过量时会自发分成两层。分离两层溶液的实验操作是
(3)研究发现,通过电解方法实现反应I,既可减少碘的加入量,也可减少溶液后续纯化过程的能耗。写出通过电解法实现反应I时,阳极的电极反应式:
(4)碘硫循环过程中反应I所制备出的HI浓度较低,必须对HI溶液进行浓缩。电解电渗析浓缩HI溶液的原理如下图所示,初始时阳极液和阴极液相同,溶液组成均为n(HI):n(H2O):n(I2)=1:6.8:2。

①电渗析过程中,阳极液中I2的浓度会
②结合化学用语,解释阴极区进行HI浓缩的原理
(5)某科研小组采用双极膜电渗析法制备高浓度氢碘酸,工作原理如下图所示。

已知:双极膜在直流电场作用下可将水解离,在双极膜的两侧分别得到H+和OH-。
①X极是
②电解后,
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】综合利用海水资源可以制备氯化铵、纯碱、金属镁等物质,其流程如下:
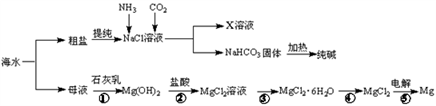
(1)反应①~⑤中,属于氧化还原反应的是______________ (填序号)。
(2)写出反应②的离子方程式__________________________________________________ 。
(3)X溶液中的主要阳离子是Na+和____________ 。
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③_____ ;④加适量盐酸;⑤_____ (请补全缺少的实验步骤)。

(1)反应①~⑤中,属于氧化还原反应的是
(2)写出反应②的离子方程式
(3)X溶液中的主要阳离子是Na+和
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
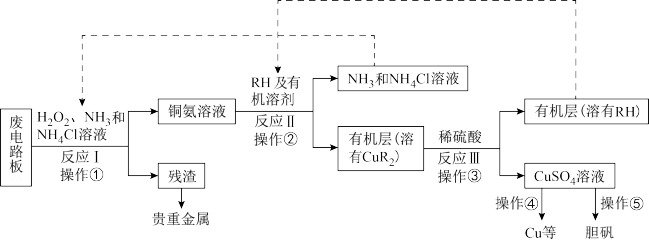
【推荐1】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如图:
(1)反应Ⅰ是将Cu转化为Cu(NH3) ,反应中H2O2的作用是
,反应中H2O2的作用是___ 。写出操作①的名称:___ 。
(2)反应Ⅱ是铜氨溶液中的Cu(NH3) 与有机物RH反应,写出该反应的离子方程式:
与有机物RH反应,写出该反应的离子方程式:___ 。操作②用到的主要仪器名称为___ ,其目的是(填序号)___ 。
a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和___ 。
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是___ 。
(5)操作⑤由硫酸铜溶液制胆矾的主要步骤是___ 。
(1)反应Ⅰ是将Cu转化为Cu(NH3)
 ,反应中H2O2的作用是
,反应中H2O2的作用是(2)反应Ⅱ是铜氨溶液中的Cu(NH3)
 与有机物RH反应,写出该反应的离子方程式:
与有机物RH反应,写出该反应的离子方程式:a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是
(5)操作⑤由硫酸铜溶液制胆矾的主要步骤是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】工业上生产高氯酸(沸点:90℃)时还同时生产了亚氯酸钠,其工艺流程如下:
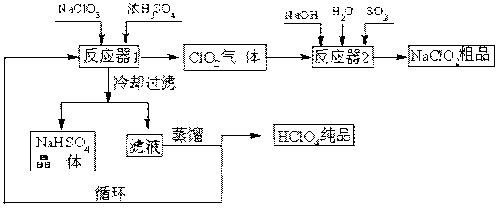
(1)冷却过滤的目的______ 。
(2)通入反应器2的SO2作用是______ ;反应器2中发生反应的离子方程式为______ 。
(3)循环使用的物质是______ 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是______ 。
(5)通过电解NaClO3水溶液的方法也可以制备NaClO4,进而可以制备HClO4,写出阳极的电极反应式______ 。

(1)冷却过滤的目的
(2)通入反应器2的SO2作用是
(3)循环使用的物质是
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是
(5)通过电解NaClO3水溶液的方法也可以制备NaClO4,进而可以制备HClO4,写出阳极的电极反应式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色,难溶于水和乙醇。工业上以废铜料(含少量铁)为原料,制备氯化亚铜的流程如图:
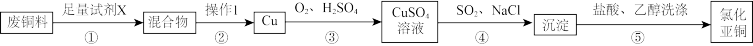
(1)步骤①中试剂X可以是___ (写化学式)。步骤③中反应时需要提供的条件是___ 。
(2)步骤③中,为提高反应速率,可用稀HNO3代替O2,此时需要严格控制n(HNO3):n(H2SO4)=___ ,用稀HNO3代替O2的不足之处是___ 。
(3)步骤④中,该反应的离子方程式为___ ;实际生产中,步骤④中要适当通入过量SO2,原因可能是___ 。
(4)若在实验室中用98%的浓H2SO4配制步骤③所需的稀H2SO41000mL所需的仪器为___ 。
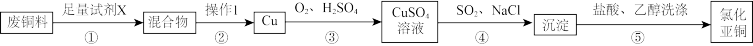
(1)步骤①中试剂X可以是
(2)步骤③中,为提高反应速率,可用稀HNO3代替O2,此时需要严格控制n(HNO3):n(H2SO4)=
(3)步骤④中,该反应的离子方程式为
(4)若在实验室中用98%的浓H2SO4配制步骤③所需的稀H2SO41000mL所需的仪器为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某小组设计实验现象SO2水溶液中使品红褪色的主要微粒。
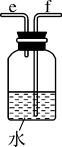
实验一:按下图装置组装好仪器,进行实验。观察到:装置III中溶液红色没有褪去,装置IV中溶液红色褪去。
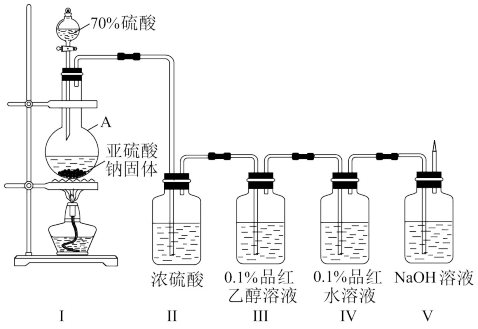
(1)仪器A的名称是___________ 。
(2)装置I中发生反应的化学方程式为___________ 。
(3)装置II中浓硫酸的作用是___________ 。
(4)比较装置III、IV的现象,可得出的结论是___________ 。
实验二:甲同学用试管和滴管进行如下系列实验:
(5)NaHSO3溶液显酸性的原因是_______ 。
(6)设计实验d、e的目的是________ 。
(7)根据实验一、二可推知,SO2水溶液使品红褪色时起主要作用的微粒是____ (填微粒符号)。
(8)乙同学认为仅向a实验后的无色溶液中滴入Ba(OH)2溶液,若出现白色沉淀,且溶液变红,即可证明起褪色作用的主要是何种微粒,你认为该方法是否正确并说明理由_____ 。
实验一:按下图装置组装好仪器,进行实验。观察到:装置III中溶液红色没有褪去,装置IV中溶液红色褪去。

(1)仪器A的名称是
(2)装置I中发生反应的化学方程式为
(3)装置II中浓硫酸的作用是
(4)比较装置III、IV的现象,可得出的结论是
实验二:甲同学用试管和滴管进行如下系列实验:
| 实验编号 | 试管中的溶液 | 滴入溶液 | 实验现象 |
| a | 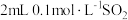 水溶液(pH=2) 水溶液(pH=2) | 各滴入1滴0.1%品红溶液 | 溶液变红逐渐变浅,约90%后完全褪色 |
| b |  溶液(pH=10) 溶液(pH=10) | 溶液变红后立即变浅,约15s后完全褪色 | |
| c |  溶液(pH=10) 溶液(pH=10) | 溶液变红后立即褪色 | |
| d | 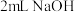 溶液(pH=10) 溶液(pH=10) | 溶液变为红色 | |
| e | 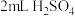 溶液(pH=2) 溶液(pH=2) | 溶液变为红色 |
(6)设计实验d、e的目的是
(7)根据实验一、二可推知,SO2水溶液使品红褪色时起主要作用的微粒是
(8)乙同学认为仅向a实验后的无色溶液中滴入Ba(OH)2溶液,若出现白色沉淀,且溶液变红,即可证明起褪色作用的主要是何种微粒,你认为该方法是否正确并说明理由
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
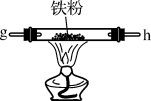
【推荐2】某兴趣小组设计用铁粉将NO还原为 (同时生成FeO)。
(同时生成FeO)。
已知:①浓硝酸可氧化NO。
②NaOH溶液能吸收 ,不吸收NO。
,不吸收NO。
(1)装置甲中的空气含有氧气,所以甲中产生的NO有部分被氧化为 。装置丁的作用是除去挥发来的硝酸和产生的
。装置丁的作用是除去挥发来的硝酸和产生的___________ 。(写化学式)
(2)装置戊中发生的化学方程式:___________ 。
(3)装置己的作用是___________ 。
(4)装置的连接顺序为a→___________ 。
(5)装置丙中发生氧化还原反应,生成两种盐,写出反应的离子方程式___________ 。
 (同时生成FeO)。
(同时生成FeO)。
|
|
|
| 甲 | 乙 | 丙 |
|
|
|
| 丁 | 戊 | 己 |
②NaOH溶液能吸收
 ,不吸收NO。
,不吸收NO。(1)装置甲中的空气含有氧气,所以甲中产生的NO有部分被氧化为
 。装置丁的作用是除去挥发来的硝酸和产生的
。装置丁的作用是除去挥发来的硝酸和产生的(2)装置戊中发生的化学方程式:
(3)装置己的作用是
(4)装置的连接顺序为a→
(5)装置丙中发生氧化还原反应,生成两种盐,写出反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】(化学与技术)聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
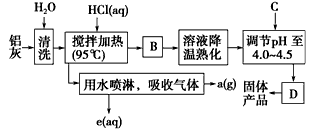
(1)搅拌加热操作过程中发生反应的离子方程式_________________ ;________________
(2)生产过程中操作B和D的名称均为_______ (B和D为简单操作)。
(3)反应中副产品a是_______________ (用化学式表示)。
(4)生产过程中可循环使用的物质是_____________________ (用化学式表示)。
(5)调节pH至4.0~4.5的目的是____________________________________________ 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用__________ 。

(1)搅拌加热操作过程中发生反应的离子方程式
(2)生产过程中操作B和D的名称均为
(3)反应中副产品a是
(4)生产过程中可循环使用的物质是
(5)调节pH至4.0~4.5的目的是
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用
| A.NaOH | B.Al | C.氨水 | D.Al2O3 E.NaAlO2 |
您最近一年使用:0次