请回答下列问题:
(1)纯水在T ℃时pH=6,该温度下1 mol/L的NaOH溶液中,由水电离出的c(OH-)=_______ mol/L。
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A)__________ pH(B) (填“>”、“=”或“<”);现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A)_________ V(B)(填“>”、“=”或“<”)。
(3)已知:二元酸H2R 的电离方程式是: ,
,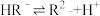 ,若0.1mol•L﹣1NaHR溶液的c(H+)="a"
,若0.1mol•L﹣1NaHR溶液的c(H+)="a" 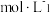 ,则0.1
,则0.1 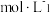 H2R溶液中c(H+)
H2R溶液中c(H+)___________ (0.1+a) 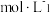 (填“<”、“>”或“=”),理由是
(填“<”、“>”或“=”),理由是______________ 。
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
①25 ℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为________ (用化学式表示)。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为__________________ 。
(1)纯水在T ℃时pH=6,该温度下1 mol/L的NaOH溶液中,由水电离出的c(OH-)=
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A)
(3)已知:二元酸H2R 的电离方程式是:
 ,
,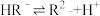 ,若0.1mol•L﹣1NaHR溶液的c(H+)="a"
,若0.1mol•L﹣1NaHR溶液的c(H+)="a" 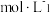 ,则0.1
,则0.1 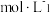 H2R溶液中c(H+)
H2R溶液中c(H+)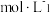 (填“<”、“>”或“=”),理由是
(填“<”、“>”或“=”),理由是(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
| 化学式 | 电离常数(25 ℃) |
| HCN | K=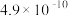 |
| CH3COOH[] | K=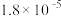 |
| H2CO3 | K1=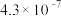 、K2= 、K2=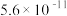 |
①25 ℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为
更新时间:2017-02-17 14:49:43
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】比较填空(填“>”、“<”或“=”)
(1)Ⅰ.比较等体积等浓度的溶液①盐酸 ②醋酸 与足量锌粒反应产生氢气的体积,①________ ②
Ⅱ.比较2H2(g)+O2(g) =2H2O(g) ΔH 1 2H2(g)+O2(g)=2H2O(l) ΔH2的反应热 ΔH1_______ ΔH2
Ⅲ.比较常温下两溶液水的电离程度,①pH=4盐酸 ②pH =10氨水溶液①________ ②
Ⅳ.同温度下溶液①使甲基橙呈现红色,溶液②使石蕊呈现紫色,比较两者pH①__________ ②
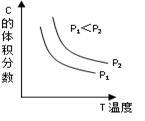
(2)Ⅴ.已知某可逆反应aA(g) + bB(g) cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b ___________ c + d
Ⅵ.比较①0.1mol/L醋酸与②0.01mol/L醋酸的导电能力,①________ ②
Ⅶ.1mol/L氨水与0.1mol/L氨水的c(OH-)之比_______ 10
Ⅷ.体积相同的恒容密闭容器,在A中充入SO2和O2各1g,在B中充入SO2和O2各2g,相同条件下发生反应2SO2+O2 2SO3平衡时 SO2的转化率A
2SO3平衡时 SO2的转化率A_______ B
(1)Ⅰ.比较等体积等浓度的溶液①盐酸 ②醋酸 与足量锌粒反应产生氢气的体积,①
Ⅱ.比较2H2(g)+O2(g) =2H2O(g) ΔH 1 2H2(g)+O2(g)=2H2O(l) ΔH2的反应热 ΔH1
Ⅲ.比较常温下两溶液水的电离程度,①pH=4盐酸 ②pH =10氨水溶液①
Ⅳ.同温度下溶液①使甲基橙呈现红色,溶液②使石蕊呈现紫色,比较两者pH①
(2)Ⅴ.已知某可逆反应aA(g) + bB(g)
 cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b 
Ⅵ.比较①0.1mol/L醋酸与②0.01mol/L醋酸的导电能力,①
Ⅶ.1mol/L氨水与0.1mol/L氨水的c(OH-)之比
Ⅷ.体积相同的恒容密闭容器,在A中充入SO2和O2各1g,在B中充入SO2和O2各2g,相同条件下发生反应2SO2+O2
 2SO3平衡时 SO2的转化率A
2SO3平衡时 SO2的转化率A
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】NaHSO4 和NaHCO3是常见的酸式盐,是水溶液中离子平衡部分重要的研究对象。请运用相关原理,回答下列有关小题。
(1)室温下,pH=5的NaHSO4放热溶液中水的电离程度______ (填“>”、“<”或“=”) pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为_______ (用离子方程式表示)。
(3)室温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c( )
)______ 2c( )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
(4)室温下,用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH__________ 7 (填“>”、“<”或“=”)。
(5)室温下,0.1 mol/L 的NaHCO3溶液的pH为8.4,同浓度的Na2CO3溶液的pH为11.4。上述溶液中,由NaHCO3水解产生的c(OH-)约是由Na2CO3水解产生的c(OH-)的_____ 倍。
(1)室温下,pH=5的NaHSO4放热溶液中水的电离程度
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为
(3)室温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(
 )
) )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。(4)室温下,用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH
(5)室温下,0.1 mol/L 的NaHCO3溶液的pH为8.4,同浓度的Na2CO3溶液的pH为11.4。上述溶液中,由NaHCO3水解产生的c(OH-)约是由Na2CO3水解产生的c(OH-)的
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】U、V、W、X、Y、Z是原子序数依次增大的短周期元素。已知:
①WU4++XU-==WU3+U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)写出Y2X2与水反应的化学方程式:________________ 。
(2)V、W、X形成的10电子氢化物中,沸点最高的是__________ (写化学式)。
(3)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为__________ 。
(4)常温下,向pH=11的Y2VX3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是_________ 。
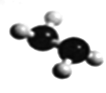
(5)已知由U、W两种元素组成的共价化合物联氨的球棍模型如图所示,则联氨分子的电子式为____________ 。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_______ (已知:N2H4+H+==N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与过量硫酸形成的酸式盐的化学式为______________ 。
①WU4++XU-==WU3+U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)写出Y2X2与水反应的化学方程式:
(2)V、W、X形成的10电子氢化物中,沸点最高的是
(3)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为
(4)常温下,向pH=11的Y2VX3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是
(5)已知由U、W两种元素组成的共价化合物联氨的球棍模型如图所示,则联氨分子的电子式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.结合表回答下列问题(均为常温下的数据):
请回答下列问题:
(1)同浓度的CH3COO-、 、
、 ,
, 、ClO-中结合H+的能力最强的是
、ClO-中结合H+的能力最强的是___________ 。
(2)常温下0.1 mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________ (填字母)。
A. B.
B. C.
C. D.c(OH-)
D.c(OH-)
(3)取等体积物质的量浓度相等的CH3COOH、HClO两溶液,别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(CH3COOH)___________ V(HClO)(填“>”、“<”或“=”)。
Ⅱ.(4)工业废水中常含有一定量的 和
和 ,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。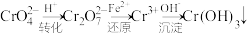 ,转化沉淀转化过程中存在平衡,
,转化沉淀转化过程中存在平衡, 能说明反应到达平衡状态的
能说明反应到达平衡状态的___________ 。
A. 和
和 的浓度相同 B.
的浓度相同 B.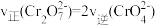
C.溶液的pH值保持不变 D.溶液颜色保持不变
Ⅲ.根据Ⅰ中弱酸的电离平衡常数:
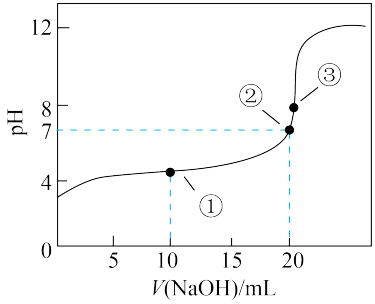
(5)常温下,用0.200 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,③点所示溶液中:2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)=c(Na+)。点①所示溶液中该草酸溶液中离子浓度大小关系为___________ 。点③所示溶液中溶质成分为___________ (用化学式表示)。
(6)以下反应的离子方程式书写正确的是___________ 。
A.次氯酸钠溶液吸收少量二氧化硫:ClO-+SO2+H2O=HClO+SO
B.漂白液生效的原理:ClO-+CO2+H2O=HClO+HCO
C.Na2CO3溶液吸收少量SO2:2CO + SO2+H2O=SO
+ SO2+H2O=SO +2HCO
+2HCO
| 化学式 | CH3COOH | H2SO3 | HClO | H2CO3 | H2C2O4 |
| 电离平衡常数 | K=1.8×10-5 | K1=1.2×10-2 K2=6.6×10-8 | K=3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 |
请回答下列问题:
(1)同浓度的CH3COO-、
 、
、 ,
, 、ClO-中结合H+的能力最强的是
、ClO-中结合H+的能力最强的是(2)常温下0.1 mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.
 B.
B. C.
C. D.c(OH-)
D.c(OH-)(3)取等体积物质的量浓度相等的CH3COOH、HClO两溶液,别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(CH3COOH)
Ⅱ.(4)工业废水中常含有一定量的
 和
和 ,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。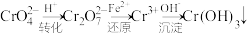 ,转化沉淀转化过程中存在平衡,
,转化沉淀转化过程中存在平衡, 能说明反应到达平衡状态的
能说明反应到达平衡状态的A.
 和
和 的浓度相同 B.
的浓度相同 B.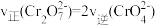
C.溶液的pH值保持不变 D.溶液颜色保持不变
Ⅲ.根据Ⅰ中弱酸的电离平衡常数:
(5)常温下,用0.200 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,③点所示溶液中:2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)=c(Na+)。点①所示溶液中该草酸溶液中离子浓度大小关系为

(6)以下反应的离子方程式书写正确的是
A.次氯酸钠溶液吸收少量二氧化硫:ClO-+SO2+H2O=HClO+SO

B.漂白液生效的原理:ClO-+CO2+H2O=HClO+HCO

C.Na2CO3溶液吸收少量SO2:2CO
 + SO2+H2O=SO
+ SO2+H2O=SO +2HCO
+2HCO
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】查阅资料得知25℃时部分弱酸的电离常数如下表:
据此回答以下几个问题:
(1) 酸性
酸性___________ (填“>”、“<”或“=”) 。
。
(2)写出 的第一步电离方程式
的第一步电离方程式___________ 。
(3)写出 溶液与
溶液与 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(4)以下方法不能证明 为弱酸的是___________(填序号)。
为弱酸的是___________(填序号)。
(5)水合草酸亚铁(FeC2O4∙xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。
①实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是___________ 。
②将水合草酸亚铁溶于适量冷盐酸中。分别取2mL此溶液于3支试管中,进行实验,填写空白:
(6)已知酸性高锰酸钾可将甲酸氧化成二氧化碳,采用 溶液对某
溶液对某 样品进行纯度测定(杂质不参与反应),取
样品进行纯度测定(杂质不参与反应),取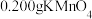 样品(
样品(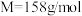 )在锥形瓶中溶解并酸化后,用0.100mol/L的标准
)在锥形瓶中溶解并酸化后,用0.100mol/L的标准 溶液进行滴定,滴定至终点时消耗
溶液进行滴定,滴定至终点时消耗 溶液20.00ml。
溶液20.00ml。
①滴定反应的离子方程式为___________ 。
②该样品中 的纯度为
的纯度为___________ (用百分数表示)。
| 酸 |  |  |  |
| 电离常数(Ka) | 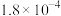 | 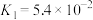 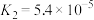 | 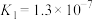  |
据此回答以下几个问题:
(1)
 酸性
酸性 。
。(2)写出
 的第一步电离方程式
的第一步电离方程式(3)写出
 溶液与
溶液与 溶液反应的离子方程式
溶液反应的离子方程式(4)以下方法不能证明
 为弱酸的是___________(填序号)。
为弱酸的是___________(填序号)。A.常温下测得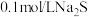 溶液的 溶液的 大于7 大于7 |
B.常温下测得 溶液的 溶液的 大于7 大于7 |
C.常温下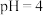 的 的 溶液稀释至100倍后,测得 溶液稀释至100倍后,测得 小于6 小于6 |
D. 不稳定,受热易分解 不稳定,受热易分解 |
①实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是
②将水合草酸亚铁溶于适量冷盐酸中。分别取2mL此溶液于3支试管中,进行实验,填写空白:
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| A | 加入几滴 溶液 溶液 | 溶液不变红 | 肯定不存在 |
| B | 加入几滴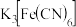 溶液 溶液 | 生产 | 肯定存在 |
| C | 加入几滴酸性 溶液 溶液 | 溶液紫红色褪去 |  |
(6)已知酸性高锰酸钾可将甲酸氧化成二氧化碳,采用
 溶液对某
溶液对某 样品进行纯度测定(杂质不参与反应),取
样品进行纯度测定(杂质不参与反应),取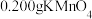 样品(
样品(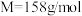 )在锥形瓶中溶解并酸化后,用0.100mol/L的标准
)在锥形瓶中溶解并酸化后,用0.100mol/L的标准 溶液进行滴定,滴定至终点时消耗
溶液进行滴定,滴定至终点时消耗 溶液20.00ml。
溶液20.00ml。①滴定反应的离子方程式为
②该样品中
 的纯度为
的纯度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】利用氨气脱硝 除
除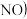 是大气污染防治研究的热点,脱硝过程中涉及的反应为:
是大气污染防治研究的热点,脱硝过程中涉及的反应为:
主反应: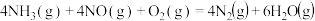
副反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.5KJ/mol
②4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) △H=-1104.9KJ/mol
③4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1269.0KJ/mol
回答下列问题:
(1)主反应的△H为______
(2)如图所示,保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示:
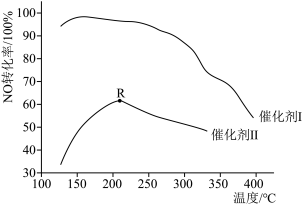
①选用催化剂I的优势有______  写出一点
写出一点
②R点对应的温度为2100C,低于2100C,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由______ .
(3)常温下,在通入氧气的条件下用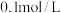 的NaOH溶液吸收NO也可实现脱硝
的NaOH溶液吸收NO也可实现脱硝 产物主要为
产物主要为 和
和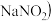 ,已知反应后溶液的
,已知反应后溶液的 ,溶液中
,溶液中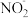 浓度为5.6×10-2mol/L,忽略反应过程中溶液体积变化,
浓度为5.6×10-2mol/L,忽略反应过程中溶液体积变化,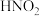 的电离平衡常数为5.1×10-4,则:
的电离平衡常数为5.1×10-4,则:
①c(NO2-)c(OH-)/c(HNO2)=______ 
②某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴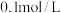 的硝酸银溶液
的硝酸银溶液 一滴为
一滴为 ,通过计算说明能否产生沉淀
,通过计算说明能否产生沉淀______ [Ksp(AgNO2)=2×10-8]
 除
除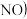 是大气污染防治研究的热点,脱硝过程中涉及的反应为:
是大气污染防治研究的热点,脱硝过程中涉及的反应为:主反应:
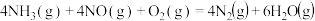
副反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.5KJ/mol
②4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) △H=-1104.9KJ/mol
③4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1269.0KJ/mol
回答下列问题:
(1)主反应的△H为
(2)如图所示,保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示:

①选用催化剂I的优势有
 写出一点
写出一点
②R点对应的温度为2100C,低于2100C,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由
(3)常温下,在通入氧气的条件下用
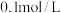 的NaOH溶液吸收NO也可实现脱硝
的NaOH溶液吸收NO也可实现脱硝 产物主要为
产物主要为 和
和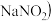 ,已知反应后溶液的
,已知反应后溶液的 ,溶液中
,溶液中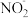 浓度为5.6×10-2mol/L,忽略反应过程中溶液体积变化,
浓度为5.6×10-2mol/L,忽略反应过程中溶液体积变化,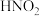 的电离平衡常数为5.1×10-4,则:
的电离平衡常数为5.1×10-4,则:①c(NO2-)c(OH-)/c(HNO2)=

②某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴
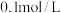 的硝酸银溶液
的硝酸银溶液 一滴为
一滴为 ,通过计算说明能否产生沉淀
,通过计算说明能否产生沉淀
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上;
②使滴定管尖嘴充满液体,再固定好滴定管;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2-3次;
(1)以上步骤有错误的是(填编号)_______ ,该错误操作会导致测定结果_______ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用_______ (填仪器名称),在锥形瓶装液前, 留有少量蒸馏水,测定结果_______ (填“偏大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_______ ;判断到达滴定终点的依据是_______
(4)以下是另一位学生实验数据记录表:
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是____
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为_______ mol·L-1
(6)室温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示, 其中表示醋酸滴定曲线的是______ (填“Ι”、“II”)。

①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上;
②使滴定管尖嘴充满液体,再固定好滴定管;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2-3次;
(1)以上步骤有错误的是(填编号)
(2)步骤④中,量取20.00mL待测液应使用
(3)步骤⑤滴定时眼睛应注视
(4)以下是另一位学生实验数据记录表:
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.22 |
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为
(6)室温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示, 其中表示醋酸滴定曲线的是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】酸碱中和反应中溶液的 变化可用于各种研究
变化可用于各种研究
(1)用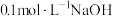 溶液分别滴定体积均为
溶液分别滴定体积均为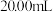 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
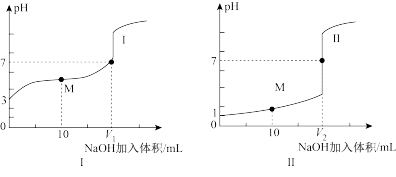
①滴定醋酸的曲线是①,判断理由是___________ 。
②滴定开始前,三种溶液中由水电离出的 最大的是
最大的是___________ (填化学式)。
③ 和
和 的关系:
的关系:
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(2)酸碱中和滴定可用于测定酸或碱的物质的量浓度,取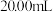 未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用
未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用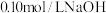 标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①滴定达到终点的现象是___________ 。
②根据上述数据,可计算出该盐酸的浓度约为___________  (保留两位有效数字)。
(保留两位有效数字)。
③在上述实验中,下列操作会造成测定结果偏高的有___________ (填字母序号)。
A.滴定终点读数时俯视
B.锥形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用待测盐酸润洗
D.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
E.碱式滴定管尖嘴部分有气泡,滴定后消失
 变化可用于各种研究
变化可用于各种研究(1)用
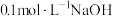 溶液分别滴定体积均为
溶液分别滴定体积均为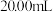 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是①,判断理由是
②滴定开始前,三种溶液中由水电离出的
 最大的是
最大的是③
 和
和 的关系:
的关系:
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(2)酸碱中和滴定可用于测定酸或碱的物质的量浓度,取
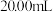 未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用
未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用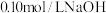 标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。| 实验编号 |  溶液的浓度( 溶液的浓度( ) ) | 滴定完成时, 溶液滴入的体积( 溶液滴入的体积( ) ) | 待测盐酸的体积( ) ) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为
 (保留两位有效数字)。
(保留两位有效数字)。③在上述实验中,下列操作会造成测定结果偏高的有
A.滴定终点读数时俯视
B.锥形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用待测盐酸润洗
D.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】醋酸是日常生活中的常见的有机物。
(1)国家规定酿造的食醋中每100mL食醋中醋酸的含量不得低于3.5g,某实验小组用酸碱滴定法测定某白醋中醋酸的含量(g/100mL),设计如下实验:
I.用酸式滴定管量取25.00mL白醋,配制成250mL待测白醋溶液。
II.用酸式滴定管量取待测白醋溶液25.00mL于锥形瓶中,加入1~2滴指示剂。
III.用碱式滴定管盛装0.1000mol/LNaOH标准溶液进行滴定。
IV.重复滴定几次,数排记录如下表。
①可以说明醋酸是弱酸的事实是_______ 。
A.醋酸易溶于水 B.醋酸能与 溶液反应生成
溶液反应生成
C.醋酸的水溶液能使酸碱指示剂变色 D.室温下0.1mol/L的醋酸溶液
②若滴定管中液面如图所示,则该读数为_______ 。

③已知醋酸钠溶液因水解显弱碱性。滴定实验中应选用的最佳指示剂为_______
A.甲基橙 B.淀粉 C.石蕊 D.酚酞
④由表中数据,计算市售的白醋中醋酸的含量为_______ g/100mL。
⑤滴定过程中出现以下情况,会使测定结果偏高的是_______ 。
A.滴定前,锥形瓶和碱式滴定管均用待装溶液润洗
B.滴定过程中,锥形瓶中溶液变色后立即停止滴定
C.初始读数正确,滴定终点时,读取标准溶液体积时俯视滴定管液面
D.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡
(2)若用0.1mol/LNaOH溶液分别测定体积均为20mL,浓度均为0.1mol/L的盐酸和醋酸溶液,滴定过程中的两条滴定曲线如图所示。(醋酸钠溶液因水解显弱碱性)
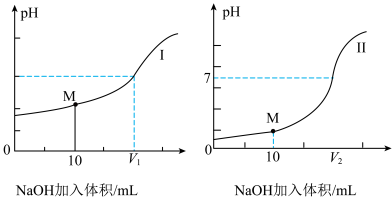
①表示盐酸与NaOH溶液的滴定图像的是曲线_______ (填“I”、“II”)。
②25℃,滴定醋酸溶液达 时,根据加入NaOH的体积,计算醋酸的电离常数为
时,根据加入NaOH的体积,计算醋酸的电离常数为
_______ (用含 或
或 的代数式表示)。
的代数式表示)。
(1)国家规定酿造的食醋中每100mL食醋中醋酸的含量不得低于3.5g,某实验小组用酸碱滴定法测定某白醋中醋酸的含量(g/100mL),设计如下实验:
I.用酸式滴定管量取25.00mL白醋,配制成250mL待测白醋溶液。
II.用酸式滴定管量取待测白醋溶液25.00mL于锥形瓶中,加入1~2滴指示剂。
III.用碱式滴定管盛装0.1000mol/LNaOH标准溶液进行滴定。
IV.重复滴定几次,数排记录如下表。
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.06 |
| 2 | 25.00 | 1.98 | 21.97 |
| 3 | 25.00 | 0.20 | 21.20 |
| 4 | 25.00 | 0.45 | 20.45 |
A.醋酸易溶于水 B.醋酸能与
 溶液反应生成
溶液反应生成
C.醋酸的水溶液能使酸碱指示剂变色 D.室温下0.1mol/L的醋酸溶液

②若滴定管中液面如图所示,则该读数为

③已知醋酸钠溶液因水解显弱碱性。滴定实验中应选用的最佳指示剂为
A.甲基橙 B.淀粉 C.石蕊 D.酚酞
④由表中数据,计算市售的白醋中醋酸的含量为
⑤滴定过程中出现以下情况,会使测定结果偏高的是
A.滴定前,锥形瓶和碱式滴定管均用待装溶液润洗
B.滴定过程中,锥形瓶中溶液变色后立即停止滴定
C.初始读数正确,滴定终点时,读取标准溶液体积时俯视滴定管液面
D.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡
(2)若用0.1mol/LNaOH溶液分别测定体积均为20mL,浓度均为0.1mol/L的盐酸和醋酸溶液,滴定过程中的两条滴定曲线如图所示。(醋酸钠溶液因水解显弱碱性)

①表示盐酸与NaOH溶液的滴定图像的是曲线
②25℃,滴定醋酸溶液达
 时,根据加入NaOH的体积,计算醋酸的电离常数为
时,根据加入NaOH的体积,计算醋酸的电离常数为
 或
或 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



