CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配制 CuSO4 溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,原因是______________________ ,最后,他向烧杯中加入了一定量的_______ 溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的 CuSO4溶液,进行以下实验探究。
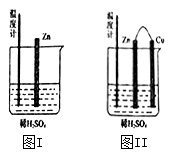
①图一是根据反应 Zn+CuSO4=Cu+ZnSO4 设计成的锌铜原电池。电解质溶液乙是_______ 溶液;Cu极的电极反应式是_________________ 。
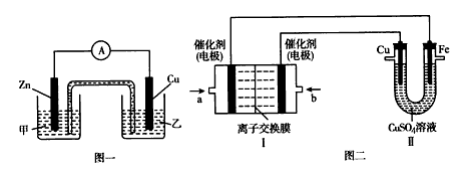
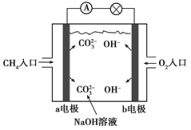
②图二中,I 是甲烷燃料电池(电解质溶液为 NaOH 溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是__________ (填“CH4”或“O2”), a 处电极上发生的电极反应式是____ ;铁为电解池的____ 极,当铜电极的质量减轻 3.2 g,则消耗的 CH4在标准状况下的体积为____ L。
(3)反应一段时间后,生成的 Na2CO3 溶液(溶质仅为 Na2CO3)中存在的关系正确的是____ 。
A. c(Na+)=c(HCO3-)=c(OH-)=c(H+) B. c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C. c(Na+)>c(CO32-)>c(H+)>c(OH-) D. c(Na+)>c(CO32-) >c(OH-)>c(HCO3-)
(1)某同学配制 CuSO4 溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,原因是
(2)该同学利用制得的 CuSO4溶液,进行以下实验探究。
①图一是根据反应 Zn+CuSO4=Cu+ZnSO4 设计成的锌铜原电池。电解质溶液乙是

②图二中,I 是甲烷燃料电池(电解质溶液为 NaOH 溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是
(3)反应一段时间后,生成的 Na2CO3 溶液(溶质仅为 Na2CO3)中存在的关系正确的是
A. c(Na+)=c(HCO3-)=c(OH-)=c(H+) B. c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C. c(Na+)>c(CO32-)>c(H+)>c(OH-) D. c(Na+)>c(CO32-) >c(OH-)>c(HCO3-)
更新时间:2017-02-26 19:31:58
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】硫酸铜可应用于电镀、颜料、医药、农药等方面。下图是探究铜与浓硫酸反应生成硫酸铜的实验装置图:

完成下列填空:
(1)写出烧瓶中发生反应的化学方程式_________ 。写出图中虚线框内装置的作用__________ 、_________ 。
(2)实验结束后,烧瓶中有白色固体生成。写出检验烧瓶中此白色固体是CuSO4的简便的方法__________ 。
(3)实验中,若反应条件控制不当,则会有少量黑色难溶物CuS、Cu2S固体生成。取此黑色固体样品ag,隔绝空气加热,发生2CuS Cu2S+S,充分反应后得到bgCu2S,则CuS的质量分数ω=
Cu2S+S,充分反应后得到bgCu2S,则CuS的质量分数ω=_________ (用含a、b的代数式表示)。加热温度过高,会有部分Cu2S分解生成Cu,则ω________ (选填“偏大”“偏小”或“不变”)。

完成下列填空:
(1)写出烧瓶中发生反应的化学方程式
(2)实验结束后,烧瓶中有白色固体生成。写出检验烧瓶中此白色固体是CuSO4的简便的方法
(3)实验中,若反应条件控制不当,则会有少量黑色难溶物CuS、Cu2S固体生成。取此黑色固体样品ag,隔绝空气加热,发生2CuS
 Cu2S+S,充分反应后得到bgCu2S,则CuS的质量分数ω=
Cu2S+S,充分反应后得到bgCu2S,则CuS的质量分数ω=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】某学习小组设计实验探究CuSO4分解产物
Ⅰ.甲同学选择下列装置设计实验探究硫酸铜分解的气态产物SO3、SO2和O2,并验证SO2的还原性。
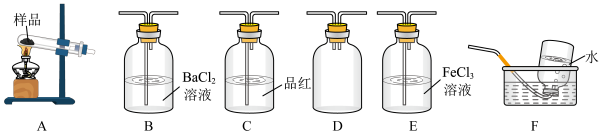
回答下列有关问题
(1)CuSO4水溶液呈酸性,其原因是______________________ (用离子方程式表示)。
(2)上述装置按气流从左至右排序为A、D、___________ E、F(填代号)。
(3)装置D的作用是___________ ;能证明有SO3生成的实验现象是___________ 。
(4)在实验过程中C装置中红色溶液逐渐变为无色溶液,说明A中分解产物有___________ ;待C中有明显现象后,F开始收集气体,F装置中集气瓶收集到了少量气体,该气体是___________ (填化学式)。
(5)为了验证SO2的还原性,取E装置中反应后的溶液于试管中,设计如下实验:
a 滴加少量的NH4SCN溶液 b 滴加少量的K3[Fe(CN)6]溶液
c 滴加酸性KMnO4溶液 d 滴加盐酸酸化的BaCl2溶液
其中,方案合理的有___________ (填代号),写出E装置中可能发生反应的离子方程式:_________ 。
Ⅱ.乙同学利用A中残留固体验证固体产物(假设硫酸铜已完全分解)
查阅资料知,铜有+2、+1价。Cu2O在酸性条件下不稳定,发生反应:Cu2O+2H+=Cu+Cu2++H2O。
(6)为了验证固体产物中是否有Cu2O,设计了下列4种方案,其中能达到实验目的的是___________ 。
甲:取少量残留固体于试管,滴加足量的稀硝酸,观察溶液颜色是否变为蓝色
乙:取少量残留固体于试管,滴加足量的稀硫酸,观察溶液颜色是否变为蓝色
丙:取少量残留固体于试管,滴加足量的稀盐酸,观察是否有红色固体生成
丁:取少量残留固体于试管,通入氢气,加热,观察是否生成红色固体
(7)经检验CuSO4分解生成CuO、Cu2O、SO3、SO2和O2,且CuO、Cu2O的质量之比为5:9,SO2、O2、SO3的体积之比(同温同压下测定)为4:3:2。写出CuSO4分解的化学方程式:_______ 。
Ⅰ.甲同学选择下列装置设计实验探究硫酸铜分解的气态产物SO3、SO2和O2,并验证SO2的还原性。

回答下列有关问题
(1)CuSO4水溶液呈酸性,其原因是
(2)上述装置按气流从左至右排序为A、D、
(3)装置D的作用是
(4)在实验过程中C装置中红色溶液逐渐变为无色溶液,说明A中分解产物有
(5)为了验证SO2的还原性,取E装置中反应后的溶液于试管中,设计如下实验:
a 滴加少量的NH4SCN溶液 b 滴加少量的K3[Fe(CN)6]溶液
c 滴加酸性KMnO4溶液 d 滴加盐酸酸化的BaCl2溶液
其中,方案合理的有
Ⅱ.乙同学利用A中残留固体验证固体产物(假设硫酸铜已完全分解)
查阅资料知,铜有+2、+1价。Cu2O在酸性条件下不稳定,发生反应:Cu2O+2H+=Cu+Cu2++H2O。
(6)为了验证固体产物中是否有Cu2O,设计了下列4种方案,其中能达到实验目的的是
甲:取少量残留固体于试管,滴加足量的稀硝酸,观察溶液颜色是否变为蓝色
乙:取少量残留固体于试管,滴加足量的稀硫酸,观察溶液颜色是否变为蓝色
丙:取少量残留固体于试管,滴加足量的稀盐酸,观察是否有红色固体生成
丁:取少量残留固体于试管,通入氢气,加热,观察是否生成红色固体
(7)经检验CuSO4分解生成CuO、Cu2O、SO3、SO2和O2,且CuO、Cu2O的质量之比为5:9,SO2、O2、SO3的体积之比(同温同压下测定)为4:3:2。写出CuSO4分解的化学方程式:
您最近一年使用:0次
【推荐3】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:

已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:

请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:__________ (写一种)。
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是__________________________ 。根据如图有关数据,你认为工业上氧化操作时应采取的条件是__________________________ 。
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___________________ 范围。操作Ⅰ的名称是_________________ 。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是__________________ 、________________ 、过滤、洗涤、干燥。

| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |

请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在
(4)溶液 C 得到CuSO4·5H2O的主要步骤是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】草酸钠( )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数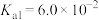 ,
,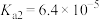 ,碳酸的电离常数
,碳酸的电离常数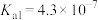 ,
,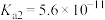 。回答下列问题:
。回答下列问题:
(1) 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为___________ 。
(2)相同条件下,同浓度的① ,②
,②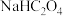 ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为___________ (用编号表示)。
(3)将等浓度、等体积的 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是___________ 。
a.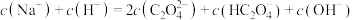
b.
c.
d.
(4) 溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的 溶液。
溶液。
①需托盘天平称取 固体
固体___________ g。
②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有___________ 。
(5)用 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:
步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤II:用(4)中配制的 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:
①滴定终点判断的依据是___________ 。
②样品中 的质量分数为
的质量分数为___________ 。
③若(4)中称取的 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数___________ (填“偏高”、“偏低”或“不变”)。
 )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数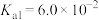 ,
,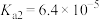 ,碳酸的电离常数
,碳酸的电离常数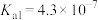 ,
,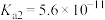 。回答下列问题:
。回答下列问题:(1)
 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为(2)相同条件下,同浓度的①
 ,②
,②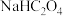 ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为(3)将等浓度、等体积的
 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是a.
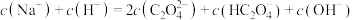
b.

c.

d.

(4)
 溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的 溶液。
溶液。①需托盘天平称取
 固体
固体②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有
(5)用
 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤II:用(4)中配制的
 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:| 第1次 | 第2次 | 第3次 | |
消耗 溶液的体积/mL 溶液的体积/mL | 49.80 | 46.75 | 50.20 |
②样品中
 的质量分数为
的质量分数为③若(4)中称取的
 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】草酸(H2C2O4)是一种常见二元弱酸,易溶于水,常用来做还原剂、沉淀剂、媒染剂、络合剂等。某化学学习兴趣小组欲制备草酸并探究其某些化学性质,经查找资料:乙炔在45-55℃硝酸汞作催化剂的条件下,经浓硝酸氧化可制得草酸。
[草酸的制备]
甲同学以电石(主要成分CaC2)、浓硝酸及少量硝酸汞为原料,利用如图装置制备草酸。

(1)仪器a的名称_______
(2)实验室制乙炔时用饱和食盐水代替水的目的是。_______ 。反应时C中产生大量红棕色气体,请写出C中发生化学反应方程式_______ 。
[产品中草酸晶体(H2C2O4·2H2O)质量分数的测定]
乙同学准确称取ag产品,配成100mL水溶液,取20mL所配制的溶液置于锥形瓶内,用cmol·L-1酸性KMnO4标准溶液滴定至终点,平行实验三次,平均消耗标准溶液vmL。试回答:
(3)上述滴定实验中发生的离子反应方程式_______ ,判断到达滴定终点的现象是_______ 。
(4)产品中草酸晶体(H2C2O4·2H2O)的质量分数为_______ (用a、v表示)
[草酸的性质]
(5)上述酸性高锰酸钾与草酸反应,体现了草酸_______ (填酸性、氧化性或还原性)
(6)室温下已知:Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.5×104,通过下列实验探究草酸的性质。[1g2=0.3,lg3=0.5]。向10mL0.1mol/LH2C2O4溶液中逐滴加入VmL0.1mol/LNaOH溶液,当V从0逐渐增大至20时,测得混合溶液的pH逐渐增大,下列说法正确的是_______(填字母)
[草酸的制备]
甲同学以电石(主要成分CaC2)、浓硝酸及少量硝酸汞为原料,利用如图装置制备草酸。

(1)仪器a的名称
(2)实验室制乙炔时用饱和食盐水代替水的目的是。
[产品中草酸晶体(H2C2O4·2H2O)质量分数的测定]
乙同学准确称取ag产品,配成100mL水溶液,取20mL所配制的溶液置于锥形瓶内,用cmol·L-1酸性KMnO4标准溶液滴定至终点,平行实验三次,平均消耗标准溶液vmL。试回答:
(3)上述滴定实验中发生的离子反应方程式
(4)产品中草酸晶体(H2C2O4·2H2O)的质量分数为
[草酸的性质]
(5)上述酸性高锰酸钾与草酸反应,体现了草酸
(6)室温下已知:Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.5×104,通过下列实验探究草酸的性质。[1g2=0.3,lg3=0.5]。向10mL0.1mol/LH2C2O4溶液中逐滴加入VmL0.1mol/LNaOH溶液,当V从0逐渐增大至20时,测得混合溶液的pH逐渐增大,下列说法正确的是_______(填字母)
A.当V=10时,溶液中离子浓度关系:c(Na+)>c(HC2O )>c(C2O )>c(C2O )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
B.当溶液中c(C2O )=c(HC2O )=c(HC2O )时,混合溶液的pH约为3.8 )时,混合溶液的pH约为3.8 |
C.当溶液中c(C2O )+c(HC2O )+c(HC2O )=c(Na+)时,混合溶液的pH=7 )=c(Na+)时,混合溶液的pH=7 |
D.当溶液中c(Na+)=2c(C2O )+2c(HC2O )+2c(HC2O )+2c(H2C2O4)时,混合溶液的pH>7 )+2c(H2C2O4)时,混合溶液的pH>7 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】碲及其化合物是半导体材料。
(1)25℃时,H2TeO3(亚碲酸):Ka1=1.0×10-3、Ka2=2.0×10-8。在该温度下,0.1mol·L-1H2TeO3溶液的pH约为_____________ (填代号)。
A.0.7B.1C.2D.5
NaHTeO3溶液中,H2TeO3、HTeO3-、TeO32-浓度大小的排序为____________________ 。
(2)工业上,常用铜阳极泥(主要成分是Cu2Te,含少量的Ag、Au)冶炼碲,其工艺流程如下(已知TeO2微溶于水,易与浓强碱.浓强酸反应):

①铜阳极泥溶于硫酸时加压的目的是_____________________________________________ ;
若调节pH时,pH过低,则粗碲产率会_____________ (填“增大”“减小”或“不变”)。
②上述流程中可以循环利用的物质是____________________ 。
③写出铜阳极泥转化成TeO2的化学方程式:___________________________________________ 。
(1)25℃时,H2TeO3(亚碲酸):Ka1=1.0×10-3、Ka2=2.0×10-8。在该温度下,0.1mol·L-1H2TeO3溶液的pH约为
A.0.7B.1C.2D.5
NaHTeO3溶液中,H2TeO3、HTeO3-、TeO32-浓度大小的排序为
(2)工业上,常用铜阳极泥(主要成分是Cu2Te,含少量的Ag、Au)冶炼碲,其工艺流程如下(已知TeO2微溶于水,易与浓强碱.浓强酸反应):

①铜阳极泥溶于硫酸时加压的目的是
若调节pH时,pH过低,则粗碲产率会
②上述流程中可以循环利用的物质是
③写出铜阳极泥转化成TeO2的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】铁、铝是重要的金属材料,铁、铝及其化合物有非常重要的用途。
(1)下列说法正确的是__________________  填序号
填序号 。
。
①配制氯化铁溶液,先将 固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度
固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度
② 只能通过置换反应生成,
只能通过置换反应生成, 只能通过化合反应生成
只能通过化合反应生成
③利用氯水和KSCN溶液可以检验 中有无
中有无
④加热蒸干 溶液获得
溶液获得 固体
固体
⑤含a mol 的溶液和含
的溶液和含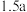 mol NaOH的溶液,无论正滴和反滴,生成
mol NaOH的溶液,无论正滴和反滴,生成 的质量相等
的质量相等
⑥由于金属铝性质稳定,所以Al在空气中能稳定存在
(2)高铁酸钾 是一种高效多功能水处理剂。其作用原理为
是一种高效多功能水处理剂。其作用原理为__________________
(3) 以铝土矿
以铝土矿 主要成分为
主要成分为 和
和 、
、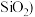 为原料制备铝的一种工艺流程如下:
为原料制备铝的一种工艺流程如下:
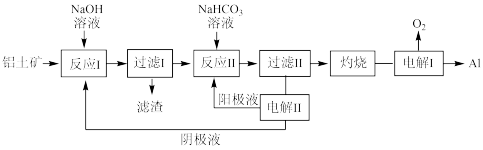
①滤渣主要成分为___________________________
②在实验室灼烧操作应选择的实验仪器为____________________________
③反应II中,加入 一段时间才有沉淀生成,写出加入少量
一段时间才有沉淀生成,写出加入少量 时发生反应的离子方程式
时发生反应的离子方程式____________________________________________
(4)已知 时
时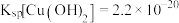
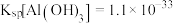 在
在 下,向浓度均为
下,向浓度均为 的
的 和
和 混合溶液中逐滴加入氨水,先生成
混合溶液中逐滴加入氨水,先生成________________ 沉淀 填化学式
填化学式 。
。
(1)下列说法正确的是
 填序号
填序号 。
。①配制氯化铁溶液,先将
 固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度
固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度②
 只能通过置换反应生成,
只能通过置换反应生成, 只能通过化合反应生成
只能通过化合反应生成③利用氯水和KSCN溶液可以检验
 中有无
中有无
④加热蒸干
 溶液获得
溶液获得 固体
固体⑤含a mol
 的溶液和含
的溶液和含 mol NaOH的溶液,无论正滴和反滴,生成
mol NaOH的溶液,无论正滴和反滴,生成 的质量相等
的质量相等⑥由于金属铝性质稳定,所以Al在空气中能稳定存在
(2)高铁酸钾
 是一种高效多功能水处理剂。其作用原理为
是一种高效多功能水处理剂。其作用原理为(3)
 以铝土矿
以铝土矿 主要成分为
主要成分为 和
和 、
、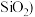 为原料制备铝的一种工艺流程如下:
为原料制备铝的一种工艺流程如下:
①滤渣主要成分为
②在实验室灼烧操作应选择的实验仪器为
③反应II中,加入
 一段时间才有沉淀生成,写出加入少量
一段时间才有沉淀生成,写出加入少量 时发生反应的离子方程式
时发生反应的离子方程式(4)已知
 时
时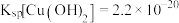
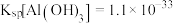 在
在 下,向浓度均为
下,向浓度均为 的
的 和
和 混合溶液中逐滴加入氨水,先生成
混合溶液中逐滴加入氨水,先生成 填化学式
填化学式 。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
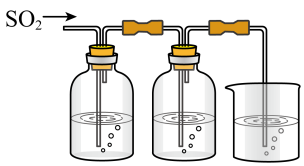
FeCl3溶液含有淀粉的碘水NaOH溶液
ABC
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在_________ 中,再加水稀释,这样操作的目的是_____________________________ 。
(2)装置C的作用是____________________________________________ 。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、__________ 、自然干燥,在这一系列操作中没有用到的仪器有________________________ (填序号)。
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式_____________________________ ;
②请设计实验方案检验有Fe2+生成____________________________________ ;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO 。该做法
。该做法_________ (填“合理”或“不合理”),理由是______________________ 。
(5)能表明I-的还原性弱于SO2的现象是_____________________________________________ 。

FeCl3溶液含有淀粉的碘水NaOH溶液
ABC
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在
(2)装置C的作用是
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式
②请设计实验方案检验有Fe2+生成
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO
 。该做法
。该做法(5)能表明I-的还原性弱于SO2的现象是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。
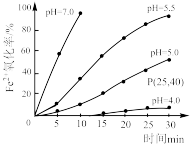
回答下列问题:
(1)写出Fe2+水解的离子方程式___ ;要抑制FeSO4水解,可以采取的措施是___ 。
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+的氧化速率___ 。
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2+4H+ 4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是
4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___ 。
a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响___ 。
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O,若取20mL待测溶液,用0.0200mol·L−1K2Cr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=___ mol·L−1。

回答下列问题:
(1)写出Fe2+水解的离子方程式
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+的氧化速率
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2+4H+
 4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是
4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O,若取20mL待测溶液,用0.0200mol·L−1K2Cr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=
您最近一年使用:0次
【推荐1】I.查阅文献发现可用多种方法制备纳米Cu2O。
①方法Ⅰ:炭粉在高温条件下还原CuO制备纳米Cu2O
已知:2Cu2O(s)+O2(g)=4CuO(s)△H=-292kJ•-1mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
请写出足量炭粉与CuO(s)制备Cu2O(s)的热化学方式___________ 。
②方法Ⅱ:加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米Cu2O,同时放出N2,写出该制法的化学方程式___________ 。
II.CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应:CO(g)+2H2(g) CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
①该反应的平衡常数K=___________ (保留两位小数)。
②恒温恒容条件下,可以说明反应已达到平衡状态的是___________ 。
A.v正(CO)=2v逆(H2)B.混合气体的密度不变
C.混合气体的平均相对分子质量不变D.CH3OH、CO、H2的浓度都不再发生变化
③若将容器体积压缩到1L,则达到新平衡时c(H2)___________ 2mol·L-1(填“>”<”或“=”)。
④若保持容器体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___________ v逆(填“>”<”或“=”)。
Ⅲ.燃料电池能量转化率高,具有广阔的发展前景。如图是甲烷燃料电池原理示意图。
①电池的负极是___________ (填“a”或“b”)。
②a极的电极反应式为___________ 。
①方法Ⅰ:炭粉在高温条件下还原CuO制备纳米Cu2O
已知:2Cu2O(s)+O2(g)=4CuO(s)△H=-292kJ•-1mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
请写出足量炭粉与CuO(s)制备Cu2O(s)的热化学方式
②方法Ⅱ:加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米Cu2O,同时放出N2,写出该制法的化学方程式
II.CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应:CO(g)+2H2(g)
 CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:| 物质 | CO | H2 | CH3OH |
| 平衡浓度(mol·L-1) | 0.9 | 1.0 | 0.6 |
①该反应的平衡常数K=
②恒温恒容条件下,可以说明反应已达到平衡状态的是
A.v正(CO)=2v逆(H2)B.混合气体的密度不变
C.混合气体的平均相对分子质量不变D.CH3OH、CO、H2的浓度都不再发生变化
③若将容器体积压缩到1L,则达到新平衡时c(H2)
④若保持容器体积不变,再充入0.6molCO和0.4molCH3OH,此时v正
Ⅲ.燃料电池能量转化率高,具有广阔的发展前景。如图是甲烷燃料电池原理示意图。

①电池的负极是
②a极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是(填序号)______ 。
A.NaOH+HCl=NaCl+H2O B.Na2CO3+2HCl=2NaCl+H2O+CO2↑
C.2H2O=2H2↑+O2↑ D.Cu+2AgNO3=2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。有关实验现象,下列说法正确的是:_______ (填序号)
A.图I和图II的气泡均产生在锌棒表面
B.图II中产生气体的速度比I快
C.图I中温度计的示数高于图II的示数
D.图I和图II中温度计的示数相等,且均高于室温
(3)大气污染越来越成为人们关注的问题.烟气中的NOx必须脱除(即脱硝)后才能排放。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=一890.3kJ·mol-l
N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-1
CH4可用于脱硝,写出该反应热化学反应式________ 。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极反应式为:__________ 。
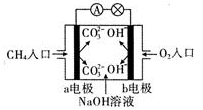
②电池工作一段时间后电解质溶液的pH________ (填“增大”“减小”或“不变”)。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池。试写出该电池的正极反应式_________ 。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是(填序号)
A.NaOH+HCl=NaCl+H2O B.Na2CO3+2HCl=2NaCl+H2O+CO2↑
C.2H2O=2H2↑+O2↑ D.Cu+2AgNO3=2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。有关实验现象,下列说法正确的是:
A.图I和图II的气泡均产生在锌棒表面
B.图II中产生气体的速度比I快
C.图I中温度计的示数高于图II的示数
D.图I和图II中温度计的示数相等,且均高于室温

(3)大气污染越来越成为人们关注的问题.烟气中的NOx必须脱除(即脱硝)后才能排放。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=一890.3kJ·mol-l
N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-1
CH4可用于脱硝,写出该反应热化学反应式
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极反应式为:

②电池工作一段时间后电解质溶液的pH
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池。试写出该电池的正极反应式
您最近一年使用:0次
【推荐3】乙烯是一种重要的基本化工原料,传统方法由丁烷裂解制备,现代工艺中利用乙烷的氧化裂解获得。两种工业方法的原理如下:
I.CH3CH2CH2CH3(g) CH2=CH2(g)+CH3CH3(g) △H1
CH2=CH2(g)+CH3CH3(g) △H1
II.C2H6(g)+ O2(g)
O2(g) C2H4(g)+H2O(g) △H2=-110 kJ/mol
C2H4(g)+H2O(g) △H2=-110 kJ/mol
(1)化学上,将稳定单质的能量定为0,由元素的单质化合生成1 mol单一化合物的反应热叫该化合物的生成热,生成热可表示该物质的相对能量。25℃、101 kPa下几种有机物的生成热如下表所示(a、b、c均大于零) :
由正丁烷裂解生成乙烯的△H1=______ kJ/mol (用含a、b、c的式子表示)。
(2)在一定温度下,向恒压密闭容器中充入一定量正丁烷,反应生成乙烯和乙烷,经过一段时间达到平衡状态,则下列情况下不能说明该反应达到平衡状态的是______ (填标号)。
A.反应热△H保持不变 B.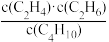 保持不变
保持不变
C.气体密度保持不变 D.正丁烷生成速率与乙烯消耗速率相等
(3)乙烷的氧化裂解反应物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),如图为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是_______ ,反应的最佳温度为________ (填序号)。

A.700℃ B.750℃ C.850℃ D.900℃
[乙烯的选择性=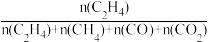 ,乙烯收率=乙烷转化率×乙烯选择性]
,乙烯收率=乙烷转化率×乙烯选择性]
(4)工业上,保持体系总压恒定为100 kP的条件下进行反应II,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是_________________ 。反应达平衡时,各组分的体积分数如表:
计算该温度下的平衡常数Kp=_______ 。
(5)乙烯—空气燃料电池以熔融的K2CO3为电解质时,该燃料电池的正极反应式为2CO2+O2+4e-=2 , 则负极反应式为
, 则负极反应式为______ 。
I.CH3CH2CH2CH3(g)
 CH2=CH2(g)+CH3CH3(g) △H1
CH2=CH2(g)+CH3CH3(g) △H1II.C2H6(g)+
 O2(g)
O2(g) C2H4(g)+H2O(g) △H2=-110 kJ/mol
C2H4(g)+H2O(g) △H2=-110 kJ/mol(1)化学上,将稳定单质的能量定为0,由元素的单质化合生成1 mol单一化合物的反应热叫该化合物的生成热,生成热可表示该物质的相对能量。25℃、101 kPa下几种有机物的生成热如下表所示(a、b、c均大于零) :
物质 | 乙烷 | 乙烯 | 正丁烷 |
生成热/ (kJ/mol ) | -a | b | -c |
由正丁烷裂解生成乙烯的△H1=
(2)在一定温度下,向恒压密闭容器中充入一定量正丁烷,反应生成乙烯和乙烷,经过一段时间达到平衡状态,则下列情况下不能说明该反应达到平衡状态的是
A.反应热△H保持不变 B.
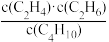 保持不变
保持不变C.气体密度保持不变 D.正丁烷生成速率与乙烯消耗速率相等
(3)乙烷的氧化裂解反应物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),如图为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是

A.700℃ B.750℃ C.850℃ D.900℃
[乙烯的选择性=
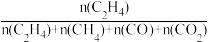 ,乙烯收率=乙烷转化率×乙烯选择性]
,乙烯收率=乙烷转化率×乙烯选择性](4)工业上,保持体系总压恒定为100 kP的条件下进行反应II,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是
C2H6 | O2 | C2H4 | H2O | 其他物质 |
2.4% | 1.0% | 12% | 15% | 69.6% |
计算该温度下的平衡常数Kp=
(5)乙烯—空气燃料电池以熔融的K2CO3为电解质时,该燃料电池的正极反应式为2CO2+O2+4e-=2
 , 则负极反应式为
, 则负极反应式为
您最近一年使用:0次



