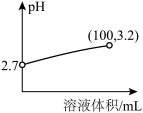
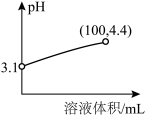
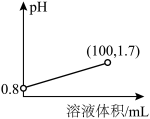
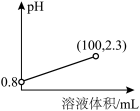
氰化钠(NaCN)是一种重要的化工原料,用于电镀、冶金和有机合成医药,农药及金属处理等方面。已知:氰化钠为白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味,剧毒。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性。
(1)氰化钠中碳元素的化合价+2价,N元素显-3价,则非金属性N__________ C(填<,=或>),用离子方程式表示NaCN溶液呈强碱性的原因:____________________ 。
(2)已知:
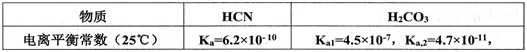
则向NaCN溶液通入少量CO2反应的离子方程式:____________________
(3)用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法错误的是________________ 。
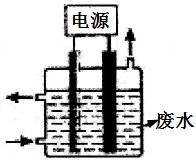
A.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
B.用石墨作阳极,铁作阴极
C.阴极的电极反应式为:2H2O+2e-=H2↑+2OH-
D.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
(4)氰化钠可用双氧水进行消毒处理。
用双氧水处理氰化钠产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式____________________ ;
(5)化合物(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,试写出(CN)2与NaOH溶液反应的化学方程式:____________________ 。
(1)氰化钠中碳元素的化合价+2价,N元素显-3价,则非金属性N
(2)已知:
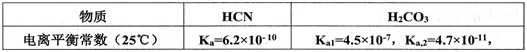
则向NaCN溶液通入少量CO2反应的离子方程式:
(3)用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法错误的是

A.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
B.用石墨作阳极,铁作阴极
C.阴极的电极反应式为:2H2O+2e-=H2↑+2OH-
D.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
(4)氰化钠可用双氧水进行消毒处理。
用双氧水处理氰化钠产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式
(5)化合物(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,试写出(CN)2与NaOH溶液反应的化学方程式:
更新时间:2017/11/23 20:44:46
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】甲、乙两同学拟用试验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_________ 。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH___________ 1(选填“>”、“<”或“=”)。简要说明pH试纸的使用方法:_________________ 。
(3)乙方案中,说明HA是弱电解质的现象是_____________ 。
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH
(3)乙方案中,说明HA是弱电解质的现象是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】常温下,某些一元弱酸的电离常数如表所示。
已知:① ;
;
②不考虑溶液混合时体积和温度的变化。
回答下列问题:
(1)HF在水中的电离方程式为_____
(2)酸性:HCN_____ (填“ ”“
”“ ”或“
”或“ ”)HNO2。
”)HNO2。
(3)常温下,将10mL0.2mol/L的CH3COOH溶液加水稀释至100mL:
①稀释过程中溶液的pH随溶液体积变化的曲线正确的是_____ (填标号)。
②稀释过程中,下列各项始终保持减小趋势的是_____ (填标号)。
A.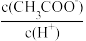 B.Kw×c(OH-) C.
B.Kw×c(OH-) C.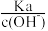 D.
D.
③常温下,0.02mol/L的CH3COOH溶液中,CH3COOH的电离度________ %。
(4)常温下,准确量取20.00mL0.1mol/LHNO2溶液:
①0.1mol/LHNO2溶液中,各离子浓度由大到小的顺序为_____ 。
②若向未知体积0.1mol/L的HNO2溶液中滴加等体积一定浓度的稀硫酸,测得混合溶液中的c(H+)=0.02mol/L,则混合溶液中 =
=_____ 。
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 6.4×10-10 | 6.4×10-4 | 1.8×10-5 | 5.0×10-4 |
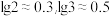 ;
;②不考虑溶液混合时体积和温度的变化。
回答下列问题:
(1)HF在水中的电离方程式为
(2)酸性:HCN
 ”“
”“ ”或“
”或“ ”)HNO2。
”)HNO2。(3)常温下,将10mL0.2mol/L的CH3COOH溶液加水稀释至100mL:
①稀释过程中溶液的pH随溶液体积变化的曲线正确的是
|
|
|
|
 |  | C |  |
A.
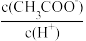 B.Kw×c(OH-) C.
B.Kw×c(OH-) C.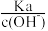 D.
D.
③常温下,0.02mol/L的CH3COOH溶液中,CH3COOH的电离度
(4)常温下,准确量取20.00mL0.1mol/LHNO2溶液:
①0.1mol/LHNO2溶液中,各离子浓度由大到小的顺序为
②若向未知体积0.1mol/L的HNO2溶液中滴加等体积一定浓度的稀硫酸,测得混合溶液中的c(H+)=0.02mol/L,则混合溶液中
 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 是目前大气中含量最高的一种温室气体。
是目前大气中含量最高的一种温室气体。 的捕获与重整是
的捕获与重整是 利用的研究热点。
利用的研究热点。
(1)在催化剂作用下,可用 与
与 反应制取甲酸。已知:
反应制取甲酸。已知:
则
___________  。
。
(2)在刚性密闭容器中, 平衡时的体积分数随投料比
平衡时的体积分数随投料比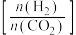 的变化如图所示:
的变化如图所示:
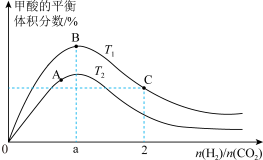
①图中 、
、 表示不同的反应温度,判断
表示不同的反应温度,判断
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②A、B、C三点 的平衡转化率
的平衡转化率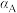 、
、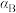 、
、 ,由大到小的顺序为
,由大到小的顺序为___________ 。
(3) 可以被
可以被 溶液捕获,当溶液
溶液捕获,当溶液 时,所得溶液中
时,所得溶液中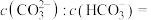
___________ 。(室温下,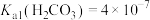 ,
,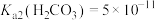 )。
)。
(4)二氧化碳的重整利用的另一方式为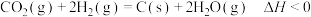 。
。
在250℃时,向体积为2L恒容密闭容器中通入 和
和 发生该反应,测得容器内气压变化如图所示。
发生该反应,测得容器内气压变化如图所示。
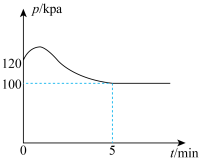
①为提高平衡时 的转化率,反应条件应选择
的转化率,反应条件应选择___________ (填标号)。
A.高压 B.低压 C.低温 D.高温
②该温度下的平衡常数
___________ 。
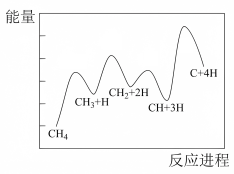
(5)一定条件下, 分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第___________ 步反应。
 是目前大气中含量最高的一种温室气体。
是目前大气中含量最高的一种温室气体。 的捕获与重整是
的捕获与重整是 利用的研究热点。
利用的研究热点。(1)在催化剂作用下,可用
 与
与 反应制取甲酸。已知:
反应制取甲酸。已知:| 共价键 |  |  |  |  |  |
键能 | 799 | 343 | 436 | 463 | 413 |

 。
。(2)在刚性密闭容器中,
 平衡时的体积分数随投料比
平衡时的体积分数随投料比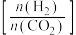 的变化如图所示:
的变化如图所示:
①图中
 、
、 表示不同的反应温度,判断
表示不同的反应温度,判断
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②A、B、C三点
 的平衡转化率
的平衡转化率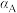 、
、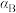 、
、 ,由大到小的顺序为
,由大到小的顺序为(3)
 可以被
可以被 溶液捕获,当溶液
溶液捕获,当溶液 时,所得溶液中
时,所得溶液中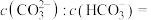
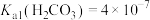 ,
,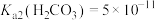 )。
)。(4)二氧化碳的重整利用的另一方式为
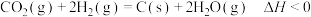 。
。在250℃时,向体积为2L恒容密闭容器中通入
 和
和 发生该反应,测得容器内气压变化如图所示。
发生该反应,测得容器内气压变化如图所示。
①为提高平衡时
 的转化率,反应条件应选择
的转化率,反应条件应选择A.高压 B.低压 C.低温 D.高温
②该温度下的平衡常数

(5)一定条件下,
 分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
真题
名校
【推荐1】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
①可以判断该分解反应已经达到平衡的是______ 。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:________
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是________ (填“增加”,“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变△H______ O(填“>”、“=”或“<”),熵变△S_______ O(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2O NH4HCO2+NH3・H2O
NH4HCO2+NH3・H2O
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)时间的变化趋势如图所示。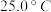 时,0-6min 氨基甲酸铵水解反应的平均速率
时,0-6min 氨基甲酸铵水解反应的平均速率______ 。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:_____ 。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)
 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol・L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是
④氨基甲酸铵分解反应的焓变△H
(2)已知:NH2COONH4+2H2O
 NH4HCO2+NH3・H2O
NH4HCO2+NH3・H2O该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)时间的变化趋势如图所示。
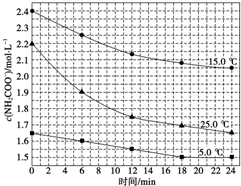
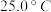 时,0-6min 氨基甲酸铵水解反应的平均速率
时,0-6min 氨基甲酸铵水解反应的平均速率⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义.
(1)海水中无机碳的存在形式及分布如下图所示:

用离子方程式表示海水呈弱碱性的原因______________ .已知春季海水pH=8.1,预测夏季海水碱性将会_____________ (填写“增强”或“减弱”),理由是_________________________ .
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)⇌CH3OH(g) △H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇.如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.下列说法正确的是_______________ .

A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol co和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol co和4mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:

①NO的作用是___________________ 。
②已知:O3(g)+0(g)=202(g) △H=-143kJ·mol-l
反应1: O3(g)+NO(g)⇌NO2(g)+O2(g) △H1=-200.2kJ·mol-l
反应2:热化学方程式为_____________________ 。
(4)大气污染物SO2可用NaOH吸收.已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol· L-1 NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示.b点所得溶液中各离子浓度由大到小的顺序是________________ ;c点所得溶液中:c(Na+)___________ 3c(HSO3-)(填“>”、“<”或“=”).

(1)海水中无机碳的存在形式及分布如下图所示:

用离子方程式表示海水呈弱碱性的原因
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)⇌CH3OH(g) △H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇.如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.下列说法正确的是

A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol co和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol co和4mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:

①NO的作用是
②已知:O3(g)+0(g)=202(g) △H=-143kJ·mol-l
反应1: O3(g)+NO(g)⇌NO2(g)+O2(g) △H1=-200.2kJ·mol-l
反应2:热化学方程式为
(4)大气污染物SO2可用NaOH吸收.已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol· L-1 NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示.b点所得溶液中各离子浓度由大到小的顺序是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
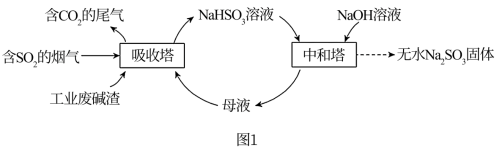
【推荐3】直接排放含 的烟气会危害环境。利用工业废碱渣(主要成分
的烟气会危害环境。利用工业废碱渣(主要成分 )可吸收烟气中的
)可吸收烟气中的 并制备无水
并制备无水 ,其流程如图1。
,其流程如图1。
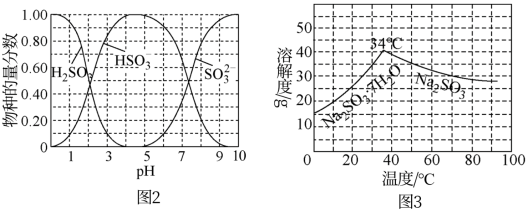
已知: 、HSO
、HSO 、SO
、SO 在水溶液中的物质的量分数随pH的分布如图2,
在水溶液中的物质的量分数随pH的分布如图2, 和
和 的溶解度曲线如图3。
的溶解度曲线如图3。
(1) 溶液显碱性,用离子方程式解释其原因:
溶液显碱性,用离子方程式解释其原因:___________ 。
(2)吸收烟气
①为提高 的产率,应控制吸收塔中的pH范围为
的产率,应控制吸收塔中的pH范围为___________ 。
② 溶液中
溶液中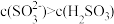 ,结合方程式解释其原因:
,结合方程式解释其原因:___________ 。
③吸收塔中的温度不宜过高,可能的原因是___________ (写出1个即可)。
(3)制备无水
将中和塔中得到的 溶液
溶液___________ (填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水 固体。
固体。
 的烟气会危害环境。利用工业废碱渣(主要成分
的烟气会危害环境。利用工业废碱渣(主要成分 )可吸收烟气中的
)可吸收烟气中的 并制备无水
并制备无水 ,其流程如图1。
,其流程如图1。
已知:
 、HSO
、HSO 、SO
、SO 在水溶液中的物质的量分数随pH的分布如图2,
在水溶液中的物质的量分数随pH的分布如图2, 和
和 的溶解度曲线如图3。
的溶解度曲线如图3。
(1)
 溶液显碱性,用离子方程式解释其原因:
溶液显碱性,用离子方程式解释其原因:(2)吸收烟气
①为提高
 的产率,应控制吸收塔中的pH范围为
的产率,应控制吸收塔中的pH范围为②
 溶液中
溶液中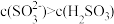 ,结合方程式解释其原因:
,结合方程式解释其原因:③吸收塔中的温度不宜过高,可能的原因是
(3)制备无水

将中和塔中得到的
 溶液
溶液 固体。
固体。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
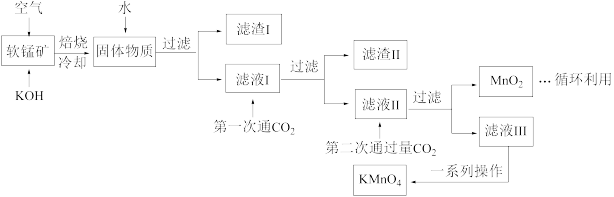
(1)配平焙烧时化学反应:________ MnO2+________ +________ O2
________ K2MnO4+________ H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因___________________________ 。
(2)滤渣Ⅱ的成分有_________ (化学式);第一次通CO2不能用稀盐酸代替的原因是_____________ 。
(3)第二次通入过量CO2生成MnO2的离子方程式为________________________ 。
(4)将滤液Ⅲ进行一系列操作得KMnO4。
由图可知,从滤液Ⅲ得到KMnO4需经过__________ 、___________ 、洗涤等操作。
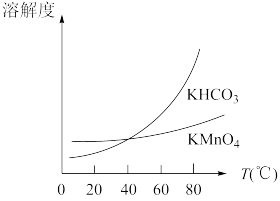
(5)工业上按上述流程连续生产。含MnO2 a%的软锰矿1吨,理论上最多可制KMnO4____________ 吨。(保留到小数点后三位)
(6)利用电解法可得到更纯的KMnO4用惰性电极电解滤液Ⅱ。
①电解槽阳极反应式为________________________________ 。
②阳极还可能有气体产生,该气体是____________ 。

(1)配平焙烧时化学反应:
(2)滤渣Ⅱ的成分有
(3)第二次通入过量CO2生成MnO2的离子方程式为
(4)将滤液Ⅲ进行一系列操作得KMnO4。
由图可知,从滤液Ⅲ得到KMnO4需经过

(5)工业上按上述流程连续生产。含MnO2 a%的软锰矿1吨,理论上最多可制KMnO4
(6)利用电解法可得到更纯的KMnO4用惰性电极电解滤液Ⅱ。
①电解槽阳极反应式为
②阳极还可能有气体产生,该气体是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g) 2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
①该反应的△H______ 0(填“>”、“=”或“<”)。
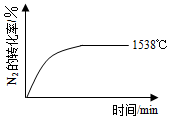
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,请补充完成1760℃时N2的转化率随时间变化的示意图。
________
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g) =4NO(g)+6H2O(1) 的反应热△H=_________ (用含a的代数式表示)。
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2 2NH3。则在电解法合成氨的过程中,应将H2不断地通入
2NH3。则在电解法合成氨的过程中,应将H2不断地通入______ 极(填“正”、“负”、“阴”或“阳”);在另一电极通入N2,该电极反应式为____________________ 。
(4)合成氨的反应N2(g)+3H2(g) 2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是
2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________ (填字母代号)。
a、升高温度
b、加入催化剂
c、增加H2的浓度
d、增加N2的浓度
e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________ 性(填“酸”、“碱”或“中”),可推断a_____ 0.01(填“大于”、“等于”或“小于”)。
(1)在不同温度下,反应N2(g)+O2(g)
 2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
2NO(g) △H=a kJ·mol-1的平衡常数K如下表:| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
①该反应的△H
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,请补充完成1760℃时N2的转化率随时间变化的示意图。

(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g) =4NO(g)+6H2O(1) 的反应热△H=
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2
 2NH3。则在电解法合成氨的过程中,应将H2不断地通入
2NH3。则在电解法合成氨的过程中,应将H2不断地通入(4)合成氨的反应N2(g)+3H2(g)
 2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是
2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是a、升高温度
b、加入催化剂
c、增加H2的浓度
d、增加N2的浓度
e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
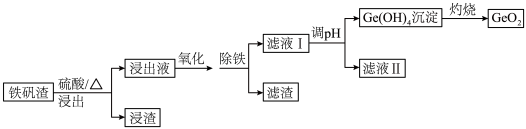
【推荐3】二氧化锗(GeO2)可用于制备半导体材料,某实验小组以铁矾渣(主要成分为FeO、CaO、GeO和SiO2等)为原料制取二氧化锗的工艺流程如下所示。
已知:25℃时,部分金属阳离子转化为氢氧化物沉淀时的pH如下表所示。
请回答下列问题:
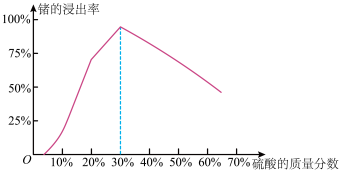
(1)由下图可知,“浸出”时,所用硫酸的最佳质量分数为________ ,浸渣的主要成分为________________ (填化学式)。
(2)“氧化”时,可选用的试剂为________ (填字母)。
A.KMnO4 B.NaOH C.H2O2 D.I2
(3)“氧化”时,若以适量稀硝酸作氧化剂,则Ge2+被氧化的离子方程式为________________ 。“氧化”后,选用K3[Fe(CN)6]溶液证明Fe2+已全部被氧化的实验现象为________________________________________________ 。
(4)“除铁”时,可选用Na2CO3为除铁剂,其原理为____________________________ 。
(5)已知Ge(OH)4,具有两性,在得到Ge(OH)4的过程中,若溶液的pH大于12,会导致Ge(OH)4溶解,写出该反应的离子方程式:________________________________ 。
(6)利用惰性电极电解酸性GeSO4溶液也可制得GeO2,则阳极的电极反应式为___________________ 。

已知:25℃时,部分金属阳离子转化为氢氧化物沉淀时的pH如下表所示。
| 离子 | Fe3+ | Mn2+ | Ge4+ |
| 开始沉淀时的pH | 2.3 | 8.3 | 8.2 |
| 沉淀完全时的pH | 4.1 | 9.8 | 11.2 |
请回答下列问题:
(1)由下图可知,“浸出”时,所用硫酸的最佳质量分数为

(2)“氧化”时,可选用的试剂为
A.KMnO4 B.NaOH C.H2O2 D.I2
(3)“氧化”时,若以适量稀硝酸作氧化剂,则Ge2+被氧化的离子方程式为
(4)“除铁”时,可选用Na2CO3为除铁剂,其原理为
(5)已知Ge(OH)4,具有两性,在得到Ge(OH)4的过程中,若溶液的pH大于12,会导致Ge(OH)4溶解,写出该反应的离子方程式:
(6)利用惰性电极电解酸性GeSO4溶液也可制得GeO2,则阳极的电极反应式为
您最近一年使用:0次