(1)①常温下,.某溶液中由水电离出的c(OH-)=1.0×10-10mol/L,该溶液可以是_________ 。(填选项)
A. pH=4的CH3COOH B.pH=10的NaOH C. pH=9的 Na2CO3
D. pH=2的 H2SO4 E. pH=4的 NH4C1
(2)常温下,aml/0.lmol/L盐酸与bmL0.lmol/L氨水混合,充分反应,若混合后溶液呈中性,则a____ b (填“<”、“>”或“=”)。
(3)常温下,amLpH=3的盐酸与bmLpH=11的氨水混合,充分反应,若a=b,,则反应后溶液中离子浓度从大到小的顺序是___________ 。
(4)氯化铝水溶液呈酸性,原因是(用离子方程式表示〉:___________ 。把A1Cl3溶液蒸干,灼烧,最后得到的主要固体产物是___________ 。
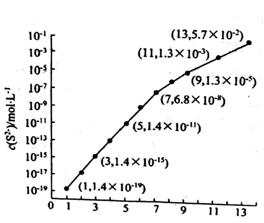
(5)25℃,在0.10 mol/LH2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下图(忽略溶液体积的变化、H2S的挥发)。
① pH=13时,溶液中的 c(H2S)+c(HS-)=_________ mol/L。
② 某溶液含 0.020 mol /LMn2+、0.10 mol/LH2S,当溶液pH=_____ 时,Mn2+开始沉淀。(Ksp(MnS) =2.8×10−13)
A. pH=4的CH3COOH B.pH=10的NaOH C. pH=9的 Na2CO3
D. pH=2的 H2SO4 E. pH=4的 NH4C1
(2)常温下,aml/0.lmol/L盐酸与bmL0.lmol/L氨水混合,充分反应,若混合后溶液呈中性,则a
(3)常温下,amLpH=3的盐酸与bmLpH=11的氨水混合,充分反应,若a=b,,则反应后溶液中离子浓度从大到小的顺序是
(4)氯化铝水溶液呈酸性,原因是(用离子方程式表示〉:
(5)25℃,在0.10 mol/LH2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下图(忽略溶液体积的变化、H2S的挥发)。
① pH=13时,溶液中的 c(H2S)+c(HS-)=
② 某溶液含 0.020 mol /LMn2+、0.10 mol/LH2S,当溶液pH=

更新时间:2017-12-07 19:26:03
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) , ΔH=-76.0 kJ·mol-1
②3FeO(s)+H2O(g)= Fe3O4(s)+H2(g) ΔH=-18.7 kJ·mol-1
(1)在上述反应中①中,每吸收1molCO2,就有_______ molFeO被氧化。
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式___________ 。
Ⅱ.一定条件下,二氧化碳转化为甲烷。向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g) CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
(3)在300℃是,将各物质按下列起始浓度(mol·L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是_____________ 。
(4)若保持温度不变,再向该容器内充入与起始量相等的CO2和H2,重新达到平衡时,CH4的浓
度________ (填字母)。
A.c(CH4)=0.8mol·L-1 B.0.8mol • L-1 >c(CH4) >1.6mol • L-1
C.c(CH4)=l.6mol·L-1 D.C(CH4)>1.6mol • L-1
(5)在300℃时,如果向该容器中加入CO20.8 mol·L-1、H21.0 mol·L-1、CH4 2.8 mol·L-1、H2O 2.0mol·L-1,则该可逆反应初始速率v正_____ v逆 (填“>” 或“<”)。
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H_________ 0(填“>”或“<”)。
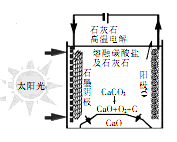
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e- =C+2CO32-,则阳极的电极反应式为______________ 。
Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) , ΔH=-76.0 kJ·mol-1
②3FeO(s)+H2O(g)= Fe3O4(s)+H2(g) ΔH=-18.7 kJ·mol-1
(1)在上述反应中①中,每吸收1molCO2,就有
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式
Ⅱ.一定条件下,二氧化碳转化为甲烷。向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。(3)在300℃是,将各物质按下列起始浓度(mol·L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是
| 选项 | CO | H2 | CH4 | H2O |
| A | 0 | 0 | 1 | 2 |
| B | 2 | 8 | 0 | 0 |
| C | 1 | 4 | 1 | .2 |
| D | 0.5 | 2 | 0.5 | 1 |
(4)若保持温度不变,再向该容器内充入与起始量相等的CO2和H2,重新达到平衡时,CH4的浓
度
A.c(CH4)=0.8mol·L-1 B.0.8mol • L-1 >c(CH4) >1.6mol • L-1
C.c(CH4)=l.6mol·L-1 D.C(CH4)>1.6mol • L-1
(5)在300℃时,如果向该容器中加入CO20.8 mol·L-1、H21.0 mol·L-1、CH4 2.8 mol·L-1、H2O 2.0mol·L-1,则该可逆反应初始速率v正
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e- =C+2CO32-,则阳极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】进入秋季,浙江省中部盆地区域雾霾天气时有发生,PM2.5污染较为严重,PM2.5约50%来源于某些气体污染物在空气中转变而成的二次颗粒物。氮氧化物、SO2是主要污染物。因此氮氧化物、SO2的处理成为化学家的重要课题。
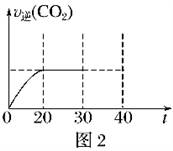
(1)如图1所示的电解装置( 电极均为惰性电极)可吸收SO2,并用阴极排出的溶液在碱性条件下吸收NO2,转化为无污染的N2和SO
电极均为惰性电极)可吸收SO2,并用阴极排出的溶液在碱性条件下吸收NO2,转化为无污染的N2和SO ,请写出阳极的电极反应式:
,请写出阳极的电极反应式:________________________________ ,写出阴极排出的溶液在碱性条件下吸收NO2的离子方程式:________________ 。

(2)活性炭具有催化和吸附作用,氮氧化物可以借助于活性炭来处理:C(s)+2NO(g) N2(g)+CO2(g)。为探究其催化效果,某化学兴趣小组在恒温(T1 ℃)条件下,将NO和足量的活性炭加入一恒容密闭的真空容器中,监测各物质的浓度并记录如下(忽略固体体积):
N2(g)+CO2(g)。为探究其催化效果,某化学兴趣小组在恒温(T1 ℃)条件下,将NO和足量的活性炭加入一恒容密闭的真空容器中,监测各物质的浓度并记录如下(忽略固体体积):

①分析表中数据,计算T1 ℃时该反应的化学平衡常数为________ (保留两位小数)。
②30 min后,改变某一条件,反应重新达到平衡,如图2表示CO2的逆反应速率[v逆(CO2)]随反应时间(t)的变化关系图。请在图中画出在30 min时刻改变上述条件,在40 min时刻再次达平衡的变化曲线。________
(1)如图1所示的电解装置(
 电极均为惰性电极)可吸收SO2,并用阴极排出的溶液在碱性条件下吸收NO2,转化为无污染的N2和SO
电极均为惰性电极)可吸收SO2,并用阴极排出的溶液在碱性条件下吸收NO2,转化为无污染的N2和SO ,请写出阳极的电极反应式:
,请写出阳极的电极反应式:
(2)活性炭具有催化和吸附作用,氮氧化物可以借助于活性炭来处理:C(s)+2NO(g)
 N2(g)+CO2(g)。为探究其催化效果,某化学兴趣小组在恒温(T1 ℃)条件下,将NO和足量的活性炭加入一恒容密闭的真空容器中,监测各物质的浓度并记录如下(忽略固体体积):
N2(g)+CO2(g)。为探究其催化效果,某化学兴趣小组在恒温(T1 ℃)条件下,将NO和足量的活性炭加入一恒容密闭的真空容器中,监测各物质的浓度并记录如下(忽略固体体积):
①分析表中数据,计算T1 ℃时该反应的化学平衡常数为
②30 min后,改变某一条件,反应重新达到平衡,如图2表示CO2的逆反应速率[v逆(CO2)]随反应时间(t)的变化关系图。请在图中画出在30 min时刻改变上述条件,在40 min时刻再次达平衡的变化曲线。

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】NOx是大气主要污染物。有效去除大气中的NOx是环境保护的重要课题。
已知:2NO(g)+O2(g) 2NO2(g)的反应过程分为两步:
2NO2(g)的反应过程分为两步:
第一步:2NO(g) N2O2(g) △H1<0;v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g) △H1<0;v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) 2NO2(g) △H2<0;v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g) △H2<0;v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)
(1)一定温度下,反应2NO(g)+O2(g) 2NO2(g)的平衡常数表达式是
2NO2(g)的平衡常数表达式是______ (用k1正,k2正,k1逆,k2逆表示)。
(2)将H2、NO、O2按体积之比为3:2:1充入恒温恒压(200℃,100Kpa)容器中,发生反应4H2(g)+2NO(g)+O2(g) N2(g)+4H2O(g)。达到平衡时,N2的体积分数为0.1。
N2(g)+4H2O(g)。达到平衡时,N2的体积分数为0.1。
①平衡时,NO的转化率为______ ,平衡常数Kp=______ (以平衡分压表示,平衡分压=平衡时总压×平衡时的物质的量分数)Kpa-2。
②已知该反应ΔH<0,初始温度、压强和反应物的用量均相同,下列四种容器中NO的转化率最高的是______ 。
A.恒温恒容容器 B.恒温恒压容器
C.恒容绝热容器 D.恒压绝热容器
③该反应需选择合适的催化剂进行,分别选用A,B,C三种不同的催化剂进行实验,所得结果如图所示(其它条件相同),则实际生产中适宜选择的催化剂是______ ,理由为______ 。______ 。
已知:2NO(g)+O2(g)
 2NO2(g)的反应过程分为两步:
2NO2(g)的反应过程分为两步:第一步:2NO(g)
 N2O2(g) △H1<0;v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g) △H1<0;v1正=k1正c2(NO),v1逆=k1逆c(N2O2)第二步:N2O2(g)+O2(g)
 2NO2(g) △H2<0;v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g) △H2<0;v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)(1)一定温度下,反应2NO(g)+O2(g)
 2NO2(g)的平衡常数表达式是
2NO2(g)的平衡常数表达式是(2)将H2、NO、O2按体积之比为3:2:1充入恒温恒压(200℃,100Kpa)容器中,发生反应4H2(g)+2NO(g)+O2(g)
 N2(g)+4H2O(g)。达到平衡时,N2的体积分数为0.1。
N2(g)+4H2O(g)。达到平衡时,N2的体积分数为0.1。①平衡时,NO的转化率为
②已知该反应ΔH<0,初始温度、压强和反应物的用量均相同,下列四种容器中NO的转化率最高的是
A.恒温恒容容器 B.恒温恒压容器
C.恒容绝热容器 D.恒压绝热容器
③该反应需选择合适的催化剂进行,分别选用A,B,C三种不同的催化剂进行实验,所得结果如图所示(其它条件相同),则实际生产中适宜选择的催化剂是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】I.高铁酸钾(K2FeO4)具有很强的氧化性,在生产,生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____ 。
(2)制备K2FeO4可以采用湿式氧化法,流程如图:

已知:①温度较低时,Cl2通入KOH溶液生成次氯酸盐;温度较高时,Cl2通入KOH溶液生成氯酸盐;②Fe(NO3)3溶液与KClO溶液在强碱性环境中生成K2FeO4。请回答下列问题:
①该生产工艺应在_____ (填“温度较高”或“温度较低”)的情况下进行。
②写出产生K2FeO4的离子方程式_________ 。
(3)实验室模拟工业电解法制取K2FeO4,装置如图.
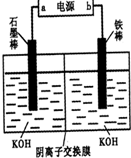
①此装置中电源的负极是______ (填“a”或“b”).
②阳极的电极反应式为______ .
II.常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因_____________ (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)_____ (填“>”、“<”或“=”)0.1mol/LNaOH溶液中由水电离出的c(H+)。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是
(2)制备K2FeO4可以采用湿式氧化法,流程如图:

已知:①温度较低时,Cl2通入KOH溶液生成次氯酸盐;温度较高时,Cl2通入KOH溶液生成氯酸盐;②Fe(NO3)3溶液与KClO溶液在强碱性环境中生成K2FeO4。请回答下列问题:
①该生产工艺应在
②写出产生K2FeO4的离子方程式
(3)实验室模拟工业电解法制取K2FeO4,装置如图.

①此装置中电源的负极是
②阳极的电极反应式为
II.常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因
(2)混合溶液中由水电离出的c(H+)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】羟胺( )在医药、农药等领域应用广泛。回答下列问题:
)在医药、农药等领域应用广泛。回答下列问题:
(1)已知:羟胺在水中主要以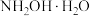 (弱碱)形式存在,电离方式与
(弱碱)形式存在,电离方式与 相似。将羟胺溶液加水稀释,
相似。将羟胺溶液加水稀释, 的值将
的值将___________ (填“增大”、“减小”或“不变”)。
(2)常温下,将0.1 盐酸分别滴入20.00
盐酸分别滴入20.00 0.1
0.1 羟胺溶液和20.00
羟胺溶液和20.00 0.1
0.1
 溶液中,测得溶液
溶液中,测得溶液 [
[ ]随滴入盐酸体积变化如图所示。
]随滴入盐酸体积变化如图所示。
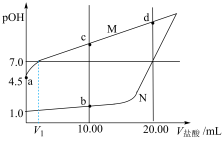
①图中表示盐酸滴定羟胺溶液的曲线是___________ (填“M”或“N”),反应的离子方程式为___________ 。
②常温下,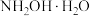 电离平衡常数的值约为
电离平衡常数的值约为___________  ;
;
___________ (保留小数点后2位数)。
③a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为___________ 。
④若将b、d点对应的溶液混合,则混合液呈___________ 性,混合液中
___________ 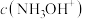 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
 )在医药、农药等领域应用广泛。回答下列问题:
)在医药、农药等领域应用广泛。回答下列问题:(1)已知:羟胺在水中主要以
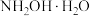 (弱碱)形式存在,电离方式与
(弱碱)形式存在,电离方式与 相似。将羟胺溶液加水稀释,
相似。将羟胺溶液加水稀释, 的值将
的值将(2)常温下,将0.1
 盐酸分别滴入20.00
盐酸分别滴入20.00 0.1
0.1 羟胺溶液和20.00
羟胺溶液和20.00 0.1
0.1
 溶液中,测得溶液
溶液中,测得溶液 [
[ ]随滴入盐酸体积变化如图所示。
]随滴入盐酸体积变化如图所示。
①图中表示盐酸滴定羟胺溶液的曲线是
②常温下,
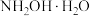 电离平衡常数的值约为
电离平衡常数的值约为 ;
;
③a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为
④若将b、d点对应的溶液混合,则混合液呈

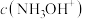 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】雪碧、可乐是深受人们青睐的碳酸型饮料.
Ⅰ.雪琩是一款柠檬味汽水饮料,其中所含酸性物质包括碳酸、柠檬酸、苯甲酸. 时,上述三种酸的电离常数如表所示:
时,上述三种酸的电离常数如表所示:
(1)上述三种酸的酸性由强到弱的顺序为____________ (填字母并用“>”符号连接)。
a.苯甲酸 b.碳酸 c.柠檬酸
(2)水中存在平衡 ,欲使平衡向右移动且溶液显碱性,下列方法可行的是
,欲使平衡向右移动且溶液显碱性,下列方法可行的是____________ (填字母)。
a.通入氨气 b.加入 c.加热至
c.加热至 d.加入
d.加入 固体
固体
(3)室温下,向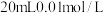 苯甲酸
苯甲酸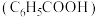 溶液中滴加等物质的量浓度的
溶液中滴加等物质的量浓度的 溶液,溶液的
溶液,溶液的 与加入
与加入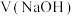 之间的关系如图所示,已知
之间的关系如图所示,已知 。
。

① 点溶液的
点溶液的
____________ (保留小数点后一位)。
②下列说法正确的有____________ 。
a.为准确判断滴定终点,可使用甲基橙做指示剂
b. 点溶液
点溶液 ,且有
,且有
c. 点溶液中一定存在
点溶液中一定存在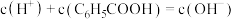
d.D点溶液中有
e.从 点到
点到 点,溶液中水的电离程度最小的是
点,溶液中水的电离程度最小的是 点
点
Ⅱ.可乐中的食品添加剂有白砂糖、二氧化碳、焦糖、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为 )有一定关系,已知磷酸电离常数为:
)有一定关系,已知磷酸电离常数为: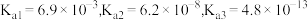
(4)室温下,测得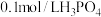 溶液的
溶液的 ,原因是
,原因是____________ (用电离方程式表示)。
(5)向含磷酸的溶液中滴加 溶液,此过程中各含磷微粒在溶液中的物质的量分数与
溶液,此过程中各含磷微粒在溶液中的物质的量分数与 的关系如图所示:
的关系如图所示:
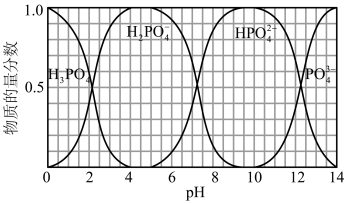
①溶液 由11增大到14的过程中,发生反应的离子方程式为
由11增大到14的过程中,发生反应的离子方程式为____________ 。
②若已知碳酸的电离常数,将磷酸滴入碳酸钠溶液中,发生反应的离子方程式错误的为____________ 。
A.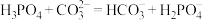 B.
B.
C.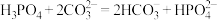 D.
D.
Ⅰ.雪琩是一款柠檬味汽水饮料,其中所含酸性物质包括碳酸、柠檬酸、苯甲酸.
 时,上述三种酸的电离常数如表所示:
时,上述三种酸的电离常数如表所示:| 物质 | 苯甲酸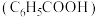 | 碳酸 | 柠檬酸 |
| 电离常数 |  |  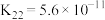 | 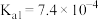 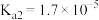  |
(1)上述三种酸的酸性由强到弱的顺序为
a.苯甲酸 b.碳酸 c.柠檬酸
(2)水中存在平衡
 ,欲使平衡向右移动且溶液显碱性,下列方法可行的是
,欲使平衡向右移动且溶液显碱性,下列方法可行的是a.通入氨气 b.加入
 c.加热至
c.加热至 d.加入
d.加入 固体
固体(3)室温下,向
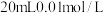 苯甲酸
苯甲酸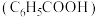 溶液中滴加等物质的量浓度的
溶液中滴加等物质的量浓度的 溶液,溶液的
溶液,溶液的 与加入
与加入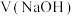 之间的关系如图所示,已知
之间的关系如图所示,已知 。
。
①
 点溶液的
点溶液的
②下列说法正确的有
a.为准确判断滴定终点,可使用甲基橙做指示剂
b.
 点溶液
点溶液 ,且有
,且有
c.
 点溶液中一定存在
点溶液中一定存在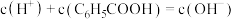
d.D点溶液中有

e.从
 点到
点到 点,溶液中水的电离程度最小的是
点,溶液中水的电离程度最小的是 点
点Ⅱ.可乐中的食品添加剂有白砂糖、二氧化碳、焦糖、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为
 )有一定关系,已知磷酸电离常数为:
)有一定关系,已知磷酸电离常数为: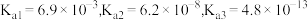
(4)室温下,测得
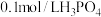 溶液的
溶液的 ,原因是
,原因是(5)向含磷酸的溶液中滴加
 溶液,此过程中各含磷微粒在溶液中的物质的量分数与
溶液,此过程中各含磷微粒在溶液中的物质的量分数与 的关系如图所示:
的关系如图所示:
①溶液
 由11增大到14的过程中,发生反应的离子方程式为
由11增大到14的过程中,发生反应的离子方程式为②若已知碳酸的电离常数,将磷酸滴入碳酸钠溶液中,发生反应的离子方程式错误的为
A.
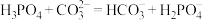 B.
B.
C.
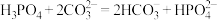 D.
D.
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】①醋酸、②盐酸、③一水合氨、④碳酸氢钠、⑤氯化钙、⑥氯化铵是实验室中的常见物质。
(1)写出一水合氨的电离方程式___________ 。
(2)碳酸氢钠溶液显碱性,结合化学用语解释原因:___________ 。
(3)有关0.1mol·L-1 CH3COOH溶液的叙述正确的是___________ 。
a.CH3COOH溶液中离子浓度关系满足:c(CH3COO-)>c(OH-)>c(H+)
b.常温下,等物质的量浓度、等体积CH3COOH溶液与NaOH溶液混合后溶液pH=7
c.向CH3COOH溶液中加少量CH3COONa固体,c(H+)减小
d.向CH3COOH溶液中加少量Na2CO3固体,c(CH3COO-)增大
e.与同浓度盐酸溶液的导电性相同
(4)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的c(H+)与氯化铵溶液中水电离出的c(H+)之比是___________ 。
(5)向饱和NaHCO3溶液中滴加饱和CaCl2溶液,可观察到先产生白色沉淀,后产生大量无色气泡,结合化学用语,从平衡移动角度解释原因___________ 。
(1)写出一水合氨的电离方程式
(2)碳酸氢钠溶液显碱性,结合化学用语解释原因:
(3)有关0.1mol·L-1 CH3COOH溶液的叙述正确的是
a.CH3COOH溶液中离子浓度关系满足:c(CH3COO-)>c(OH-)>c(H+)
b.常温下,等物质的量浓度、等体积CH3COOH溶液与NaOH溶液混合后溶液pH=7
c.向CH3COOH溶液中加少量CH3COONa固体,c(H+)减小
d.向CH3COOH溶液中加少量Na2CO3固体,c(CH3COO-)增大
e.与同浓度盐酸溶液的导电性相同
(4)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的c(H+)与氯化铵溶液中水电离出的c(H+)之比是
(5)向饱和NaHCO3溶液中滴加饱和CaCl2溶液,可观察到先产生白色沉淀,后产生大量无色气泡,结合化学用语,从平衡移动角度解释原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ. 下的某溶液中,
下的某溶液中,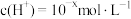 ,
,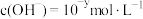 ,
, 与
与 的关系如下图所示:
的关系如下图所示:
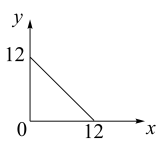
(1)在此温度下,向 溶液中逐滴加入
溶液中逐滴加入 的盐酸,测得混合溶液的部分
的盐酸,测得混合溶液的部分 如表所示:
如表所示:
假设溶液混合前后的体积变化忽略不计,则
_______ ,实验②中由水电离产生的
_______  。
。
(2)在此温度下,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得溶液的
混合,所得溶液的 为
为_______ 。
Ⅱ.在保持体系总压为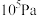 的条件下进行反应:
的条件下进行反应: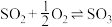 ,原料气中
,原料气中 和
和 的物质的量之比
的物质的量之比 不同时,
不同时, 的平衡转化率与温度
的平衡转化率与温度 的关系如图所示:
的关系如图所示:

(3)图中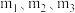 的大小顺序为
的大小顺序为_______ 。
(4)图中A点原料气的成分: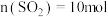 ,
,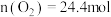 ,
, ,达平衡时
,达平衡时 的分压
的分压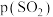 为
为_______  (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。
(5)若在容积均为2L的密闭容器内, 时按不同方式投入反应物,发生反应:
时按不同方式投入反应物,发生反应: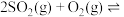
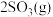
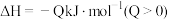 ,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
三个容器中的反应分别达平衡时下列各组数据关系正确的是_______(填字母)。
Ⅲ. 与
与 发生羰化反应形成的络合物可作为催化剂。
发生羰化反应形成的络合物可作为催化剂。 的羰化反应为:
的羰化反应为: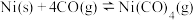
 ,
, 温度下测得一定的实验数据,计算
温度下测得一定的实验数据,计算 和
和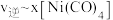 的关系如图所示:
的关系如图所示:
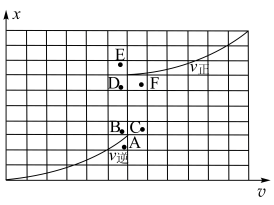
(6)当降低温度时,反应重新达到平衡, 和
和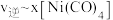 相对应的点分别为
相对应的点分别为_______ 、_______ (填字母)。
 下的某溶液中,
下的某溶液中,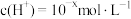 ,
,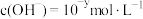 ,
, 与
与 的关系如下图所示:
的关系如下图所示:
(1)在此温度下,向
 溶液中逐滴加入
溶液中逐滴加入 的盐酸,测得混合溶液的部分
的盐酸,测得混合溶液的部分 如表所示:
如表所示:| 实验序号 |  溶液的体积/mL 溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |


 。
。(2)在此温度下,将
 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得溶液的
混合,所得溶液的 为
为Ⅱ.在保持体系总压为
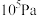 的条件下进行反应:
的条件下进行反应: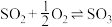 ,原料气中
,原料气中 和
和 的物质的量之比
的物质的量之比 不同时,
不同时, 的平衡转化率与温度
的平衡转化率与温度 的关系如图所示:
的关系如图所示:
(3)图中
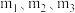 的大小顺序为
的大小顺序为(4)图中A点原料气的成分:
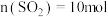 ,
,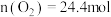 ,
, ,达平衡时
,达平衡时 的分压
的分压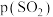 为
为 (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。(5)若在容积均为2L的密闭容器内,
 时按不同方式投入反应物,发生反应:
时按不同方式投入反应物,发生反应: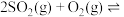
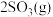
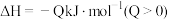 ,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 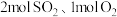 | 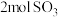 |  |
平衡时n( ) ) |  |  |  |
| 反应的能量变化 | 放出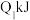 | 吸收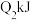 | 放出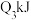 |
| 体系的压强 |  |  |  |
| 反应物的转化率 | 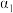 | 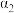 | 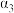 |
A.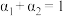 |
B.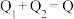 |
C. |
D. |
E. |
F.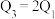 |
Ⅲ.
 与
与 发生羰化反应形成的络合物可作为催化剂。
发生羰化反应形成的络合物可作为催化剂。 的羰化反应为:
的羰化反应为: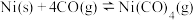
 ,
, 温度下测得一定的实验数据,计算
温度下测得一定的实验数据,计算 和
和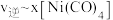 的关系如图所示:
的关系如图所示:
(6)当降低温度时,反应重新达到平衡,
 和
和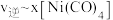 相对应的点分别为
相对应的点分别为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】酸碱中和实验是化学研究中重要的定量实验。
Ⅰ.25℃时,在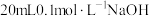 溶液中逐滴加入
溶液中逐滴加入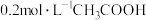 溶液,pH的变化曲线如图所示:
溶液,pH的变化曲线如图所示:
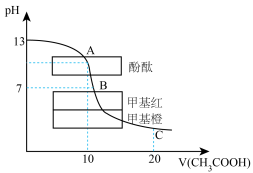
(1)A点溶液中离子浓度由大到小的顺序为___________ [用“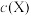 ”表示x的浓度,用“>”连接]。
”表示x的浓度,用“>”连接]。
(2)A→B过程中(不含A点,含B点),下列离子浓度大小关系可能出现的是___________。
(3)图中所示的三种指示剂,误差最大的是___________ 。
(4)滴定过程中水的电离情况如图所示:
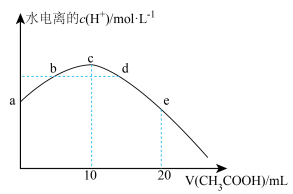
①a点水电离的
___________  。
。
②b点和d点对应的溶液中,pH=7的点是___________ (填“b”或“d”)。
Ⅱ. 的盐酸与
的盐酸与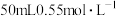 的NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热,回答相关问题。
的NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热,回答相关问题。
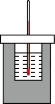
(5)从实验装置上看,图中尚缺少的一种玻璃仪器是___________ 。
(6)若实验过程中,图中内筒未加杯盖,求得的中和反应反应热数值___________ (填“偏大”、“偏小”或“无影响”)。
(7)为了计算中和反应反应热,某学生的实验记录数据如下:
依据上表数据,计算该实验中生成 时放出的热量为
时放出的热量为___________ kJ(结果保留一位小数)。(盐酸和氢氧化钠溶液的密度设为 ,中和反应后生成的溶液的比热容
,中和反应后生成的溶液的比热容 ,忽略量热计的比热容。)
,忽略量热计的比热容。)
Ⅰ.25℃时,在
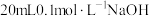 溶液中逐滴加入
溶液中逐滴加入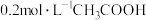 溶液,pH的变化曲线如图所示:
溶液,pH的变化曲线如图所示:
(1)A点溶液中离子浓度由大到小的顺序为
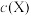 ”表示x的浓度,用“>”连接]。
”表示x的浓度,用“>”连接]。(2)A→B过程中(不含A点,含B点),下列离子浓度大小关系可能出现的是___________。
A.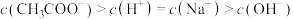 |
B. |
C.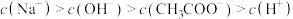 |
D.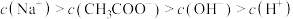 |
(3)图中所示的三种指示剂,误差最大的是
(4)滴定过程中水的电离情况如图所示:

①a点水电离的

 。
。②b点和d点对应的溶液中,pH=7的点是
Ⅱ.
 的盐酸与
的盐酸与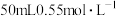 的NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热,回答相关问题。
的NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热,回答相关问题。
(5)从实验装置上看,图中尚缺少的一种玻璃仪器是
(6)若实验过程中,图中内筒未加杯盖,求得的中和反应反应热数值
(7)为了计算中和反应反应热,某学生的实验记录数据如下:
| 实验序号 | 反应物的温度/℃ | 反应前体系的温度 /℃ /℃ | 反应后体系的温度 /℃ /℃ | |
| 盐酸 | 氢氧化钠溶液 | |||
| 1 | 20.0 | 20.1 | 20.05 | 23.2 |
| 2 | 20.2 | 20.4 | 20.3 | 23.4 |
| 3 | 20.3 | 20.3 | 20.3 | 24.2 |
| 4 | 20.5 | 20.6 | 20.55 | 23.6 |
 时放出的热量为
时放出的热量为 ,中和反应后生成的溶液的比热容
,中和反应后生成的溶液的比热容 ,忽略量热计的比热容。)
,忽略量热计的比热容。)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为____________ (答出一条即可)。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),其中
),其中 元素的化合价为
元素的化合价为______ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素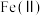 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ ;再加入石灰乳,所得滤渣中主要成分是 、
、______ 。
②通入混合气中 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是____________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是____________ 。 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成
 沉淀的离子方程式:
沉淀的离子方程式:______ 。
②若“镍钴分离”后溶液中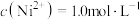 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中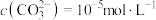 ,则沉镍率=
,则沉镍率=______ 。[已知: ,沉镍率=
,沉镍率=
 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。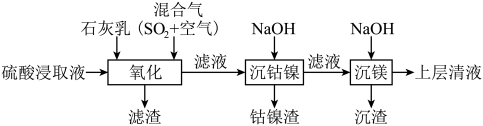
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),其中
),其中 元素的化合价为
元素的化合价为(3)已知:
 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素
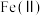 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是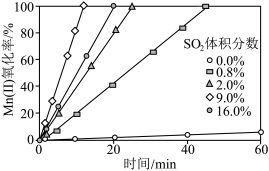
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中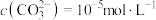 ,则沉镍率=
,则沉镍率= ,沉镍率=
,沉镍率=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】HDS催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧—水浸取法从HDS废催化剂(主要成分为MoS、NiS、V2O5、Al2O3)中提取贵重金属钒和钼,其工艺流程如图所示。

已知:I.MoO3、V2O5、Al2O3均可与纯碱反应生成对应的钠盐,而NiO不行。
Ⅱ.高温下,NH4VO3易分解产生N2和一种含氮元素的气体。
Ⅲ.Ksp(CuS)=6×10-36;K1(H2S)=1×10-7,K2(H2S)=6×10-15。
回答下列问题:
(1)“浸渣”的成分为___________ (填化学式);“滤液2”中的成分除了Na2MoO4外,还含有___________ (填化学式)。
(2)请写出“焙烧”过程中MoS及Al2O3分别与纯碱反应的化学方程式:___________ ,___________ 。
(3)“沉钒”时提钒率随初始钒的浓度及氯化铵的加入量的关系如图所示,则选择的初始钒的浓度和NH4Cl的加入量分别为___________ 、___________ 。
(4)“沉钒”时生成NH4VO3沉淀,请写出“煅烧”后生成氧化产物和还原产物的物质的量之比___________ 。

已知:I.MoO3、V2O5、Al2O3均可与纯碱反应生成对应的钠盐,而NiO不行。
Ⅱ.高温下,NH4VO3易分解产生N2和一种含氮元素的气体。
Ⅲ.Ksp(CuS)=6×10-36;K1(H2S)=1×10-7,K2(H2S)=6×10-15。
回答下列问题:
(1)“浸渣”的成分为
(2)请写出“焙烧”过程中MoS及Al2O3分别与纯碱反应的化学方程式:
(3)“沉钒”时提钒率随初始钒的浓度及氯化铵的加入量的关系如图所示,则选择的初始钒的浓度和NH4Cl的加入量分别为

(4)“沉钒”时生成NH4VO3沉淀,请写出“煅烧”后生成氧化产物和还原产物的物质的量之比
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】锌是一种重要的金属,锌及其化合物被广泛应用于汽车、建筑、船舶、电池等行业。现某科研小组以固体废锌催化剂(主要成分为ZnO及少量Fe2O3、CuO、MnO、SiO2 )为原料制备锌的工艺流程如图所示:

已知:①“浸取”时,ZnO、CuO转化为[Zn(NH3)4]2+、[Cu(NH3)4]2+进入溶液;
②25 ℃时,Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24;
③深度除杂标准:溶液中 ≤2.0×10-6。
≤2.0×10-6。
(1)“浸取”温度为30 ℃时,锌的浸出率可达90.6%,继续升温浸出率反而下降,其原因为_______ 。
(2)操作a的名称是_______ 。
(3)“深度除锰”是将残留的Mn2+转化为MnO2的过程,离子方程式为_______ 。
(4)“深度除铜”时,锌的最终回收率、除铜效果[除铜效果用反应后溶液中的铜锌比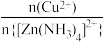 表示]与(NH4)2S 加入量[用
表示]与(NH4)2S 加入量[用 ×100% 表示]的关系曲线如图所示。
×100% 表示]的关系曲线如图所示。
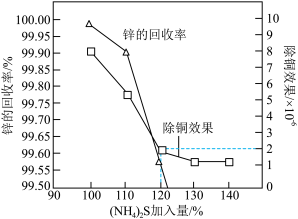
①当(NH4)2S的加入量≥100% 时,锌的最终回收率下降的原因是_______ (请结合离子方程式回答)。已知:[Zn(NH3)4]2+的K稳= =2.9×109。
=2.9×109。
②“深度除铜”时,(NH4)2S较为合理的加入量约为120%,理由是_______ 。

已知:①“浸取”时,ZnO、CuO转化为[Zn(NH3)4]2+、[Cu(NH3)4]2+进入溶液;
②25 ℃时,Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24;
③深度除杂标准:溶液中
 ≤2.0×10-6。
≤2.0×10-6。(1)“浸取”温度为30 ℃时,锌的浸出率可达90.6%,继续升温浸出率反而下降,其原因为
(2)操作a的名称是
(3)“深度除锰”是将残留的Mn2+转化为MnO2的过程,离子方程式为
(4)“深度除铜”时,锌的最终回收率、除铜效果[除铜效果用反应后溶液中的铜锌比
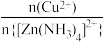 表示]与(NH4)2S 加入量[用
表示]与(NH4)2S 加入量[用 ×100% 表示]的关系曲线如图所示。
×100% 表示]的关系曲线如图所示。
①当(NH4)2S的加入量≥100% 时,锌的最终回收率下降的原因是
 =2.9×109。
=2.9×109。②“深度除铜”时,(NH4)2S较为合理的加入量约为120%,理由是
您最近一年使用:0次



