常温下,已知H2A的电离平衡常数为: K1=1.3×10-7 K2=7.1×10-15现有常温下的0.1mol/L NaHA溶液。
(1)请写出H2A的电离方程式______
(2)已知NaHA溶液pH>7,请解释原因_________
(3)请写出NaHA溶液中的电荷守恒式__________
(4)NaHA溶液中粒子之间的关系式中正确的是________
A.c(A2-)+c(HA-)=0.1mol/L B.c(H+)=c(OH-)+c(A2-)
C.c(HA-)>c(OH-)>c(A2-) D.c(A2-)>c(H2A)
(5)如果H2A为H2S,则向NaHS溶液中滴加硫酸铝溶液,发生反应的离子方程式________
(1)请写出H2A的电离方程式
(2)已知NaHA溶液pH>7,请解释原因
(3)请写出NaHA溶液中的电荷守恒式
(4)NaHA溶液中粒子之间的关系式中正确的是
A.c(A2-)+c(HA-)=0.1mol/L B.c(H+)=c(OH-)+c(A2-)
C.c(HA-)>c(OH-)>c(A2-) D.c(A2-)>c(H2A)
(5)如果H2A为H2S,则向NaHS溶液中滴加硫酸铝溶液,发生反应的离子方程式
更新时间:2018-01-08 21:10:41
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)醋酸的电离方程式为__________________ 。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是____。
(3)向0.1mol/LCH3COOH溶液中加水稀释, 的比值将
的比值将________ (填“变大”、“不变”或“变小”)。
(4)下列事实一定能说明CH3COOH是弱电解质的是_________(填字母)。
(5)现有a. CH3COOH b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
①将pH相同的两种酸溶液分别稀释100倍后,pH的大小关系为a_______ b。
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a_____ b。
(1)醋酸的电离方程式为
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是____。
| A.c(CH3COO-) | B.c(H+) | C.c(OH-) | D.CH3COOH电离平衡常数 |
 的比值将
的比值将(4)下列事实一定能说明CH3COOH是弱电解质的是_________(填字母)。
| A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸>醋酸 |
| B.1mol/LCH3COOH溶液能使紫色石蕊试液变红 |
| C.25℃时,1mol/LCH3COOH溶液的pH约为2 |
| D.10mL1mol/L的CH3COOH溶液恰好与10mL1mol/LNaOH溶液完全反应 |
①将pH相同的两种酸溶液分别稀释100倍后,pH的大小关系为a
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】Ⅰ.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
HClO

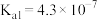
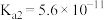

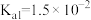
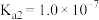
(1)相同浓度的 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为_______ 。
(2)写出 的电离方程式
的电离方程式_______ 。
(3)室温下, 通入NaOH溶液中,在所得溶液中,
通入NaOH溶液中,在所得溶液中,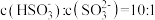 ,则溶液的pH=
,则溶液的pH=_______ 。
II.水在25℃和95℃时电离平衡曲线如图。
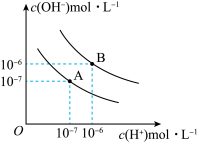
(4)在曲线A所对应的温度下,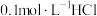 溶液由水电离出来的
溶液由水电离出来的
_______  。
。
(5)在曲线A所对应的温度下, 的下列溶液:①HCl②
的下列溶液:①HCl② ③
③ ④NaOH ⑤
④NaOH ⑤ ,pH由大到小的顺序是
,pH由大到小的顺序是_______ (填序号顺序)。
(6)在曲线A所对应的温度下, 的醋酸与
的醋酸与 的NaOH等体积混合,所得溶液的pH
的NaOH等体积混合,所得溶液的pH_______ 7(填“>”“<”或“=”)。
(7)在曲线B所对应的温度下,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的6,则NaOH溶液与
溶液混合,若所得混合溶液的6,则NaOH溶液与 溶液的体积比为
溶液的体积比为_______ 。
HClO


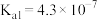
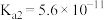

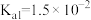
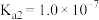
(1)相同浓度的
 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为(2)写出
 的电离方程式
的电离方程式(3)室温下,
 通入NaOH溶液中,在所得溶液中,
通入NaOH溶液中,在所得溶液中,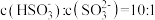 ,则溶液的pH=
,则溶液的pH=II.水在25℃和95℃时电离平衡曲线如图。

(4)在曲线A所对应的温度下,
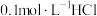 溶液由水电离出来的
溶液由水电离出来的
 。
。(5)在曲线A所对应的温度下,
 的下列溶液:①HCl②
的下列溶液:①HCl② ③
③ ④NaOH ⑤
④NaOH ⑤ ,pH由大到小的顺序是
,pH由大到小的顺序是(6)在曲线A所对应的温度下,
 的醋酸与
的醋酸与 的NaOH等体积混合,所得溶液的pH
的NaOH等体积混合,所得溶液的pH(7)在曲线B所对应的温度下,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的6,则NaOH溶液与
溶液混合,若所得混合溶液的6,则NaOH溶液与 溶液的体积比为
溶液的体积比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】下表是25 ℃时某些弱酸的电离平衡常数。
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_______________________________________ 。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________ 。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为_____________________ 。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______________ mol·L-1(填精确计算结果)。
(5) 将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为__________________________ 。
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=
(5) 将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
Ⅰ、电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
①25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为______ 。(填写序号)
②25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为_______ 。
③已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH____ 7。(选填“大于”、“小于”或“等于”)
Ⅱ、已知某溶液中存在OH﹣、H+、NH4+、Cl﹣四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣) ②c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
③c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+) ④c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是______ ,上述四种离子浓度的大小顺序为__ (选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为_______ ;若上述关系中④是正确的,则溶液中的溶质为_____ 。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)____ c(NH3•H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH﹣)的关系为c(H+)____ c(OH﹣)。
Ⅰ、电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
①25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为
②25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为
③已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH
Ⅱ、已知某溶液中存在OH﹣、H+、NH4+、Cl﹣四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣) ②c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
③c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+) ④c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是
(2)若上述关系中③是正确的,则溶液中的溶质为
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】现有下列化合物①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答问题:
(1)NH4Cl溶液显________ 性,用离子方程式表示________________________ 。
(2)常温下,pH=10的CH3COONa溶液中,水电离出来的c(OH-)为________ mol/l,在pH=3的CH3COOH溶液中水电离出来的c(H+)为________ mol/l。
(3)已知水中存在如下平衡:H2O+H2O H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的方法是
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的方法是________ 。
A.向水中加入NaHSO4固体 B.向水中加入Na2CO3固体 C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4) 常温下,将pH=12的NaOH和氨水分别加水稀释100倍后,稀释后NaOH的pH______ 10,氨水的pH______ 10(填“>”“<”或“=”)
(5)等物质的量浓度的④NH4Cl⑤CH3COONH4⑦NH3·H2O溶液中 浓度由大到小的顺序(填序号)
浓度由大到小的顺序(填序号)_____________ 。
(6)请分析0.1 mol·L-1 NaHCO3溶液显碱性原因的离子方程式__________ 。
(7)实验室中配制FeCl3溶液时常加入_______ 溶液以抑制其水解,若把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为____ 。
(1)NH4Cl溶液显
(2)常温下,pH=10的CH3COONa溶液中,水电离出来的c(OH-)为
(3)已知水中存在如下平衡:H2O+H2O
 H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的方法是
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的方法是A.向水中加入NaHSO4固体 B.向水中加入Na2CO3固体 C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4) 常温下,将pH=12的NaOH和氨水分别加水稀释100倍后,稀释后NaOH的pH
(5)等物质的量浓度的④NH4Cl⑤CH3COONH4⑦NH3·H2O溶液中
 浓度由大到小的顺序(填序号)
浓度由大到小的顺序(填序号)(6)请分析0.1 mol·L-1 NaHCO3溶液显碱性原因的离子方程式
(7)实验室中配制FeCl3溶液时常加入
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】现有常温下的0.1mol•L-1纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是___________ 。为证明存在上述平衡,进行如下实验:在0.1mol•L-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加 ___________ (填化学式)溶液,红色逐渐褪为无色,说明上述观点成立。
(2)同学甲查阅资料得知0.1mol•L-1 Na2CO3溶液中,发生水解的CO 不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)
不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)___________ 。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中错误的是___________ 。
A.c(Na+)>2c(CO )
)
B.c(CO )>c(OH-)>c(HCO
)>c(OH-)>c(HCO )>c(H2CO3)
)>c(H2CO3)
C.c(OH-)=c(H+)+c(HCO )+2c(H2CO3)
)+2c(H2CO3)
D.c(CO )+c(HCO
)+c(HCO )=0.1mol•L-1
)=0.1mol•L-1
E.c(H+)+c(Na+)=c(OH-)+c(HCO )+c(CO
)+c(CO )
)
(4)室温下pH均为a的Na2CO3和NaOH溶液中,水电离产生的c(OH-)之比=___________ 。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是
(2)同学甲查阅资料得知0.1mol•L-1 Na2CO3溶液中,发生水解的CO
 不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)
不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中错误的是
A.c(Na+)>2c(CO
 )
)B.c(CO
 )>c(OH-)>c(HCO
)>c(OH-)>c(HCO )>c(H2CO3)
)>c(H2CO3)C.c(OH-)=c(H+)+c(HCO
 )+2c(H2CO3)
)+2c(H2CO3)D.c(CO
 )+c(HCO
)+c(HCO )=0.1mol•L-1
)=0.1mol•L-1E.c(H+)+c(Na+)=c(OH-)+c(HCO
 )+c(CO
)+c(CO )
)(4)室温下pH均为a的Na2CO3和NaOH溶液中,水电离产生的c(OH-)之比=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答问题。
(1)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
①从甲组情况分析,如何判断HA是强酸还是弱酸?_______ 。
②乙组混合溶液中 和
和 的大小关系是
的大小关系是_______ (填字母)。
A.前者大 B.后者大 C.二者相等 D.无法判断
③从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是_______ 。
④分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
_______  。
。
(2)常温下,某水溶液 中存在的离子有
中存在的离子有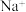 、
、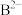 、
、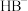 、
、 、
、 ,存在的分子只有
,存在的分子只有 。
。
①写出酸 的电离方程式:
的电离方程式:_______ (只写第一步)。
(2)若溶液 由
由 溶液与
溶液与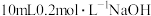 溶液混合而成,则溶液
溶液混合而成,则溶液 的
的
_______ (填“>”“<”或“=”)7,M溶液中,下列粒子浓度关系正确的是_______ (填字母)。
A.
B.
C.
D.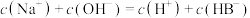
(1)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验编号 | HA的物质的量浓度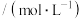 | NaOH的物质的量浓度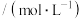 | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
②乙组混合溶液中
 和
和 的大小关系是
的大小关系是A.前者大 B.后者大 C.二者相等 D.无法判断
③从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
④分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):

 。
。(2)常温下,某水溶液
 中存在的离子有
中存在的离子有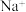 、
、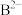 、
、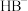 、
、 、
、 ,存在的分子只有
,存在的分子只有 。
。①写出酸
 的电离方程式:
的电离方程式:(2)若溶液
 由
由 溶液与
溶液与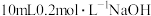 溶液混合而成,则溶液
溶液混合而成,则溶液 的
的
A.

B.

C.

D.
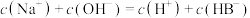
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】常温下,将某一元酸 HA 和 NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的 pH 如表:
请回答:
(1)用离子方程式表示①组混合溶液显碱性的原因是_____ 。
(2)②组中c_____ 0.2(填“>”、“<”或“=”,下同);③组中 a_____ 9。
(3)常温下,HA 的电离平衡常数的值为_____ 。
(4)从以上实验分析,将 pH=11 的 NaOH 溶液与 pH=3 的 HA 溶液等体积混合,所得混合溶液中所有离子浓度由大到小的顺序为_____ 。
| 实验编号 | HA物质的量浓度/(mol•L-1) | NaOH物质的量浓度/( mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.2 | pH=a |
(1)用离子方程式表示①组混合溶液显碱性的原因是
(2)②组中c
(3)常温下,HA 的电离平衡常数的值为
(4)从以上实验分析,将 pH=11 的 NaOH 溶液与 pH=3 的 HA 溶液等体积混合,所得混合溶液中所有离子浓度由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题。
(1)在相同温度下,同浓度的三种酸溶液的导电能力由大到小的顺序为___________ 。
(2)结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,三种溶液的pH由大到小的顺序为___________ 。(填溶液前序号)
②相同温度下浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)-c(CN-)___________ c(K+)-c(CH3COO-)。(填“>”“<”或“=”)
③室温下,若将0.1mol·L-1盐酸滴入20ml0.1mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质有两种,它们是___________ 。

(3)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式___________ 。
| 化学式 | HCN | CH3COOH | H2CO3 |
| 电离平衡常数(25℃) | Ka=4.93×10-10 | Ka=1.76×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
(2)结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,三种溶液的pH由大到小的顺序为
②相同温度下浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)-c(CN-)
③室温下,若将0.1mol·L-1盐酸滴入20ml0.1mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质有两种,它们是

(3)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式
您最近一年使用:0次



