Ⅰ.(1)在2L定容密闭容器中通入1molN2(g)和3molH2(g),发生反应:
3H2(g)+N2(g) 2NH3(g)△H<0,测得压强一时间图象如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图象。
2NH3(g)△H<0,测得压强一时间图象如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图象。
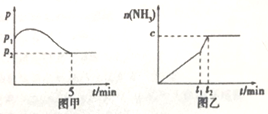
①若图中c=1.6mol,则改变的条件是__________ (填字母,下同);
A.升温 B.降温 C.加压 D.减压 E.加催化剂
②若图中c<1.6mol,则改变的条件是__________ (填字母);此时该反应的平衡常数__________ (填“增大”、“减小”、“不变”)。
(2)如图甲,平衡时氢气的转化率为____________ 。
Ⅱ.粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
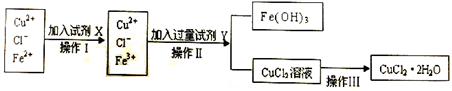
(1)操作Ⅰ时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是__________ 。
A.KMnO4 B.H2O2 C.Cl2 D.HNO3
(2)操作Ⅱ调整溶液的pH的Y试剂可选用下列中的__________ 。
A.NaOH(s) B.氨水 C.CuO(s) D.Cu(OH)2(s)
(3)已知溶度积常数如下表:
将溶液的pH调至pH=4时,使Fe3+完全转化为Fe(OH)3沉淀而除去,此时c(Fe3+)=__________ 。
(4)若将CuCl2溶液蒸干后,再灼烧,得到的固体是__________ (填化学式);操作Ⅲ后由CuCl2·2H2O晶体得到纯净无水CuCl2的合理操作是_____________________________________ 。
3H2(g)+N2(g)
 2NH3(g)△H<0,测得压强一时间图象如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图象。
2NH3(g)△H<0,测得压强一时间图象如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图象。
①若图中c=1.6mol,则改变的条件是
A.升温 B.降温 C.加压 D.减压 E.加催化剂
②若图中c<1.6mol,则改变的条件是
(2)如图甲,平衡时氢气的转化率为
Ⅱ.粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

(1)操作Ⅰ时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是
A.KMnO4 B.H2O2 C.Cl2 D.HNO3
(2)操作Ⅱ调整溶液的pH的Y试剂可选用下列中的
A.NaOH(s) B.氨水 C.CuO(s) D.Cu(OH)2(s)
(3)已知溶度积常数如下表:
| 物质 | Cu(OH) | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
将溶液的pH调至pH=4时,使Fe3+完全转化为Fe(OH)3沉淀而除去,此时c(Fe3+)=
(4)若将CuCl2溶液蒸干后,再灼烧,得到的固体是
更新时间:2018-01-16 11:59:11
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】元素锑被广泛用于制造半导体和二极管,在电子工业中有重要地位。回答下列问题:
(1)我国当前主流的炼锑工艺为鼓风炉挥发-反射炉熔炼法,其原理为利用硫化锑矿(Sb2S3)在高温挥发氧化转化成Sb2O3,再经还原熔炼,制得粗锑。
以下为有关反应的热化学方程式:
反应1: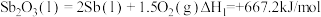
反应2:
反应3:
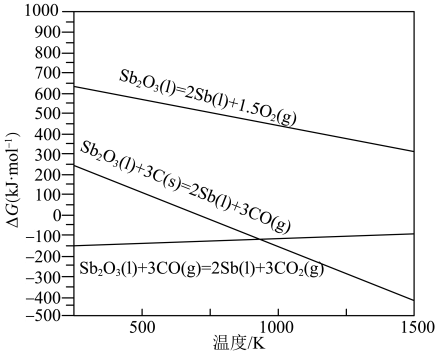
①碳燃烧热的热化学方程式为___________ 。
②反应1、2和3的∆G随温度的变化关系如下图所示。工业还原熔炼粗锑的温度一般为1423K~1473K,结合图像从热力学角度分析,宜选用___________ (填“C”或者“CO”)作还原剂,理由是___________ 。
(2)某企业对粗铜精炼阳极泥中锑元素进行回收。
①向脱铜阳极泥中加入硫酸和氯化钠进行浸出,使Sb2O3转化为较稳定的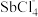 ,反应的离子方程式为
,反应的离子方程式为___________ 。
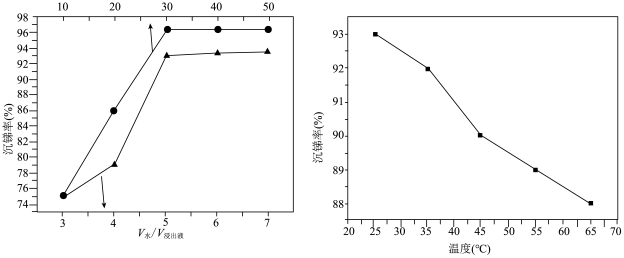
②经硫酸和氯化钠浸出后的Sb(Ⅲ)在一定条件下可发生水解反应进而沉淀出锑,为了寻求最佳沉锑条件,分别对水解时间、浸出液稀释倍数、温度等因素进行探究,结果如图所示。水解沉锑的最佳条件为___________ 。
(3)水溶液中的Sb(III)易被氧化成Sb(V),Sb(V)主要以:Sb(OH)5、 的形式存在。在298K条件下,方解石(主要成分CaCO3在天然水体中会逐渐溶解并释放Ca2+,与水体中的
的形式存在。在298K条件下,方解石(主要成分CaCO3在天然水体中会逐渐溶解并释放Ca2+,与水体中的 形成(Ca[Sb(OH)6]2难溶物,进一步聚集生长而固定在方解石表面。体系中pH与lg c关系如下图所示,c为Sb(OH)5、
形成(Ca[Sb(OH)6]2难溶物,进一步聚集生长而固定在方解石表面。体系中pH与lg c关系如下图所示,c为Sb(OH)5、 、Ca2+、CO
、Ca2+、CO 的浓度,单位为mol/L。已知天然水体表面CO2的分压保持恒定。
的浓度,单位为mol/L。已知天然水体表面CO2的分压保持恒定。
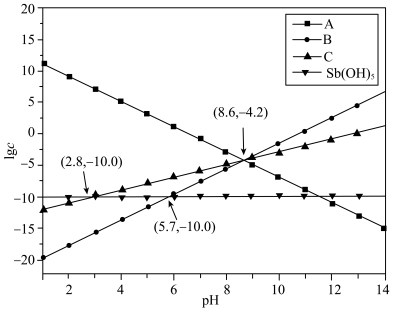
①图中A线代表的粒子为___________ 。
②Sb(OH)5的电离方程式可以写成 其电离平衡常数为
其电离平衡常数为___________ 。
(1)我国当前主流的炼锑工艺为鼓风炉挥发-反射炉熔炼法,其原理为利用硫化锑矿(Sb2S3)在高温挥发氧化转化成Sb2O3,再经还原熔炼,制得粗锑。
以下为有关反应的热化学方程式:
反应1:
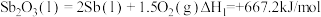
反应2:

反应3:

①碳燃烧热的热化学方程式为
②反应1、2和3的∆G随温度的变化关系如下图所示。工业还原熔炼粗锑的温度一般为1423K~1473K,结合图像从热力学角度分析,宜选用

(2)某企业对粗铜精炼阳极泥中锑元素进行回收。
①向脱铜阳极泥中加入硫酸和氯化钠进行浸出,使Sb2O3转化为较稳定的
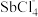 ,反应的离子方程式为
,反应的离子方程式为②经硫酸和氯化钠浸出后的Sb(Ⅲ)在一定条件下可发生水解反应进而沉淀出锑,为了寻求最佳沉锑条件,分别对水解时间、浸出液稀释倍数、温度等因素进行探究,结果如图所示。水解沉锑的最佳条件为

(3)水溶液中的Sb(III)易被氧化成Sb(V),Sb(V)主要以:Sb(OH)5、
 的形式存在。在298K条件下,方解石(主要成分CaCO3在天然水体中会逐渐溶解并释放Ca2+,与水体中的
的形式存在。在298K条件下,方解石(主要成分CaCO3在天然水体中会逐渐溶解并释放Ca2+,与水体中的 形成(Ca[Sb(OH)6]2难溶物,进一步聚集生长而固定在方解石表面。体系中pH与lg c关系如下图所示,c为Sb(OH)5、
形成(Ca[Sb(OH)6]2难溶物,进一步聚集生长而固定在方解石表面。体系中pH与lg c关系如下图所示,c为Sb(OH)5、 、Ca2+、CO
、Ca2+、CO 的浓度,单位为mol/L。已知天然水体表面CO2的分压保持恒定。
的浓度,单位为mol/L。已知天然水体表面CO2的分压保持恒定。
①图中A线代表的粒子为
②Sb(OH)5的电离方程式可以写成
 其电离平衡常数为
其电离平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】以分子中含有一个碳原子的物质为原料的化学工业称为“碳一化工”,甲醇是碳一化工的支柱。回答下列问题:
(1)以甲醇生产甲胺的化学方程式为 CH3OH(l)+NH3(g)═CH3NH2(g)+H2O(g), 该反应在高温下才能自发进行,则该反应的ΔH_______ 0(填“>”“<”或“=”)。
(2)利用甲醇(CH₃OH)制备甲醛可以使人类的基础化学品摆脱对石油的依赖。目前常用的方法有以下两种。
脱氢法: CH3OH(g) HCHO(g)+H2(g) ΔH= +46.203kJ·mol-1
HCHO(g)+H2(g) ΔH= +46.203kJ·mol-1
氧化法:CH3OH(g)+ O2(g)
O2(g)  HCHO(g)+ H2O(g) ΔH= -149.73kJ·mol-1
HCHO(g)+ H2O(g) ΔH= -149.73kJ·mol-1
已知几种共价键的键能如下表:
如图为甲醇制备甲醛两种方法对应的lg K(K为浓度平衡常数)随温度(T)的变化曲线。
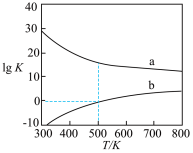
①表中n=_______ 。
②曲线_______ (填“a”或“b”)对应氧化法,其理由是_______ 。
③在一个体积为1L的恒容密闭容器中加入2 mol CH3OH,在500K时发生脱氢反应,经5min达到平衡状态,则体系压强变为原来的_______ 倍。若平衡时体系压强为3.6MPa,则平衡时压强平衡常数 Kp=_______ MPa。
(3)以CO、CH3OH 为原料生产醋酸是碳一化工的成功范例,产品中乙酸含量≥99.8%。
①根据下表数据分析,实际工业生产中采用低压羰基合成反应制备醋酸的原因是_______ 。
甲醇合成醋酸消耗定额的比较(以生产1t醋酸计)
②该羰基合成反应采用不同组分的铑系催化剂,它们的催化性能比较如下表。其中性能最优的催化剂是_______ 。
(4)一种甲醇燃料电池采用碳化钨作为电极催化剂,在稀硫酸电解液中加入纯化的甲醇,同时向另一个电极通入空气,负极的电极反应式为 _______ 。
(1)以甲醇生产甲胺的化学方程式为 CH3OH(l)+NH3(g)═CH3NH2(g)+H2O(g), 该反应在高温下才能自发进行,则该反应的ΔH
(2)利用甲醇(CH₃OH)制备甲醛可以使人类的基础化学品摆脱对石油的依赖。目前常用的方法有以下两种。
脱氢法: CH3OH(g)
 HCHO(g)+H2(g) ΔH= +46.203kJ·mol-1
HCHO(g)+H2(g) ΔH= +46.203kJ·mol-1氧化法:CH3OH(g)+
 O2(g)
O2(g)  HCHO(g)+ H2O(g) ΔH= -149.73kJ·mol-1
HCHO(g)+ H2O(g) ΔH= -149.73kJ·mol-1已知几种共价键的键能如下表:
| 共价键 | C-O | C-H | O-H | C═O | H—H |
| 键能/(kJ·mol-1) | 413.4 | n | 462.8. | 745 | 436 |

①表中n=
②曲线
③在一个体积为1L的恒容密闭容器中加入2 mol CH3OH,在500K时发生脱氢反应,经5min达到平衡状态,则体系压强变为原来的
(3)以CO、CH3OH 为原料生产醋酸是碳一化工的成功范例,产品中乙酸含量≥99.8%。
①根据下表数据分析,实际工业生产中采用低压羰基合成反应制备醋酸的原因是
甲醇合成醋酸消耗定额的比较(以生产1t醋酸计)
| 名称 | 高压羰基合成 | 低压羰基合成 |
| 甲醇/kg | 610 | 545 |
| 一氧化碳/m3(标准状况) | 630 | 454 |
| 电/kWh | 350 | 29 |
| 催化剂 | 铑的百分含量/% | 相对催化速率 |
| RhCl3-NaX | 0.25 | 50 |
| RhCl(CO)(PPh3)-Al2O3 | 1.39 | 40 |
| Rh(NO3)3/C | 3.00 | 25 |
| Rh/Ys | 1.00 | 900 |
您最近一年使用:0次
【推荐3】2021年7月,生态环境部召开例行新闻发布会表示:习近平总书记要求将碳达峰、碳中和落实情况纳入中央生态环境保护督察,生态环境部将坚决贯彻落实。用CO还原 ,实现无害化处理是环境治理的一个重要的方法:
,实现无害化处理是环境治理的一个重要的方法: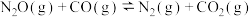
 。
。
(1)已知:①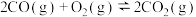

②


_______ (用含 、
、 的代数式表示)。
的代数式表示)。
(2) 和CO在
和CO在 作用下发生的反应分两步进行:
作用下发生的反应分两步进行:
反应Ⅰ:
反应Ⅱ:
反应过程的能量变化如图所示:
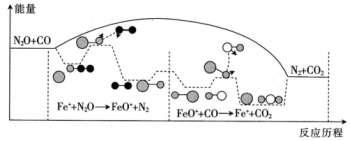
①
_______ (填“>”、“<”或“=”)0。
②决定总反应速率的是_______ (填“反应Ⅰ”或“反应Ⅱ”)
③下列有关说法正确的是_______ (填标号)。
A. 改变反应历程,降低活化能和焓变 B.升高温度,
改变反应历程,降低活化能和焓变 B.升高温度, 的平衡转化率减小
的平衡转化率减小
C. 是中间产物,可增大平衡常数 D.上述反应过程中断裂离子键和极性键
是中间产物,可增大平衡常数 D.上述反应过程中断裂离子键和极性键
(3) 的速率方程为
的速率方程为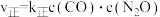 ,
,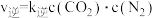 (
( 、
、 为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。回答下列问题:
为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。回答下列问题:
①净反应速率(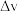 )等于正、逆反应速率之差。平衡时,
)等于正、逆反应速率之差。平衡时,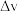 (500 K)
(500 K)_______ (填“>”、“<”或“=”) 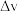 (550 K)
(550 K)
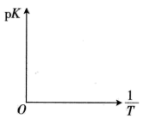
②该反应的平衡常数为K,在图中画出 (
( )随温度的倒数(
)随温度的倒数( )的变化曲线
)的变化曲线_______ 。
(4)已知500℃时,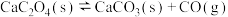 的平衡常数
的平衡常数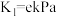 ,向一恒容密闭容器加入足量的
,向一恒容密闭容器加入足量的 固体,再充入一定量
固体,再充入一定量 气体,起始压强为bkPa,达到平衡时总压强为ckPa。500℃时,反应
气体,起始压强为bkPa,达到平衡时总压强为ckPa。500℃时,反应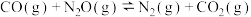 的平衡常数
的平衡常数
_______ 。
 ,实现无害化处理是环境治理的一个重要的方法:
,实现无害化处理是环境治理的一个重要的方法: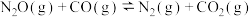
 。
。(1)已知:①
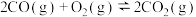

②
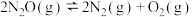


 、
、 的代数式表示)。
的代数式表示)。(2)
 和CO在
和CO在 作用下发生的反应分两步进行:
作用下发生的反应分两步进行:反应Ⅰ:

反应Ⅱ:

反应过程的能量变化如图所示:

①

②决定总反应速率的是
③下列有关说法正确的是
A.
 改变反应历程,降低活化能和焓变 B.升高温度,
改变反应历程,降低活化能和焓变 B.升高温度, 的平衡转化率减小
的平衡转化率减小C.
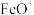 是中间产物,可增大平衡常数 D.上述反应过程中断裂离子键和极性键
是中间产物,可增大平衡常数 D.上述反应过程中断裂离子键和极性键(3)
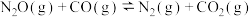 的速率方程为
的速率方程为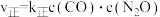 ,
,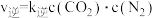 (
( 、
、 为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。回答下列问题:
为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。回答下列问题:①净反应速率(
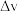 )等于正、逆反应速率之差。平衡时,
)等于正、逆反应速率之差。平衡时,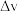 (500 K)
(500 K)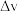 (550 K)
(550 K)②该反应的平衡常数为K,在图中画出
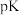 (
( )随温度的倒数(
)随温度的倒数( )的变化曲线
)的变化曲线
(4)已知500℃时,
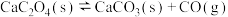 的平衡常数
的平衡常数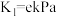 ,向一恒容密闭容器加入足量的
,向一恒容密闭容器加入足量的 固体,再充入一定量
固体,再充入一定量 气体,起始压强为bkPa,达到平衡时总压强为ckPa。500℃时,反应
气体,起始压强为bkPa,达到平衡时总压强为ckPa。500℃时,反应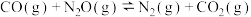 的平衡常数
的平衡常数
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】将 和
和 重整转化为合成气一直是减少温室气体排放的研究方向之一,涉及如下反应:
重整转化为合成气一直是减少温室气体排放的研究方向之一,涉及如下反应:
主反应:

副反应: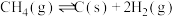
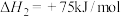
回答下列问题:
(1)已知: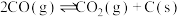
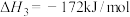 ,则
,则
_______  。
。
(2)恒温恒容密闭容器中仅发生主反应,能说明反应达到平衡状态的是_______(填标号)。
(3)在体积为 恒容密闭容器中充入
恒容密闭容器中充入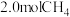 和
和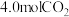 ,
, 下仅发生主反应,
下仅发生主反应, 、
、 的物质的量随时间变化如下表所示:
的物质的量随时间变化如下表所示:
① 在
在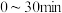 内的平均反应速率
内的平均反应速率
_______ 。
②若在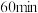 时再充入
时再充入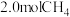 ,达到新平衡后
,达到新平衡后 的转化率
的转化率_______ (填“增大”、“减小”或“不变”,下同),此时平衡常数
_______ 。
③若相同条件下改为充入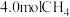 和
和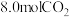 反应,平衡后
反应,平衡后 的转化率
的转化率_______  (填“<”、“=”或“>”)。
(填“<”、“=”或“>”)。
(4) 催化加
催化加 可以制备
可以制备 ,保持反应气中
,保持反应气中 与
与 的体积比为
的体积比为 ,以
,以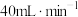 的流速通过催化剂,甲烷化过程中,含碳产物
的流速通过催化剂,甲烷化过程中,含碳产物 的物质的量百分数
的物质的量百分数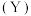 及
及 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。 时
时 反应速率为
反应速率为_______  。
。

 和
和 重整转化为合成气一直是减少温室气体排放的研究方向之一,涉及如下反应:
重整转化为合成气一直是减少温室气体排放的研究方向之一,涉及如下反应:主反应:


副反应:
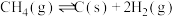
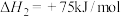
回答下列问题:
(1)已知:
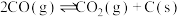
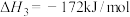 ,则
,则
 。
。(2)恒温恒容密闭容器中仅发生主反应,能说明反应达到平衡状态的是_______(填标号)。
| A.容器内的压强不变 |
B. |
| C.混合气体的密度不再变化 |
D.断开 键同时断开 键同时断开 键 键 |
(3)在体积为
 恒容密闭容器中充入
恒容密闭容器中充入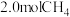 和
和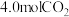 ,
, 下仅发生主反应,
下仅发生主反应, 、
、 的物质的量随时间变化如下表所示:
的物质的量随时间变化如下表所示:时间/min 反应物 | 0 | 15 | 30 | 45 | 60 | 75 |
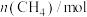 | 2.0 | 1.3 | 0.8 | 0.4 | 0.2 | 0.2 |
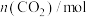 | 4.0 | 3.3 | 2.8 | 2.4 | 2.2 | 2.2 |
 在
在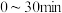 内的平均反应速率
内的平均反应速率
②若在
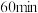 时再充入
时再充入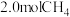 ,达到新平衡后
,达到新平衡后 的转化率
的转化率
③若相同条件下改为充入
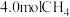 和
和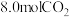 反应,平衡后
反应,平衡后 的转化率
的转化率 (填“<”、“=”或“>”)。
(填“<”、“=”或“>”)。(4)
 催化加
催化加 可以制备
可以制备 ,保持反应气中
,保持反应气中 与
与 的体积比为
的体积比为 ,以
,以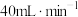 的流速通过催化剂,甲烷化过程中,含碳产物
的流速通过催化剂,甲烷化过程中,含碳产物 的物质的量百分数
的物质的量百分数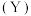 及
及 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。 时
时 反应速率为
反应速率为 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中的NO2,已知NO2(g)+SO2(g) SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________________ 。
(2)目前降低尾气中NO和CO的可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g)ΔH=-akJ·mol-1(a>0)。在25℃和101kPa下,将2.0molNO、2.4molCO气体通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g)ΔH=-akJ·mol-1(a>0)。在25℃和101kPa下,将2.0molNO、2.4molCO气体通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
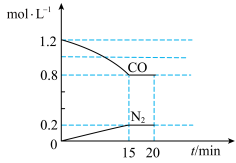
①有害气体NO的转化率为________________ 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________________ (填字母)。
a.缩小容器体积b.增加CO的量c.降低温度d.扩大容器体积
(3)消除汽车尾气中的NO2也可以用CO,已知:2NO(g)+O2(g)=2NO2(g)ΔH=-bkJ·mol-1;CO的燃烧热ΔH=-ckJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学反应方程式:________________ 。
(1)用SO2气体可以消除汽车尾气中的NO2,已知NO2(g)+SO2(g)
 SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=(2)目前降低尾气中NO和CO的可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g)ΔH=-akJ·mol-1(a>0)。在25℃和101kPa下,将2.0molNO、2.4molCO气体通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g)ΔH=-akJ·mol-1(a>0)。在25℃和101kPa下,将2.0molNO、2.4molCO气体通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
①有害气体NO的转化率为
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是
a.缩小容器体积b.增加CO的量c.降低温度d.扩大容器体积
(3)消除汽车尾气中的NO2也可以用CO,已知:2NO(g)+O2(g)=2NO2(g)ΔH=-bkJ·mol-1;CO的燃烧热ΔH=-ckJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学反应方程式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】石油化工、煤化工等行业的废气中普遍含有硫化氢, 的回收利用有重要意义。以下是
的回收利用有重要意义。以下是 处理的一些方法。
处理的一些方法。
完成下列填空:
Ⅰ.用氢氧化钠溶液吸收。
(1)硫化氢被完全吸收后,溶液里含硫的微粒可能为_______ ,25℃时若溶液 ,则溶液中
,则溶液中
_______  (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。
Ⅱ.制取 ,其反应的能量示意如下图所示。
,其反应的能量示意如下图所示。

(2)写出该总反应的热化学方程式。_______
Ⅲ.高温分解: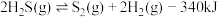
(3)能够判断上述反应到达平衡状态的是_______ 。(选填编号)
a. 的浓度保持不变b.气体的质量保持不变
的浓度保持不变b.气体的质量保持不变
c.恒容时,容器的压强保持不变d.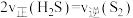
(4)在恒温恒压条件下,充入氩气,发现: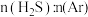 越小,
越小, 平衡转化率越大,请解释可能的原因。
平衡转化率越大,请解释可能的原因。_______
Ⅳ.将 燃烧,产生的
燃烧,产生的 与剩余
与剩余 混合后反应,生成单质硫回收。
混合后反应,生成单质硫回收。
①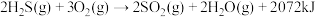
②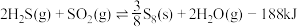
(5)②的平衡常数表达式为_______ ,某温度下,若只发生反应②,从反应开始到15s时,测得容器内的气体密度减小了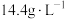 ,则
,则 内,
内, 平均反应速率
平均反应速率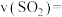
_______ 。
(6)在某温度下发生反应①和②,当②达到平衡,测得密闭系统中各组分浓度分别为: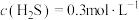 、
、 、
、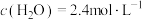 ,请计算开始时投料比
,请计算开始时投料比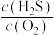
_______ 。
 的回收利用有重要意义。以下是
的回收利用有重要意义。以下是 处理的一些方法。
处理的一些方法。完成下列填空:
Ⅰ.用氢氧化钠溶液吸收。
(1)硫化氢被完全吸收后,溶液里含硫的微粒可能为
 ,则溶液中
,则溶液中
 (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。Ⅱ.制取
 ,其反应的能量示意如下图所示。
,其反应的能量示意如下图所示。
(2)写出该总反应的热化学方程式。
Ⅲ.高温分解:
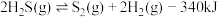
(3)能够判断上述反应到达平衡状态的是
a.
 的浓度保持不变b.气体的质量保持不变
的浓度保持不变b.气体的质量保持不变c.恒容时,容器的压强保持不变d.
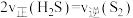
(4)在恒温恒压条件下,充入氩气,发现:
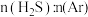 越小,
越小, 平衡转化率越大,请解释可能的原因。
平衡转化率越大,请解释可能的原因。Ⅳ.将
 燃烧,产生的
燃烧,产生的 与剩余
与剩余 混合后反应,生成单质硫回收。
混合后反应,生成单质硫回收。①
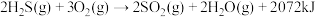
②
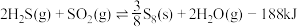
(5)②的平衡常数表达式为
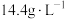 ,则
,则 内,
内, 平均反应速率
平均反应速率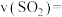
(6)在某温度下发生反应①和②,当②达到平衡,测得密闭系统中各组分浓度分别为:
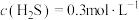 、
、 、
、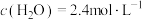 ,请计算开始时投料比
,请计算开始时投料比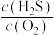
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】橡胶工业的硫化剂二氯化二硫( ,沸点:
,沸点: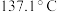 )是一种橙黄色液体,溶于
)是一种橙黄色液体,溶于 、
、 等,易水解,超过
等,易水解,超过 开始分解。可由
开始分解。可由 (沸点:
(沸点: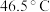 )与
)与 在
在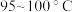 反应制备,同时有
反应制备,同时有 (沸点:
(沸点: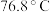 )生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略):
)生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略): ;
; 在
在 以上分解生成
以上分解生成 和
和 。
。
回答下列问题:
(1)利用上述装置制备 ,按气流从左到右的方向连接各仪器接口,正确的顺序是a→
,按气流从左到右的方向连接各仪器接口,正确的顺序是a→____________ (填小写字母,仪器不重复使用)。
(2)装置 中生成
中生成 的化学方程式为
的化学方程式为________________________ 。
(3)仪器X的名称是____________________ ,试剂Y的名称是_______________ 。
(4)实验过程中仪器X中回流的主要物质是____________ (填化学式)。
(5)已知减压条件下可降低液体沸点。实验完成后,对E中混合液选择减压蒸馏,其原因是_________________ 。
(6)本实验对于装置E,需考虑的因素是____________ (任写一种即可)。
(7) 遇水水解时,产生能使品红溶液褪色的气体,写出
遇水水解时,产生能使品红溶液褪色的气体,写出 遇水反应的化学方程式:
遇水反应的化学方程式:_______________ 。
 ,沸点:
,沸点: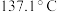 )是一种橙黄色液体,溶于
)是一种橙黄色液体,溶于 、
、 等,易水解,超过
等,易水解,超过 开始分解。可由
开始分解。可由 (沸点:
(沸点: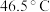 )与
)与 在
在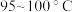 反应制备,同时有
反应制备,同时有 (沸点:
(沸点: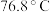 )生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略):
)生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略):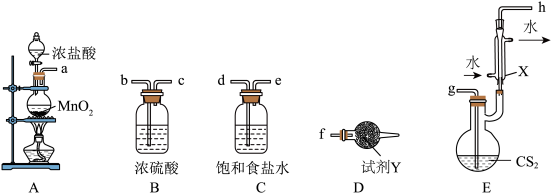
 ;
; 在
在 以上分解生成
以上分解生成 和
和 。
。回答下列问题:
(1)利用上述装置制备
 ,按气流从左到右的方向连接各仪器接口,正确的顺序是a→
,按气流从左到右的方向连接各仪器接口,正确的顺序是a→(2)装置
 中生成
中生成 的化学方程式为
的化学方程式为(3)仪器X的名称是
(4)实验过程中仪器X中回流的主要物质是
(5)已知减压条件下可降低液体沸点。实验完成后,对E中混合液选择减压蒸馏,其原因是
(6)本实验对于装置E,需考虑的因素是
(7)
 遇水水解时,产生能使品红溶液褪色的气体,写出
遇水水解时,产生能使品红溶液褪色的气体,写出 遇水反应的化学方程式:
遇水反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪(Sc)是一种稀土金属,利用钛尾矿回收金属钪和草酸的工艺流程如图1所示。回答下列问题:

已知:①xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
③25℃时,部分物质的相关信息如表所示:
(1)“焙烧”过程生成Sc2O3的化学方程式为___________ 。
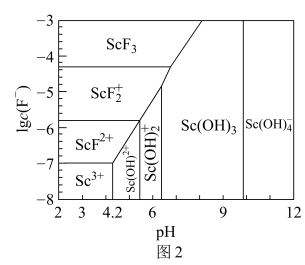
(2)含钪元素的微粒与lgc(F-)、pH的关系如下图所示,用氨水调节溶液的pH值,控制pH的范围是3.5<pH<___________ 。
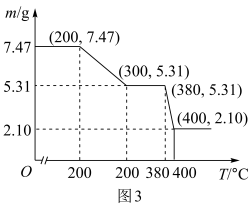
(3)“脱水除铵”过程中固体质量与温度的关系如下图所示,其中在380-400℃过程中会有白烟冒出,保温至无烟气产生,即得到 ScF3,由图3中数据可得x:z=___________ 。
(4)传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质,原因是___________ 。(用化学方程式表示)。流程中“沉钪”后“脱水除铵”可制得纯度很高的ScF3,其原因是___________ 。
(5)将1.8mol PbSO4加到1L含有0.12mol/L H2C2O4的废水中。发生的离子反应为PbSO4(s)+H2C2O4(aq) PbC2O4(s)+2H+(aq)+ SO
PbC2O4(s)+2H+(aq)+ SO (aq),该反应的平衡常数K=
(aq),该反应的平衡常数K=___________ 。滤饼经浓硫酸处理后的“沉淀”是___________ (化学式)。

已知:①xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
③25℃时,部分物质的相关信息如表所示:
| Ksp(PbSO4) | Ksp(PbC2O4) | Ka1(H2C2O4) | Ka2(H2C2O4) |
| 2.0×10-8 | 5.0×10-10 | 6.0×10-2 | 6.25×10-5 |
(2)含钪元素的微粒与lgc(F-)、pH的关系如下图所示,用氨水调节溶液的pH值,控制pH的范围是3.5<pH<

(3)“脱水除铵”过程中固体质量与温度的关系如下图所示,其中在380-400℃过程中会有白烟冒出,保温至无烟气产生,即得到 ScF3,由图3中数据可得x:z=

(4)传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质,原因是
(5)将1.8mol PbSO4加到1L含有0.12mol/L H2C2O4的废水中。发生的离子反应为PbSO4(s)+H2C2O4(aq)
 PbC2O4(s)+2H+(aq)+ SO
PbC2O4(s)+2H+(aq)+ SO (aq),该反应的平衡常数K=
(aq),该反应的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】Ⅰ.稀土金属包括17种金属,已广泛应用于电子、石油化工、冶金等各个行业。德国《每日镜报》援引一名德国经济界驻京代表的话说,中国人玩稀土就像当年欧佩克玩石油一样:稀土这种资源被描述成中国要挟他国的“独门武器”,是因为中国控制世界稀土市场约98%的份额。稀土金属的制备常用电解法,步骤如下:
第一步:稀土氯化物晶体(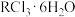 )的制备(R表示稀土金属,常见稳定价态为+3价)。
)的制备(R表示稀土金属,常见稳定价态为+3价)。
由于R—O键比R—Cl(或R—F)键牢固,所以稀土金属在自然界大多以R—O键的形式存在,人们常常以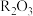 表示矿物中稀土金属的含量。将矿物用浓盐酸处理再经分离提纯得到
表示矿物中稀土金属的含量。将矿物用浓盐酸处理再经分离提纯得到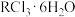 。
。
第二步:无水稀土氯化物的制备。
将稀土氧化物晶体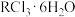 脱水制取
脱水制取 ,脱水温度为200~300℃。
,脱水温度为200~300℃。
第三步:电解。
第四步:再通过较为复杂的方法分离各种稀土金属。
请回答下列问题:
(1)生产时选择电解熔融稀土金属氯化物,而不用熔融稀土金属氧化物的原因是___________ 。
(2)若要测定某矿物中稀土金属含量,方法之一是将矿物处理为氧化物,然后转化为草酸盐,再用热重分析法测定(产物为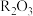 )。若在实验室来进行,应将提纯后的草酸盐放在
)。若在实验室来进行,应将提纯后的草酸盐放在___________ 中加热,灼烧至恒重。某实验小组进行实验,实验数据如下表所示:
则该样品中稀土金属含量为___________ (不考虑处理过程中的损失,含量以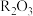 计,用百分数表示)。
计,用百分数表示)。
Ⅱ.脱水时会有部分稀土氯氧化物ROCl(红色)生成,这种难熔的物质会使电解时的熔体粘度增大,导电性降低,并使析出的金属液滴不易从盐相中聚集和离析出来。这些悬浮的ROCl在电解时大部分会沉积于电解槽的底部,将阴极金属覆盖住,使电解难以继续进行,红色的ROCl被称为“红泥”。“红泥”不被电解。
(3)为防止ROCl的生成,脱水可在 存在的条件下进行,理由是
存在的条件下进行,理由是___________ ,同时,在 存在时,若有ROCl产生,也能转化为
存在时,若有ROCl产生,也能转化为 。试用化学反应方程式予以解释
。试用化学反应方程式予以解释__________ 。
(4)电解时电解槽电极之一为石墨,实验表明,即使是使用含水的稀土氯化物,槽内也并无红泥的蓄积,但发现作为电极的石墨发生严重的腐蚀现象。其中石墨作___________ 极,试写出该电极上的电极反应式___________ (电解温度:850~900℃,“红泥”被消除时有气体产生,且有 生成)。
生成)。
第一步:稀土氯化物晶体(
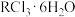 )的制备(R表示稀土金属,常见稳定价态为+3价)。
)的制备(R表示稀土金属,常见稳定价态为+3价)。由于R—O键比R—Cl(或R—F)键牢固,所以稀土金属在自然界大多以R—O键的形式存在,人们常常以
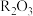 表示矿物中稀土金属的含量。将矿物用浓盐酸处理再经分离提纯得到
表示矿物中稀土金属的含量。将矿物用浓盐酸处理再经分离提纯得到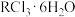 。
。第二步:无水稀土氯化物的制备。
将稀土氧化物晶体
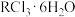 脱水制取
脱水制取 ,脱水温度为200~300℃。
,脱水温度为200~300℃。第三步:电解。
第四步:再通过较为复杂的方法分离各种稀土金属。
请回答下列问题:
(1)生产时选择电解熔融稀土金属氯化物,而不用熔融稀土金属氧化物的原因是
(2)若要测定某矿物中稀土金属含量,方法之一是将矿物处理为氧化物,然后转化为草酸盐,再用热重分析法测定(产物为
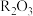 )。若在实验室来进行,应将提纯后的草酸盐放在
)。若在实验室来进行,应将提纯后的草酸盐放在| 矿物样品质量(g) | 剩余固体质量(g) | |
| 第一次实验 | 1.48 | 0.89 |
| 第二次实验 | 1.51 | 0.90 |
| 第三次实验 | 1.51 | 0.91 |
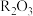 计,用百分数表示)。
计,用百分数表示)。Ⅱ.脱水时会有部分稀土氯氧化物ROCl(红色)生成,这种难熔的物质会使电解时的熔体粘度增大,导电性降低,并使析出的金属液滴不易从盐相中聚集和离析出来。这些悬浮的ROCl在电解时大部分会沉积于电解槽的底部,将阴极金属覆盖住,使电解难以继续进行,红色的ROCl被称为“红泥”。“红泥”不被电解。
(3)为防止ROCl的生成,脱水可在
 存在的条件下进行,理由是
存在的条件下进行,理由是 存在时,若有ROCl产生,也能转化为
存在时,若有ROCl产生,也能转化为 。试用化学反应方程式予以解释
。试用化学反应方程式予以解释(4)电解时电解槽电极之一为石墨,实验表明,即使是使用含水的稀土氯化物,槽内也并无红泥的蓄积,但发现作为电极的石墨发生严重的腐蚀现象。其中石墨作
 生成)。
生成)。
您最近一年使用:0次
【推荐1】氮、硫、氯及其化合物是中学化学重要的组成部分。
(1)氨气燃料电池使用的电解质溶液是 溶液,电池反应为:
溶液,电池反应为: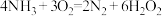 。该电池负极的电极反应式为
。该电池负极的电极反应式为___________ ;用该电池进行粗铜(含 、
、 、
、 、
、 、
、 等杂质)的电解精炼,以
等杂质)的电解精炼,以 溶液为电解质溶液,下列说法正确的是
溶液为电解质溶液,下列说法正确的是___________ 。
a.电能全部转化为化学能
b. 的物质的量浓度不变(不考虑溶液体积变化)
的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中 向阳极移动
向阳极移动
d.利用阳极泥可回收 、
、 、
、 等金属
等金属
e.若阳极质量减少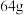 ,则转移电子
,则转移电子
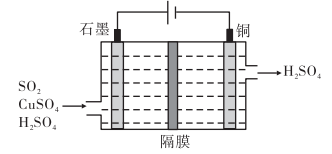
(2)利用如图所示电化学装置吸收工业尾气中的 消除污染,阴极上生成
消除污染,阴极上生成 。写出装置中阳极的电极反应式
。写出装置中阳极的电极反应式___________ 。
(3)已知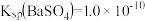 ,
,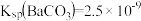 。某同学设想用下列流程得到
。某同学设想用下列流程得到 ,
,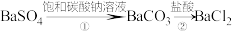 。则①的离子方程式为
。则①的离子方程式为___________ ,该反应的平衡常数
___________ 。
(1)氨气燃料电池使用的电解质溶液是
 溶液,电池反应为:
溶液,电池反应为: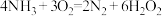 。该电池负极的电极反应式为
。该电池负极的电极反应式为 、
、 、
、 、
、 、
、 等杂质)的电解精炼,以
等杂质)的电解精炼,以 溶液为电解质溶液,下列说法正确的是
溶液为电解质溶液,下列说法正确的是a.电能全部转化为化学能
b.
 的物质的量浓度不变(不考虑溶液体积变化)
的物质的量浓度不变(不考虑溶液体积变化)c.溶液中
 向阳极移动
向阳极移动d.利用阳极泥可回收
 、
、 、
、 等金属
等金属e.若阳极质量减少
 ,则转移电子
,则转移电子
(2)利用如图所示电化学装置吸收工业尾气中的
 消除污染,阴极上生成
消除污染,阴极上生成 。写出装置中阳极的电极反应式
。写出装置中阳极的电极反应式
(3)已知
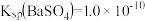 ,
,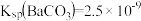 。某同学设想用下列流程得到
。某同学设想用下列流程得到 ,
,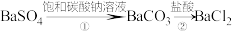 。则①的离子方程式为
。则①的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
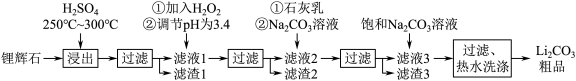
已知:①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量FeO、MgO等。
②Li2O·Al2O3·4SiO2+H2SO4 Li2SO4+Al2O3·4SiO2·H2O
Li2SO4+Al2O3·4SiO2·H2O
③某些物质的溶解度(S)如下表所示。
④Fe3+完全沉淀时pH为3.4
(1)为提高原料浸出速率,除升高温度外还可采取的措施是__________ (任写一条)。
(2)在滤液1中加入H2O2的目的是__________ (用离子方程式表示);调节pH最佳试剂是__________ (填序号 )。
(3)从滤渣中分离出Al2O3的流程如下图所示,请写出生成沉淀的离子方程式__________ 。

(4)向滤液2中加入Na2CO3溶液的作用是__________ 。
(5)“过滤、热水洗涤”步骤中,“热水洗涤”的原因是__________ ;证明沉淀已洗净的操作是__________ 。

已知:①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量FeO、MgO等。
②Li2O·Al2O3·4SiO2+H2SO4
 Li2SO4+Al2O3·4SiO2·H2O
Li2SO4+Al2O3·4SiO2·H2O③某些物质的溶解度(S)如下表所示。
| T℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)为提高原料浸出速率,除升高温度外还可采取的措施是
(2)在滤液1中加入H2O2的目的是
| A.CuO | B.CuCO3 | C.MgO | D.NH3·H2O |

(4)向滤液2中加入Na2CO3溶液的作用是
(5)“过滤、热水洗涤”步骤中,“热水洗涤”的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】回答下列问题:
(1)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
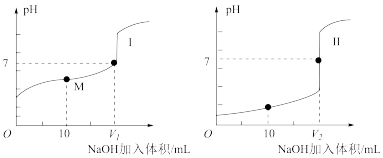
①滴定醋酸的曲线是__ (填“I”或“II”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是__ 。
③V1和V2的关系:V1__ V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是__ 。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀。相同温度下,溶解度:AgSCN>AgI。
①写出步骤2中溶液变红色的离子方程式___ 。
②步骤3中现象a是__ 。
③用化学平衡原理解释步骤4的实验现象__ 。
(1)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是
③V1和V2的关系:V1
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀。相同温度下,溶解度:AgSCN>AgI。
| 操作步骤 | 现象 |
| 步骤1:向2mL0.005mol•L-1AgNO3溶液中加入2mL0.005mol•L-1KSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1Fe(NO3)3溶液。 | 溶液变红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液。 | 现象a,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液。 | 浊液中出现黄色沉淀。 |
①写出步骤2中溶液变红色的离子方程式
②步骤3中现象a是
③用化学平衡原理解释步骤4的实验现象
您最近一年使用:0次



