(1)①氯胺(NH2Cl)的电子式为
| 化学键 | 键能/(kJ·mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s)
 N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)
 N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示: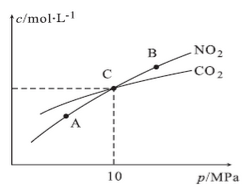
①A、B两点的浓度平衡常数关系:Kc(A)
②A、B、C三点中NO2的转化率最高的是
③计算C点时该反应的压强平衡常数Kp(C)=
相似题推荐
I.真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3(s)+3C(s)=Al2OC(s)+2CO(g) ΔH=a kJ·mol-1
2Al2OC(s)+3C(s)=Al4C3(s)+2CO(g) ΔH=b kJ·mol-1
2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) ΔH3
(1)ΔH3=
(2)Al4C3遇水剧烈反应,生成最简单的烃,该反应的化学方程式为
II.
(3)用还原法也可以处理氮氧化合物,发生的反应为:2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,在一恒压绝热的密闭容器中,不能表示上述反应达到平衡状态的是
A.单位时间内断裂1mol N≡N键的同时生成4mol C=O键
B.c(NO)∶c(N2)∶c(CO2)=2∶1∶2
C.混合气体的密度保持不变
D.容器内的总压强保持不变
E.容器内温度保持不变
F.混合气体的平均摩尔质量保持不变
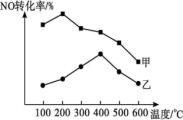
(4)为探究温度及不同催化剂对反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的影响,分别在不同温度、不同催化剂(甲、乙)下,保持其他初始条件不变,重复实验,在相同时间内测得NO的转化率与温度的关系如图所示,结合图象,最合适的反应条件为
Ⅲ.
(5)工业上合成甲醇时常以Cu2O作催化剂。合成原理:CO(g)+2H2(g)⇌CH3OH(g) ∆H<0,研究表明,反应体系中少量CO2有利于维持催化剂Cu2O的量不变,请结合平衡移动原理分析其原因是
(6)向一恒容密闭容器中充入3mol CO和4mol H2,开始测得气体的总压为7MPa,在一定温度下合成甲醇,10min后达到平衡,测得H2的转化率为50%,该反应的平衡常数KP=
(7)CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
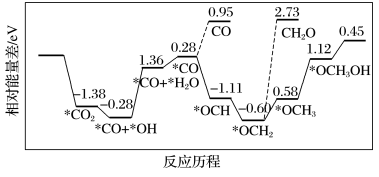
容易得到的副产物有CO和CH2O,其中相对较多的副产物为
(1)煤的液化发生的主要反应之一为2H2(g)+CO(g)=CH3OH (g) ΔH=a kJ·mol−1,在不同温度下,K(500℃)=2.5 L2·mol−2,K(700℃)=0.2 L2·mol−2。
①ΔH
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH3OH物质的量分别为2 mol、1 mol、3mol,则此时生成CH3OH的速率
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
i 2CH3OH(g)=C2H4(g)+2H2O(g) ΔH1=-20.9 kJ·mol−1
ii3CH3OH(g)=C3H6(g)+3H2O(g) ΔH2=-98.1 kJ·mol−1
iii 4CH3OH(g)=C4H8(g)+4H2O(g) ΔH3=-118.1 kJ·mol−1
①C3H6转化为C2H4的热化学方程式为iv:2C3H6(g)
 3C2H4 (g) ΔH4=
3C2H4 (g) ΔH4=②加入N2作为稀释剂,反应i中C2H4的产率将
(3)为研究不同条件对反应的影响,测得不同温度下平衡时C2H4、C3H6和C4H8的物质的量分数变化,如图所示:

①随着温度的升高,C3H6的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
②体系总压为0.1MPa,400℃时反应iv的平衡常数Kp=
③为了获得更高的C2H4在产物中的比例,除控制较高温度的条件外,以下较适宜的是
A.增加水醇比 B.降低水醇比
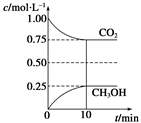
I.在一定温度下的2 L固定容积的密闭容器中,通入2 mol CO2和3 mol H2,发生的反应为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。①不能说明该反应已达平衡状态的是
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2 mol H2,同时消耗0.4 mol H2O
D.反应中H2O与CH3OH的物质的量浓度之比为1∶1,且保持不变
②从0 min到10 min,v(H2)=
③下列措施中不能使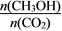 增大的是
增大的是
A.降低温度 B.将H2O(g)从体系中分离
C.恒温恒容下充入He(g) D.恒温恒容再充入2 mol CO2和3 mol H2
④计算该温度下此反应的平衡常数K=
II.为进一步探究CO2与NaCN溶液反应的产物,查得数据如下:
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:
III.(1)有一种利用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) ===CH3OH(g)+H2O(l) ΔH=-a kJ·mol-1;
CH3OH(g)===CH3OH(l) ΔH=-b kJ·mol-1;
2H2(g)+O2(g)===2H2O(l) ΔH=-c kJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为
(2)某甲醇燃料电池原理如图所示。
①M区发生反应的电极反应式为
②用上述电池做电源,用如图装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL(体积变化忽略),当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为
(1)用FeO作载氧剂,部分反应的lgKp与温度的关系如图所示。[已知:平衡常数Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]
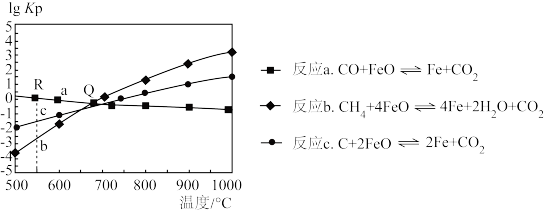
①图中涉及的反应中,属于吸热反应的是反应
②R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌CO2(g)+Fe(s),则CO的平衡转化率为
(2)在T℃下,向某恒容密闭容器中加入2molCH4(g)和8molFeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,达到平衡状态时,容器的气体压强是起始压强的2倍。
①T℃下,该反应的Kp=
②若起始时向该容器中加入1molCH4(g),4molFeO(s),1molH2O(g),0.5molCO2(g),此时反应向
(3)一种微胶囊吸收剂,将煤燃烧排放的CO2以安全、高效的方式处理掉,胶囊内部充有Na2CO3溶液,其原理如图所示。
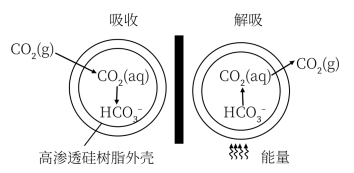
①这种微胶囊吸收CO2的原理是
②在吸收过程中当n(CO2):n(Na2CO3)=1:3时,溶液中
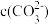
 )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。③将解吸后的CO2催化加氢可制取乙烯。
已知:C2H4(g)+O2(g)=2CO2(g)+2H2O(g)∆H1=-1323kJ/mol
2H2(g)+O2(g)=H2O(g)∆H2=-483.6kJ/mol
2CO(g)+6H2(g)=C2H4(g)+4H2O(g)∆H3=
 可合成烷烃、烯烃、醇等系列重要化工原料。回答下列有关问题:
可合成烷烃、烯烃、醇等系列重要化工原料。回答下列有关问题:I.制备甲烷
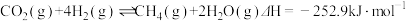
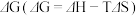 与温度的关系如图1所示。
与温度的关系如图1所示。①要使该反应能顺利发生,理论上温度不高于
②在恒温、恒容容器中进行该反应,下列
A.
 和
和 的转化率之比不再变化 B.混合气体的平均摩尔质量不再变化
的转化率之比不再变化 B.混合气体的平均摩尔质量不再变化C.容器内的压强不再变化 D.
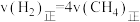
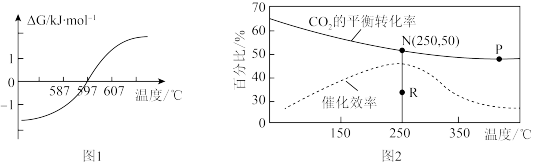
(2)选择合适催化剂,在密闭容器中按
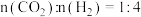 充入反应物,反应结果如图2所示。
充入反应物,反应结果如图2所示。①若N点压强为
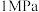 ,则平衡常数
,则平衡常数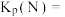
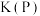
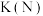 (填“>”、<”或“=”)。
(填“>”、<”或“=”)。②若无催化剂,N点平衡转化率是否可能降至R点?说明理由。答:
II.制备甲醇:
主反应:
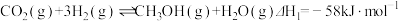
副反应:
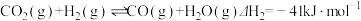
(3)向恒容容器中充入
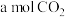 和
和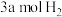 ,在催化剂存在的条件下进行反应,测得温度与平衡转化率、产物选择性的关系如下图所示。
,在催化剂存在的条件下进行反应,测得温度与平衡转化率、产物选择性的关系如下图所示。
 选择性
选择性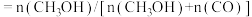
①
 选择性随温度升高而下降的原因是
选择性随温度升高而下降的原因是②有利于提高
 选择性的反应条件是
选择性的反应条件是A.高温高压 B.低温低压 C.高温低压 D.低温高压
(1)已知T℃时,2SO2(g)+O2(g)
 2SO3(g) △H1
2SO3(g) △H12H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s)
 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol • L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图所示。
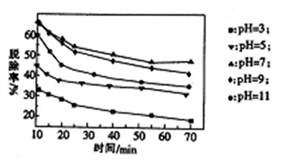
①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为
(2)脱硝时,最佳pH为
 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示。
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示。

(2)若容器Ⅰ的体积为2L,反应在370℃下进行,20s后达到平衡,则从起始到平衡过程中N2O反应速率为
(3)容器Ⅱ中,反应在B点时对应的平衡常数K=
(4)根据题给信息,下列有关说法正确的是_____。
| A.体积之比:VⅠ>VⅡ>VⅢ |
| B.容器Ⅲ中,当N2与O2物质的量之比为2:1时反应达平衡状态 |
| C.图乙中A、C、D对应的容器中混合气体平均相对分子质量相等 |
| D.图乙中A、C、D三点由于转化率相等,因而平衡常数相等 |
| A.υ正>υ逆 | B.υ正<υ逆 | C.υ正=υ逆 |
反应I:主反应CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1 Kp1
2CO(g)+2H2(g) ΔH1 Kp1反应II:副反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2 Kp2
CO(g)+H2O(g) ΔH2 Kp2反应III:积碳反应2CO(g)
 CO2(g)+C(s) ΔH3 Kp3
CO2(g)+C(s) ΔH3 Kp3反应IV:积碳反应CH4(g)
 C(s)+2H2(g) ΔH4 Kp4
C(s)+2H2(g) ΔH4 Kp4(1)已知H2(g)、CO(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0lkJ·mol-1,H2O(l)= H2O(g) ΔH5=+44kJ·mol-1,则反应II的ΔH2=
(2)设Kp为分压平衡常数(用分压代替浓度,气体分压=总压×该组分的物质的量分数),反应III、IV的lgKp随
 (T表示温度)的变化如图所示。据图判断,反应I的ΔH1
(T表示温度)的变化如图所示。据图判断,反应I的ΔH1
A.在投料时适当增大 的值,有利于减少积碳 的值,有利于减少积碳 |
| B.在一定条件下建立平衡后,移去部分积碳,反应III和反应IV平衡均向右移 |
C.随着投料比 的增大,达到平衡时CH4的转化率增大 的增大,达到平衡时CH4的转化率增大 |
| D.降低反应温度,反应I、II、IV的正反应速率减小,逆反应速率增大;反应III的正反应速率增大,逆反应速率减小 |
 =1加入反应物,发生反应I(反应II、III、IV可忽略)。在不同条件下达到平衡,设体系中平衡状态下甲烷的物质的量分数为x(CH4),在T=800℃下的x(CH4)随压强P的变化曲线、在P=100kPa下的x(CH4)随温度T的变化曲线如图所示。
=1加入反应物,发生反应I(反应II、III、IV可忽略)。在不同条件下达到平衡,设体系中平衡状态下甲烷的物质的量分数为x(CH4),在T=800℃下的x(CH4)随压强P的变化曲线、在P=100kPa下的x(CH4)随温度T的变化曲线如图所示。
②若x(CH4)=0.1.则CO2的平衡转化率为
I. CO的处理。硝酸的工业尾气中含有大量的氮氧化物,在一定条件下用氮氧化物处理CO能使有毒气体都变为环境友好型物质。已知有下列反应:
①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ/mol
②N2(g)+O2(g)=2NO(g) △H=+181 kJ/mol
(1)请写出用NO处理CO反应的热化学方程式
a 增大反应体系的压强 b 使用优质催化剂 c 适当降低温度 d 增大NO的浓度
II.氧硫化碳(COS)的脱硫处理。在一定条件下用水蒸气与氧硫化碳反应是常用的脱硫方法,其热化学方程式为:COS(g)+H2O(g)⇌H2S(g)+CO2(g) △H=- 35 kJ/mol
(2)向容积为2 L的密闭容器中加入等物质的量的水蒸气和氧硫化碳,在一定条件发生上述脱硫反应,反应开始时压强为P(MPa),测得一定时间内COS(g)和CO2(g)的物质的量变化如表所示:
| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0min | 5min | 10min | 15min | 20min | 25min | 30min | |
| COS(g) | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| CO2(g) | 0 | 0.84 | 1.20 | 1.20 | 1.50 | 1.60 | 1.60 |
①0~5 min内以COS(g)表示的反应速率v(COS)=
②由表中数据变化判断T1
③T1℃时,平衡常数Kp=
(3)实验测得:v正=k正·c(COS)·c(H2O),v逆=k逆c(H2S)·c(CO2)(k正、k逆为速率常数,与温度有关)。若在2 L的密闭容器中充入1 mol COS和1 mol H2O, 在T2℃温度下达到平衡时,k正:k逆=



