捕集CO2的技术对解决全球温室效应意义重大。目前国际空间站处理CO2的一个重要方法是将CO2还原,涉及的化学反应如下:CO2(g)+4H2(g)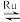 CH4(g)+2H2O(g)+Q(Q>0)
CH4(g)+2H2O(g)+Q(Q>0)
完成下列填空:
(1)该反应的平衡常数表达式为________________________________ 。如果改变某种条件,平衡向正反应方向移动,则平衡常数________ (填写编号)。
a、一定增大 b、一定减小 c、可能增大 d、可能减小 e、可能不变
(2)为了提高CO2的捕获百分率,可采取的措施是____________________ 。(任写一条)
(3)向2L某密闭容器充入1mol CO2和4mol H2,一定条件下发生上述反应。5min末测得气体的物质的量减少了20%,则0~5min内CO2的平均反应速率为_______________ 。CO2还可应用于纯碱工业。工业生产纯碱的过程中,向饱和的氨化食盐水中通入足量CO2的生产环节又被称为“碳酸化”。
(4)碳酸化时产生的现象是____________________________ 。碳酸化过程中,溶液中c(CO32-)的变化情况为____________________ 。
(5)碳酸化后过滤,留在滤液中的阳离子主要有_______________ (填写化学式)。简述检验滤液中Cl- 离子的实验操作。________________________________
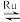 CH4(g)+2H2O(g)+Q(Q>0)
CH4(g)+2H2O(g)+Q(Q>0)完成下列填空:
(1)该反应的平衡常数表达式为
a、一定增大 b、一定减小 c、可能增大 d、可能减小 e、可能不变
(2)为了提高CO2的捕获百分率,可采取的措施是
(3)向2L某密闭容器充入1mol CO2和4mol H2,一定条件下发生上述反应。5min末测得气体的物质的量减少了20%,则0~5min内CO2的平均反应速率为
(4)碳酸化时产生的现象是
(5)碳酸化后过滤,留在滤液中的阳离子主要有
2018·上海普陀·二模 查看更多[3]
上海市普陀区2018届高三3月等级考模拟质量调研(二模)化学试题(已下线)上海市普陀区2018届高三二模等级高考化学卷(已下线)专题06 酸碱中和与盐类水解及难溶电解质的沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)
更新时间:2018-04-07 19:52:15
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】气态含氮化合物既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。请回答下列问题:
(1)用NH3催化还原NO,可以消除氮氧化物的污染。已知:
①4NH3(g)+3O2(g)2 = N2(g)+6H2O(g)ΔH=-akJ/mol
②N2(g)+O2(g)=2NO(g) ΔH=-bkJ/mol
写出NH3还原NO至N2和水蒸气的热化学方程式_____ 。
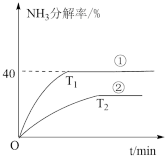
(2)恒容密闭容器中,在Ni作催化剂条件下,NH3分解反应如下:
2NH3(g) N2(g)+3H2(g),不同温度下,NH3分解率随时间的变化如图所示,则曲线①②中,温度较低的曲线为
N2(g)+3H2(g),不同温度下,NH3分解率随时间的变化如图所示,则曲线①②中,温度较低的曲线为_____
(3)东南大学王金兰课题组提出合成氨的“表面氢化机理”如图所示,在较低的电压下实现氮气的还原合成氨。

已知:第一步:*H++e- = *H(快)(吸附在催化剂表而的物种用*表示);
第二步:N2+2*H =中间体(吸附在催化剂表面)(慢);
第三步:___________ (快)(写出第三步的方程式)。其中,第二步为决速步,原因是___________ 。该法较传统工业合成氨法,具有能耗小、环境友好的优点。
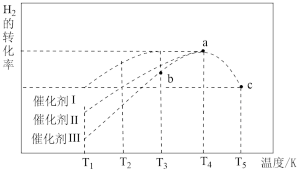
(4)向一恒定温度的刚性密闭容器中充入物质的量之比为1:1的N2和H2混合气体,初始压强为30MPa,在不同催化剂作用下反应,相同时间内H2的转化率随温度的变化如图所示,b点v正___________ v逆(填“>”、“<”或“=”)。图中a点混合气体平均相对分子质量为18.75,a点对应温度下反应的平衡常数Kp=___________ (保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数)
物质的量分数)
(5)氨不仅应用于化肥生产,也可以应用于能源领域,与氢氧燃料电池比,氨氧燃料电池有其独特优势。某研究小组设计的氨氧燃料电池装置如图所示,则电极1的电极反应式为___________ 标准状况下,当3.36LO2参加反应时,生成N2的物质的量为_______

(1)用NH3催化还原NO,可以消除氮氧化物的污染。已知:
①4NH3(g)+3O2(g)2 = N2(g)+6H2O(g)ΔH=-akJ/mol
②N2(g)+O2(g)=2NO(g) ΔH=-bkJ/mol
写出NH3还原NO至N2和水蒸气的热化学方程式
(2)恒容密闭容器中,在Ni作催化剂条件下,NH3分解反应如下:
2NH3(g)
 N2(g)+3H2(g),不同温度下,NH3分解率随时间的变化如图所示,则曲线①②中,温度较低的曲线为
N2(g)+3H2(g),不同温度下,NH3分解率随时间的变化如图所示,则曲线①②中,温度较低的曲线为
(3)东南大学王金兰课题组提出合成氨的“表面氢化机理”如图所示,在较低的电压下实现氮气的还原合成氨。

已知:第一步:*H++e- = *H(快)(吸附在催化剂表而的物种用*表示);
第二步:N2+2*H =中间体(吸附在催化剂表面)(慢);
第三步:
(4)向一恒定温度的刚性密闭容器中充入物质的量之比为1:1的N2和H2混合气体,初始压强为30MPa,在不同催化剂作用下反应,相同时间内H2的转化率随温度的变化如图所示,b点v正
 物质的量分数)
物质的量分数)
(5)氨不仅应用于化肥生产,也可以应用于能源领域,与氢氧燃料电池比,氨氧燃料电池有其独特优势。某研究小组设计的氨氧燃料电池装置如图所示,则电极1的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应: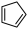 (l)+H2(g)
(l)+H2(g)
 (环戊烯)(l) ∆H=-100.5 kJ/mol
(环戊烯)(l) ∆H=-100.5 kJ/mol
副反应: (l)+H2(g)
(l)+H2(g)
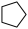 (环戊烷)(l) ∆H=-109.4 kJ/mol
(环戊烷)(l) ∆H=-109.4 kJ/mol
解聚反应:
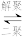 2
2 (g) ∆H>0
(g) ∆H>0
回答下列问题:
(1)反应 (l)+2H2(g)
(l)+2H2(g)
 (l)的△H=
(l)的△H=_________ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:

①0~4 h氢化反应速率比副反应快的可能原因是___________________ 。
②最佳的反应时间为_________ h。若需迅速减慢甚至停止反应,可采取的措施有__________________ (写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_____________________ 。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是________ (填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则 p(H2O)=________ kPa,平衡常数Kp=__________ kPa (Kp为以分压表示的平衡常数)。
氢化反应:
 (l)+H2(g)
(l)+H2(g)
 (环戊烯)(l) ∆H=-100.5 kJ/mol
(环戊烯)(l) ∆H=-100.5 kJ/mol副反应:
 (l)+H2(g)
(l)+H2(g)
 (环戊烷)(l) ∆H=-109.4 kJ/mol
(环戊烷)(l) ∆H=-109.4 kJ/mol解聚反应:

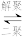 2
2 (g) ∆H>0
(g) ∆H>0回答下列问题:
(1)反应
 (l)+2H2(g)
(l)+2H2(g)
 (l)的△H=
(l)的△H=(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:

①0~4 h氢化反应速率比副反应快的可能原因是
②最佳的反应时间为
③一段时间后,环戊烯产率快速下降的原因可能是
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则 p(H2O)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】甲醇是一种清洁能源。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ: ,
,
反应Ⅱ: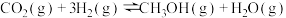 ,
,
(1) 与
与 分子中碳原子的杂化方式分别为
分子中碳原子的杂化方式分别为_______ 、 的分子构型为
的分子构型为_______
(2)将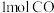 和
和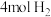 充入2L的密闭容器中发生反应I,10
充入2L的密闭容器中发生反应I,10 后测得
后测得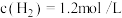 计算此段时间的反应速率(用
计算此段时间的反应速率(用 表示)
表示)_______ 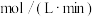 。
。
(3)反应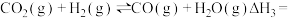
_______ (用 和
和 表示)。
表示)。
(4)若容器容积不变,下列措施可提高反应Ⅱ中 的平衡转化率的是(选字母)_______
的平衡转化率的是(选字母)_______
(5)保持恒温条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡常数K_______ (填“增大”、“减小”或“不变”),化学平衡向_______ (填“正反应”或“逆反应”)移动
反应Ⅰ:
 ,
,
反应Ⅱ:
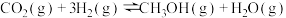 ,
,
(1)
 与
与 分子中碳原子的杂化方式分别为
分子中碳原子的杂化方式分别为 的分子构型为
的分子构型为(2)将
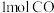 和
和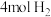 充入2L的密闭容器中发生反应I,10
充入2L的密闭容器中发生反应I,10 后测得
后测得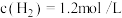 计算此段时间的反应速率(用
计算此段时间的反应速率(用 表示)
表示)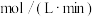 。
。(3)反应
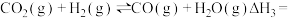
 和
和 表示)。
表示)。(4)若容器容积不变,下列措施可提高反应Ⅱ中
 的平衡转化率的是(选字母)_______
的平衡转化率的是(选字母)_______A.充入 ,使体系总压强增大 ,使体系总压强增大 |
B.将 从体系中分离出来 从体系中分离出来 |
C.充入 ,使体系总压强增大 ,使体系总压强增大 |
D.充入 增大体系的总压强 增大体系的总压强 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(一)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
(1)①混合气体的平均相对分子质量_______ 。
②列式并计算平衡常数K=_______ 。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是_______ 。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正_______ v逆(填“>”、“<”或“=”)。
(二)已知化学反应①Fe(s)+CO2(g) FeO(s)+CO(g) ,其平衡常数为K1;
FeO(s)+CO(g) ,其平衡常数为K1;
②Fe(s)+H2O(g) FeO(s)+H2(g) ,其平衡常数为K2.在温度973K和1173K情况下,K1.、K2的值分别如下:
FeO(s)+H2(g) ,其平衡常数为K2.在温度973K和1173K情况下,K1.、K2的值分别如下:
(2)通过表格中的数值可以推断:反应①是_______ (填“吸热”或“放热”)反应。
(3)现有反应③:H2(g)+CO2(g) H2O(g)+CO(g) :根据反应①与② 可推导出K1、K2、K3的关系式为
H2O(g)+CO(g) :根据反应①与② 可推导出K1、K2、K3的关系式为_______
(4)据此关系和上表数据,也能推断出反应③是_______ (填“吸热”或“放热”)反应。
(一)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)
 CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:| 物质 | CO | H2 | CH3OH |
| 浓度(mol•L-1) | 0.9 | 1.0 | 0.6 |
②列式并计算平衡常数K=
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正
(二)已知化学反应①Fe(s)+CO2(g)
 FeO(s)+CO(g) ,其平衡常数为K1;
FeO(s)+CO(g) ,其平衡常数为K1;②Fe(s)+H2O(g)
 FeO(s)+H2(g) ,其平衡常数为K2.在温度973K和1173K情况下,K1.、K2的值分别如下:
FeO(s)+H2(g) ,其平衡常数为K2.在温度973K和1173K情况下,K1.、K2的值分别如下:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(3)现有反应③:H2(g)+CO2(g)
 H2O(g)+CO(g) :根据反应①与② 可推导出K1、K2、K3的关系式为
H2O(g)+CO(g) :根据反应①与② 可推导出K1、K2、K3的关系式为(4)据此关系和上表数据,也能推断出反应③是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
 (反应I)
(反应I)
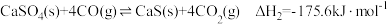 (反应II)
(反应II)
请回答下列问题:
(1)反应I在低温条件下不能自发进行,则该反应的
___________ 0(填“大于”、“小于”或“等于”)。
(2)对于反应I、反应II,下列描述不正确的是___________
(3)通过监测反应体系中气体浓度的变化判断反应I和II是否同时发生,理由是___________ 。
(4)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有___________ 。(至少写出两条措施)

(5)恒温恒容条件下,假设反应I和II同时发生,且 ,请在图2中面出反应体系中c(SO2)随时间t变化的总趋势图
,请在图2中面出反应体系中c(SO2)随时间t变化的总趋势图___________ 。

 (反应I)
(反应I)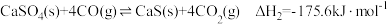 (反应II)
(反应II)请回答下列问题:
(1)反应I在低温条件下不能自发进行,则该反应的

(2)对于反应I、反应II,下列描述不正确的是___________
| A.在恒温恒容密闭容器中只进行反应I,若CO2的气体体积分数不再改变,说明反应I达到平衡状态 |
| B.上述两个反应达到平衡后,瞬间降温后,两个反应的正反应速率均一直降低至达到新的平衡 |
| C.恒温恒压条件下,增大CO的浓度能使反应II的平衡正向移动 |
| D.升高温度,反应II的平衡常数增大 |
(4)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有

(5)恒温恒容条件下,假设反应I和II同时发生,且
 ,请在图2中面出反应体系中c(SO2)随时间t变化的总趋势图
,请在图2中面出反应体系中c(SO2)随时间t变化的总趋势图
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】降低大气中C02的含量及有效地开发利用CO2,已引起了全世界的普遍重视。
(1)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。
①2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1
CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1
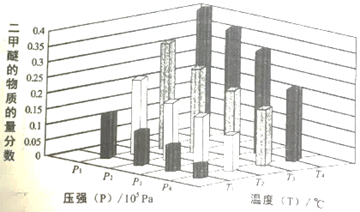
某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时、改变压强和温度,平衡体系中CH3OCH3(g)的物质分数变化情况如图所示,则p1______ p2(填“>”“<”或“=”,下同)。若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1______ K3,T1、P1时H2的平衡转化率为____________ 。
②在恒容密闭容器里按体积比为1:3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是______ (填序号)。
A. 反应物的浓度增大 B. 混合气体的密度减小
C. 正反应速率小于逆反应速率 D. 氢气的转化率减小
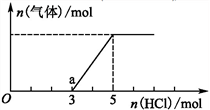
(2)将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:通入1mol HCl时,溶液中所含溶质的化学式_____________ ,a点溶液中各离子浓度由大到小的关系式为___________________ 。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其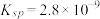 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为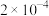 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为
mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________ mol·L-1.
(1)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。
①2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1
CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1
某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时、改变压强和温度,平衡体系中CH3OCH3(g)的物质分数变化情况如图所示,则p1
②在恒容密闭容器里按体积比为1:3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是
A. 反应物的浓度增大 B. 混合气体的密度减小
C. 正反应速率小于逆反应速率 D. 氢气的转化率减小
(2)将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:通入1mol HCl时,溶液中所含溶质的化学式

(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其
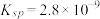 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为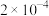 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为
mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
①写出该反应平衡常数的表达式________ 。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量________ ;充入氦气,混合气体的密度________ (填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1mol·L-1的下列六种溶液的pH如下表:
①根据表中数据判断,浓度均为0.01mol·L-1的下列四种物质的溶液中,酸性最强的是________ (填编号)。
A.HCNB.HClOC.H2CO3D.CH3COOH
②据上表数据,请你判断下列反应不能成立的是________ (填编号)。
A.CH3COOH+Na2CO3===NaHCO3+CH3COONa
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2+H2O+2NaClO===Na2CO3+2HClO
(3)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂,写出使用时发生反应的离子方程式_______________________________________________________
(4)写出难溶电解质的溶度积表达式,Mg(OH)2:____________ ;在Mg(OH)2悬浊液中加入MgCl2固体,平衡________ 移动(填“正向”“逆向”或“不”),Ksp________ (填“增大”“减小”或“不变”)。
(5)1g固体炭与水蒸气反应生成CO气体和H2气体,需吸收akJ热量,此反应的热化学方程式为____________________________________
 Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:| T/K | 938 | 1100 |
| K | 0.68 | 0.40 |
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量
(2)常温下,浓度均为0.1mol·L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCNB.HClOC.H2CO3D.CH3COOH
②据上表数据,请你判断下列反应不能成立的是
A.CH3COOH+Na2CO3===NaHCO3+CH3COONa
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2+H2O+2NaClO===Na2CO3+2HClO
(3)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂,写出使用时发生反应的离子方程式
(4)写出难溶电解质的溶度积表达式,Mg(OH)2:
(5)1g固体炭与水蒸气反应生成CO气体和H2气体,需吸收akJ热量,此反应的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。
(1)室温下,测得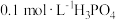 溶液的
溶液的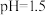 ,用电离方程式解释原因:
,用电离方程式解释原因:___________ 。
(2)羟基磷灰石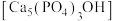 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: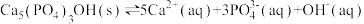 。 长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。 长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:___________ 。
(3)常温下,向磷酸溶液中滴加NaOH溶液,含磷微粒的分布比例与pH的关系如图所示。
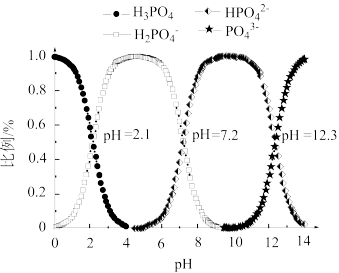
①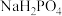 溶液显酸性。下列有关分析正确的是
溶液显酸性。下列有关分析正确的是___________ 。
a.溶液中
b. 的电离程度大于其水解程度
的电离程度大于其水解程度
c.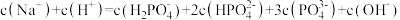
d.溶液中水的电离程度比纯水大
②当溶液的pH由4到10时,所发生反应的离子方程式是:___________ 。
(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将可乐样品注入圆底烧瓶,加入活性炭,吸附色素。
ii.将可乐回流加热10 min,冷却至室温,过滤。
iii.取50.00 mL滤液,用百里香酚酞作指示剂,用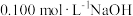 溶液滴定至终点时生成
溶液滴定至终点时生成 ,消耗NaOH溶液5.00 mL。
,消耗NaOH溶液5.00 mL。
①加热的目的是___________ 。
②该可乐样品中磷酸的含量为___________ g/L。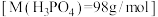
 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。(1)室温下,测得
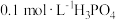 溶液的
溶液的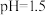 ,用电离方程式解释原因:
,用电离方程式解释原因:(2)羟基磷灰石
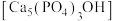 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: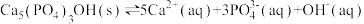 。 长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。 长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:(3)常温下,向磷酸溶液中滴加NaOH溶液,含磷微粒的分布比例与pH的关系如图所示。

①
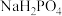 溶液显酸性。下列有关分析正确的是
溶液显酸性。下列有关分析正确的是a.溶液中

b.
 的电离程度大于其水解程度
的电离程度大于其水解程度c.
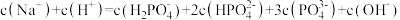
d.溶液中水的电离程度比纯水大
②当溶液的pH由4到10时,所发生反应的离子方程式是:
(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将可乐样品注入圆底烧瓶,加入活性炭,吸附色素。
ii.将可乐回流加热10 min,冷却至室温,过滤。
iii.取50.00 mL滤液,用百里香酚酞作指示剂,用
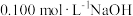 溶液滴定至终点时生成
溶液滴定至终点时生成 ,消耗NaOH溶液5.00 mL。
,消耗NaOH溶液5.00 mL。①加热的目的是
②该可乐样品中磷酸的含量为
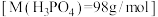
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g) 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=________ kJ·mol-1。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________ 。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
D.反应物气体体积分数增大
(3)在体积可变的密闭容器中投入1molCO和2mol H2,在不同条件下发生反应:CO(g)+2H2(g) CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。

①该反应自发进行的条件是________ (填“低温”、“高温”或“任意温度”)
②506K时,反应平衡时H2的转化率为________ ;压强:p1________ (填“>”“<”或“=”)p2。
③反应速率:N点v正(CO)________ (填“>”“<”或“=”)M点v逆(CO)。
(4)已知常温下,H2A在水中存在以下平衡:H2A H++HA﹣,HA﹣
H++HA﹣,HA﹣ H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)⇌Ca2+(aq)+A2﹣(aq)△H>0。
H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)⇌Ca2+(aq)+A2﹣(aq)△H>0。
①温度升高时,Ksp________ (填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________ 。
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2③2CH4(g)+O2(g)
 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1(1)ΔH2=
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是
A.正反应速率先增大后减少
 B.化学平衡常数K减少
B.化学平衡常数K减少C.再加入一定量碳
 D.反应物气体体积分数增大
D.反应物气体体积分数增大(3)在体积可变的密闭容器中投入1molCO和2mol H2,在不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。
①该反应自发进行的条件是
②506K时,反应平衡时H2的转化率为
③反应速率:N点v正(CO)
(4)已知常温下,H2A在水中存在以下平衡:H2A
 H++HA﹣,HA﹣
H++HA﹣,HA﹣ H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)⇌Ca2+(aq)+A2﹣(aq)△H>0。
H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)⇌Ca2+(aq)+A2﹣(aq)△H>0。①温度升高时,Ksp
②滴加少量浓盐酸,c(Ca2+)
您最近一年使用:0次



