以甲烷为原料合成甲醇的反应如下:
反应I:CH4(g) + CO2(g) 2CO(g) + 2H2(g) △H1= +247 kJ/mol
2CO(g) + 2H2(g) △H1= +247 kJ/mol
反应II:CO(g) + 2H2(g) CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
已知: T1℃时,反应II 的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。下列说法中,正确的是
反应I:CH4(g) + CO2(g)
 2CO(g) + 2H2(g) △H1= +247 kJ/mol
2CO(g) + 2H2(g) △H1= +247 kJ/mol 反应II:CO(g) + 2H2(g)
 CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol已知: T1℃时,反应II 的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。下列说法中,正确的是
| A.反应I中,使用催化剂可以减小△H1,提高反应速率 |
| B.反应II 中,加热或加压均可提高原料气的平衡转化率 |
| C.由上述数据可判断反应II 的温度: T1> T2 |
D.CO(g)+CH3OH(g) CH4(g) +CO2(g) △H= +157 kJ/mol CH4(g) +CO2(g) △H= +157 kJ/mol |
更新时间:2018-04-13 17:59:46
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】依据图示关系,下列说法正确的是
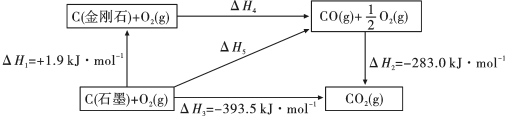

A.石墨的燃烧热 |
B.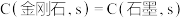  ,则金刚石比石墨稳定 ,则金刚石比石墨稳定 |
C. 石墨或 石墨或 金刚石分别完全燃烧,金刚石放出热量多 金刚石分别完全燃烧,金刚石放出热量多 |
D.反应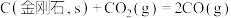 在任何温度下均能自发进行 在任何温度下均能自发进行 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】已知:①
②
③
则反应 的
的 等于
等于

②

③

则反应
 的
的 等于
等于A. | B. |
C. | D. |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】CO2催化重整CH4的反应:(Ⅰ)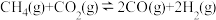 △H1,主要副反应:(Ⅱ)
△H1,主要副反应:(Ⅱ) 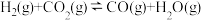 △H2>0,(Ⅲ)
△H2>0,(Ⅲ)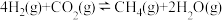 △H3<0。在恒容反应器中CH4和CO2按物质的量之比1:1充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法错误的是
△H3<0。在恒容反应器中CH4和CO2按物质的量之比1:1充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法错误的是

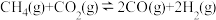 △H1,主要副反应:(Ⅱ)
△H1,主要副反应:(Ⅱ) 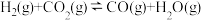 △H2>0,(Ⅲ)
△H2>0,(Ⅲ)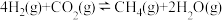 △H3<0。在恒容反应器中CH4和CO2按物质的量之比1:1充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法错误的是
△H3<0。在恒容反应器中CH4和CO2按物质的量之比1:1充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法错误的是
| A.△H1>0 |
| B.若反应Ⅰ、Ⅲ消耗等量的CO2时,转移电子数之比为3:4 |
| C.300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量 |
| D.T℃时,在2.0L容器中加入1molCH4、1molCO2以及催化剂进行重整反应,测得CO2的平衡转化率为50%,则反应(I)的平衡常数小于1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】化学就在身边,下列说法中正确的是
| A.开启啤酒瓶后,瓶中马上泛起大量泡沫,此现象无法用勒夏特列原理解释 |
| B.将水坝中的钢闸门连通电源的负极对其进行保护,其原理为牺牲阳极的阴极保护法 |
| C.银锡子佩戴时间长了会发黑,将其放在盛有食盐水的铝制易拉罐(打磨后)中,可使其光亮如新 |
D.钢铁发生吸氧腐蚀时负极发生的反应为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列有关说法正确的是
| A.为防止铁质闸门在水中被腐蚀,可以在闸门表面焊接铜块 |
| B.反应NH3(g)+HCl(g)=NH4Cl(s)常温下可自发进行,该反应为吸热反应 |
C.保持温度不变,将图中的活塞快速推至20 mL处,新平衡时气体颜色变浅 |
D.向0.1 mol·L-1 CH3COONa溶液中加入少量水,溶液中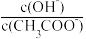 增大 增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】一定温度下,反应: 的反应热和化学平衡常数分别为∆H和K,∆H<0,下列说法正确的是
的反应热和化学平衡常数分别为∆H和K,∆H<0,下列说法正确的是
 的反应热和化学平衡常数分别为∆H和K,∆H<0,下列说法正确的是
的反应热和化学平衡常数分别为∆H和K,∆H<0,下列说法正确的是| A.升高温度,K增大 |
B.2molSO2和1molO2反应放出热量 |
C.其他条件不变,增大 的量,∆H和K均增大 的量,∆H和K均增大 |
D.相同温度时反应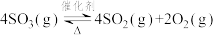 的反应热和化学平衡常数为-2∆H和 的反应热和化学平衡常数为-2∆H和 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
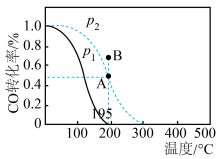
【推荐2】在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如下表所示。下列说法正确的是( )
p2和195 ℃时n(H2)

p2和195 ℃时n(H2)
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
A.p2和195 ℃时,0~3 min,反应速率v(CH3OH)= mol·L-1·min-1 mol·L-1·min-1 |
| B.p1<p2,ΔH>0 |
| C.195 ℃、p2时,在B点:v正>v逆 |
| D.在p2和195 ℃时,该反应的平衡常数为25 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】700℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2,发生如下反应:CO(g)+2H2(g) CH3OH(g),反应过程中测定的部分数据见下表:
CH3OH(g),反应过程中测定的部分数据见下表:
下列说法正确的是
 CH3OH(g),反应过程中测定的部分数据见下表:
CH3OH(g),反应过程中测定的部分数据见下表:| 反应时间/min | n(CO)/mol | n(H2)/ mol |
| 0 | 0.60 | 1.20 |
| 20 | 0.20 | |
| 30 | 0.40 |
| A.反应在20 min内的平均速率为v(H2)=0.04 mol·L-1·min-1 |
| B.若其他条件不变,升高温度,平衡时c(CH3OH)= 0.15 mol·L-1,则反应的ΔH>0 |
| C.保持其他条件不变,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,达到新平衡前v(正)> v(逆) |
| D.相同温度下,若起始时向容器中充入1.0molCH3OH,达到平衡时CH3OH转化率大于1/3 |
您最近一年使用:0次



