常温下,浓度均为 0.1 mol·L-1 的盐酸和醋酸,下列说法正确的是
| A.两种溶液的 pH:盐酸大于醋酸 |
| B.用相同浓度的 NaOH 溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的 NaOH溶液体积多 |
C.向醋酸中加入等物质的量的 NaOH,溶液呈碱性,且溶液中  |
| D.两种溶液中水电离出的氢离子:盐酸大于醋酸 |
19-20高三上·浙江台州·阶段练习 查看更多[3]
更新时间:2018-11-09 23:05:35
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】25℃时,用0.1mol•L-1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)= ]如图所示:
]如图所示:

下列说法错误的是
 ]如图所示:
]如图所示:
下列说法错误的是
| A.用NaOH溶液滴定0.1mol•L-1NaHA溶液可用酚酞作指示剂 |
| B.0.1mol•L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-) |
| C.0.1mol•L-1Na2A溶液中:c(Na+)>c(HA-)+2c(A2-) |
| D.H2A的Ka2=1×10-7 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列事实中,能说明HA是弱酸的是
| A.0.10 mol·L-1 HA溶液能使紫色石蕊试液变红 |
| B.0.10 mol·L-1 HA溶液能与鸡蛋壳反应生成CO2气体 |
| C.0.10 mol·L-1 NH4Cl呈酸性,0.10 mol·L-1 NH4A溶液呈中性 |
| D.等体积的0.10 mol·L-1HA溶液与0.10 mol·L-1NaOH溶液恰好完全反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】水体中重金属铅的污染问题备受关注。溶液中Pb2+及其与OH-形成的微粒的浓度分数 随溶液pH变化的关系如图所示。已知NH3•H2O的Kb=1.74×10-5,向Pb(NO3)2溶液中滴加氨水,关于该过程的说法正确的是
随溶液pH变化的关系如图所示。已知NH3•H2O的Kb=1.74×10-5,向Pb(NO3)2溶液中滴加氨水,关于该过程的说法正确的是

 随溶液pH变化的关系如图所示。已知NH3•H2O的Kb=1.74×10-5,向Pb(NO3)2溶液中滴加氨水,关于该过程的说法正确的是
随溶液pH变化的关系如图所示。已知NH3•H2O的Kb=1.74×10-5,向Pb(NO3)2溶液中滴加氨水,关于该过程的说法正确的是
| A.pb2+的浓度分数先减小后增大 |
| B.溶液中Pb2+与Pb(OH)2浓度相等时,氨主要以NH3•H2O的形式存在 |
C.pH=7时, 溶液中存在的阳离子有pb2+、 Pb(OH)+、 H+和NH |
D.随着pH增大,c[Pb(OH)+]先增大后减小,c(NO )保持不变 )保持不变 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】H2C2O4为二元弱酸,20℃时,配制一组c(H2C2O4)+c(HC2O )+c(C2O
)+c(C2O )=0.1mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
)=0.1mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

 )+c(C2O
)+c(C2O )=0.1mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
)=0.1mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O )>c(HC2O )>c(HC2O ) ) |
B.pH=7的溶液中,c(Na+)=2c(C2O ) ) |
C.c(HC2O )=c(C2O )=c(C2O )的溶液中:c(Na+)>0.1+c(HC2O )的溶液中:c(Na+)>0.1+c(HC2O ) ) |
D.c(Na+)=0.1mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列实验过程能达到目的,且现象和结论正确的是
| 选项 | 实验目的 | 实验过程 | 现象和结论 |
| A. | 探究HA酸性强弱 | 等体积pH=3 的 HA 和HB 两种酸分别与足量的锌反应 | 相同时间内,HA 收集到的氢气多, 说明 HA是强酸 |
| B. | 探究压强对化学平衡的影响 | 在一定温度下的密闭容器中发生反应: , 平衡时 A 的浓度为0.5mol/L。保持温度不变,将容器扩大到原来的2倍,再次平衡时A的浓度为 0.3mol/L。 , 平衡时 A 的浓度为0.5mol/L。保持温度不变,将容器扩大到原来的2倍,再次平衡时A的浓度为 0.3mol/L。 | 说明该反应减压时,平衡向正反应方向移动 |
| C. | 探究温度对反应速率的影响 | 两支试管分别装5mL0.2mol·L⁻¹Na2S2O3溶液和5mL0.2mol·L⁻¹H2SO4溶液的混合溶液,分别放在热水和冷水中 | 热水中先出现浑浊,说明温度越高,反应速率越快 |
| D. | 探究可逆反应的热效应 | 已知CuCl2溶液中存在下列平衡: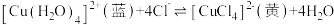 ,取一定浓度的CuCl2溶液,升高温度 ,取一定浓度的CuCl2溶液,升高温度 | 溶液由蓝色变为黄色,说明该反应ΔH<0 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列溶液中有关微粒浓度的关系不正确的是
| A.向0.2 mol/L KA溶液中加入等体积的0.1 mol/L HCl溶液,得pH=10的混合溶液:c(K+)>c(HA)>c(Cl-)>c(A-) |
| B.c1 mol/L pH=a的醋酸,c2 mol/L pH=b的醋酸,若a+1=b,则c1 >10 c2 |
| C.浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] |
| D.某二元弱酸的酸式盐NaHA溶液:c(H+)+c(H2A)=c(OH-)+c(A2-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,0.1mol•L-1H2A溶液中H2A、HA-、A2-三者所占物质的量分数(分布系数δ)随pH变化的关系如图所示,下列说法错误的是


| A.图中X、Y、Z分别代表H2A、HA-、A2- |
| B.若升高温度,a、b点移动趋势都向左 |
| C.常温下,H2A的一级电离常数Ka1=10-4.3 |
| D.NaHA溶液中存在:c(H+)+c(H2A)=c(A2-)+c(OH-) |
您最近一年使用:0次




