Ⅰ、元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、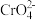 (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________ 。
(2)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的 还原成Cr3+,该反应的离子方程式为
还原成Cr3+,该反应的离子方程式为______________ 。
Ⅱ、以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
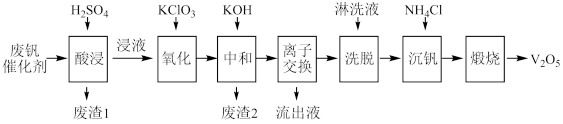
(3)“酸浸”时V2O5转化为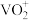 ,反应的离子方程式为
,反应的离子方程式为___________
(4)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________ 。
III、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
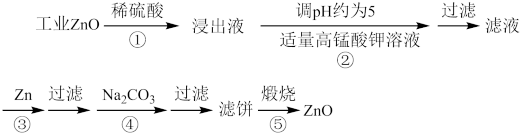
(5)在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2,回答下列问题:
反应②中发生反应的离子方程式为___________ ,___________ 。
 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、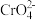 (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
(2)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的
 还原成Cr3+,该反应的离子方程式为
还原成Cr3+,该反应的离子方程式为Ⅱ、以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

(3)“酸浸”时V2O5转化为
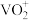 ,反应的离子方程式为
,反应的离子方程式为(4)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式
III、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:

(5)在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2,回答下列问题:
反应②中发生反应的离子方程式为
更新时间:2019-01-07 18:06:21
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】非金属元素及其化合物在生活、生产中有着重要的用途
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的最外层电子排布式为___________ ,已知3种原子晶体的熔点数据如下表:
金刚石熔点比晶体硅熔点高的原因是___________ 。
(2)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g) CS2(g)+2H2S(g),CS2分子的空间构型为
CS2(g)+2H2S(g),CS2分子的空间构型为___________ ,用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单质硫,可实现废物利用,保护环境,写出其中一个反应的化学方程式___________ 。
(3)中国传统的农具、兵器曾大量使用铁,铁器的修复是文物保护的重要课题。铁器表面氧化层的成分有多种,性质如下:
在有氧条件下,Fe3O4在含Cl–溶液中会转化为FeOCl,将相关反应的离子方程式补充完整___________ ,4Fe3O4 +_____O2 +______ +_____H2O _____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为
_____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为___________ 。
(4)化学修复可以使FeOCl转化为Fe3O4致密保护层:用Na2SO3和NaOH混合溶液浸泡锈蚀的铁器,一段时间后取出,再用NaOH溶液反复洗涤。
①FeOCl在NaOH的作用下转变为FeO(OH),推测溶解度FeOCl___________ FeO(OH)(填“>”或“<”)。
② Na2SO3的作用是___________ 。
③ 检验FeOCl转化完全的操作和现象是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的最外层电子排布式为
| 金刚石 | 碳化硅 | 晶体硅 | |
| 熔点/℃ | >3550 | 2600 | 1415 |
金刚石熔点比晶体硅熔点高的原因是
(2)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g)
 CS2(g)+2H2S(g),CS2分子的空间构型为
CS2(g)+2H2S(g),CS2分子的空间构型为(3)中国传统的农具、兵器曾大量使用铁,铁器的修复是文物保护的重要课题。铁器表面氧化层的成分有多种,性质如下:
| 成分 | Fe3O4 | FeO(OH) | FeOCl |
| 性质 | 致密 | 疏松 | 疏松 |
在有氧条件下,Fe3O4在含Cl–溶液中会转化为FeOCl,将相关反应的离子方程式补充完整
 _____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为
_____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为(4)化学修复可以使FeOCl转化为Fe3O4致密保护层:用Na2SO3和NaOH混合溶液浸泡锈蚀的铁器,一段时间后取出,再用NaOH溶液反复洗涤。
①FeOCl在NaOH的作用下转变为FeO(OH),推测溶解度FeOCl
② Na2SO3的作用是
③ 检验FeOCl转化完全的操作和现象是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】海洋是一个巨大的资源宝库。在海洋中生长的海带,富含碘元素。某同学设计以下实验方案,从海带中提取 。
。
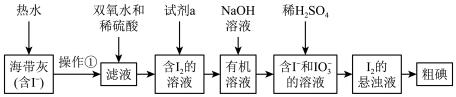
(1)灼烧海带时,需要用到的瓷质实验仪器是___________ 。
(2)如将加双氧水改为加二氧化锰也可达到实验目的,写出向滤液中加入 和稀硫酸发生反应的离子方程式:
和稀硫酸发生反应的离子方程式:___________ 。
(3)试剂a可以是___________ (填字母)。
a.乙醇 b.裂化汽油 c.四氯化碳
(4) 和
和 生成
生成 的离子方程式是
的离子方程式是___________ 。
(5)上图中,含 的溶液经3步转化为
的溶液经3步转化为 的悬浊液,其目的是
的悬浊液,其目的是___________ 。
(6)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:___________ 。
 。
。
(1)灼烧海带时,需要用到的瓷质实验仪器是
(2)如将加双氧水改为加二氧化锰也可达到实验目的,写出向滤液中加入
 和稀硫酸发生反应的离子方程式:
和稀硫酸发生反应的离子方程式:(3)试剂a可以是
a.乙醇 b.裂化汽油 c.四氯化碳
(4)
 和
和 生成
生成 的离子方程式是
的离子方程式是(5)上图中,含
 的溶液经3步转化为
的溶液经3步转化为 的悬浊液,其目的是
的悬浊液,其目的是(6)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】实验室制备硫氰化钾的实验装置如图所示(部分夹持装置已略去):
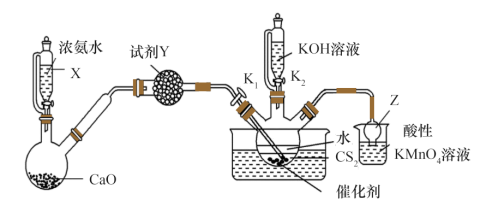
已知:NH3不溶于CS2,在一定条件下发生反应CS2+3NH3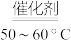 NH4SCN+NH4HS,生成物中NH4HS的热稳定性较NH4SCN差。
NH4SCN+NH4HS,生成物中NH4HS的热稳定性较NH4SCN差。
(1)仪器X的名称为___________ ;试剂Y为___________ 。
(2)在50~60℃反应一段时间后,关闭K1,保持三颈烧瓶内液温105℃一段时间,其目的是_______ ;然后打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,制得较纯净的KSCN溶液。
(3)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压加热浓缩、冷却结晶、________ 、___________ 、干燥,得到硫氰化钾晶体。
(4)仪器Z的作用为___________ ;实验过程中观察到烧杯中有淡黄色沉淀产生,该反应的离子方程式为___________ 。
(5)测定晶体中KSCN的含量:称取10.0g样品,配成1000mL溶液,量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000mol·L−1AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液的体积18.00mL,该晶体中KSCN的质量分数为___________ 。[已知:滴定时发生的反应为SCN−+Ag+=AgSCN↓(白色)]

已知:NH3不溶于CS2,在一定条件下发生反应CS2+3NH3
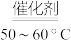 NH4SCN+NH4HS,生成物中NH4HS的热稳定性较NH4SCN差。
NH4SCN+NH4HS,生成物中NH4HS的热稳定性较NH4SCN差。(1)仪器X的名称为
(2)在50~60℃反应一段时间后,关闭K1,保持三颈烧瓶内液温105℃一段时间,其目的是
(3)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压加热浓缩、冷却结晶、
(4)仪器Z的作用为
(5)测定晶体中KSCN的含量:称取10.0g样品,配成1000mL溶液,量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000mol·L−1AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液的体积18.00mL,该晶体中KSCN的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】探究影响KMnO4与草酸(H2C2O4,二元弱酸)反应速率的因素。完成下列填空:
I.配制1.000×10-3 mol·L-1 KMnO4溶液、0.40 mol·L-1草酸溶液。
(1)用5.200×10-3 mol·L-1 KMnO4溶液配制100 mL 1.000×10-3 mol·L-1 KMnO4溶液需要的仪器有:_______ 。
II.将KMnO4溶液与草酸溶液按如下比例混合。
(2)实验①和②的目的是 _______ 。
(3)上述实验应控制pH相同,则应加入的试剂是_______ (选填选项)。
A.盐酸 B.硫酸 C.草酸
III.将溶液调至pH=1进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液变为青色溶液;
ii.青色溶液逐渐褪至无色溶液。
资料:(a)Mn2+在溶液中无色;
(b)Mn3+无色,有强氧化性,发生反应Mn3++2
 [Mn(C2O4)2]-(青绿色)后氧化性减弱;
[Mn(C2O4)2]-(青绿色)后氧化性减弱;
(c)MnO 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和MnO2。
和MnO2。
(4)推测阶段i中可能产生了MnO 。该观点是否合理,并说明理由:
。该观点是否合理,并说明理由:_______ 。
IV.为证明溶液中含有[Mn(C2O4)2]-,测得反应过程中 和[Mn(C2O4)2]-浓度随时间的变化如下图:
和[Mn(C2O4)2]-浓度随时间的变化如下图:

(5)第i阶段中检测到有CO2产生,反应的离子方程式为_______ 。
(6)实验②在第ii阶段反应速率较大,猜测是c(Mn3+)较大引起的,请解释实验②中c(Mn3+)较大的原因_______ 。
(7)据此推测,若在第ii阶段将c(H+)调节至0.2 mol·L-1,溶液褪至无色的时间会_______ (填“增加”“减少” 或“不变”)。
I.配制1.000×10-3 mol·L-1 KMnO4溶液、0.40 mol·L-1草酸溶液。
(1)用5.200×10-3 mol·L-1 KMnO4溶液配制100 mL 1.000×10-3 mol·L-1 KMnO4溶液需要的仪器有:
II.将KMnO4溶液与草酸溶液按如下比例混合。
| 序号 | V(KMnO4) / mL | V(草酸) /mL | V(H2O) /mL | 反应温度 |
| ① | 2.0 | 2.0 | 0 | 20°C |
| ② | 2.0 | 1.0 | 1.0 | 20°C |
(3)上述实验应控制pH相同,则应加入的试剂是
A.盐酸 B.硫酸 C.草酸
III.将溶液调至pH=1进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液变为青色溶液;
ii.青色溶液逐渐褪至无色溶液。
资料:(a)Mn2+在溶液中无色;
(b)Mn3+无色,有强氧化性,发生反应Mn3++2

 [Mn(C2O4)2]-(青绿色)后氧化性减弱;
[Mn(C2O4)2]-(青绿色)后氧化性减弱; (c)MnO
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和MnO2。
和MnO2。(4)推测阶段i中可能产生了MnO
 。该观点是否合理,并说明理由:
。该观点是否合理,并说明理由:IV.为证明溶液中含有[Mn(C2O4)2]-,测得反应过程中
 和[Mn(C2O4)2]-浓度随时间的变化如下图:
和[Mn(C2O4)2]-浓度随时间的变化如下图:
(5)第i阶段中检测到有CO2产生,反应的离子方程式为
(6)实验②在第ii阶段反应速率较大,猜测是c(Mn3+)较大引起的,请解释实验②中c(Mn3+)较大的原因
(7)据此推测,若在第ii阶段将c(H+)调节至0.2 mol·L-1,溶液褪至无色的时间会
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】FeOOH可用于脱硫工序,脱除效果较好。工业上利用冶金废渣(主要成分为FeSO4,还含有少量的Fe2(SO4)3、MgSO4及TiOSO4)为主要原料生产FeOOH的一种工艺流程如下:

(1)FeOOH中Fe的化合价为_______ 。
(2)冶金废渣“溶解”时一般要粉碎,目的是_______ ,TiOSO4与水反应生成难溶于水的H2TiO3和一种常见的酸,该反应的化学方程式为_______ 。
(3)“除杂”时,加入NaF溶液的作用为沉淀Mg2+,则滤液Y中的主要含有的溶质为_______ 。
(4)“氧化”时,试剂X最佳选择为_______ (填序号)。
a.KMnO4 b. HNO3 c. Cl2 d.空气
(5)工业上冶炼Fe的方法是_______ ,铝与四氧化三铁的反应方程式:_______ 。

(1)FeOOH中Fe的化合价为
(2)冶金废渣“溶解”时一般要粉碎,目的是
(3)“除杂”时,加入NaF溶液的作用为沉淀Mg2+,则滤液Y中的主要含有的溶质为
(4)“氧化”时,试剂X最佳选择为
a.KMnO4 b. HNO3 c. Cl2 d.空气
(5)工业上冶炼Fe的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】回收废旧铅蓄电池铅膏中的铅是当今环保领域的重点课题之一,某铅膏中主要含有PbSO4、PbO2、PbO及少量Fe2O3。一种利用铅膏制备Pb(OH)2的流程如下:

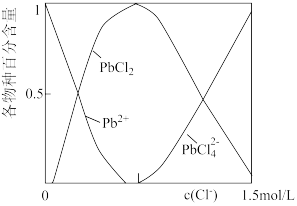
已知:①向一定浓度的Pb2+溶液中滴加氯化钠溶液,二价铅物种的分布分数与氯离子浓度的关系如图所示。
②常温下PbSO4、PbCO3、PbCl2均难溶于水,Pb(OH)2是两性氢氧化物。
(1)“还原”过程中发生氧化反应的物质是_______ (填化学式)。
(2)“脱硫”时,间隔一段时间需进行机械搅拌,其主要目的是_______ 。
(3)“浸铅”时,通过增加NaCl的量来增加溶液中Cl-的浓度,HCl的用量不宜过多的原因除了环保、经济及影响后续沉铅时氢氧化钠用量外,另一主要原因是_______ 。
(4)“沉铅”时反应的离子方程式为_______ 。沉铅时,NaOH用量不易过多的原因_______ (用化学方程式解释)。

已知:①向一定浓度的Pb2+溶液中滴加氯化钠溶液,二价铅物种的分布分数与氯离子浓度的关系如图所示。
②常温下PbSO4、PbCO3、PbCl2均难溶于水,Pb(OH)2是两性氢氧化物。

(1)“还原”过程中发生氧化反应的物质是
(2)“脱硫”时,间隔一段时间需进行机械搅拌,其主要目的是
(3)“浸铅”时,通过增加NaCl的量来增加溶液中Cl-的浓度,HCl的用量不宜过多的原因除了环保、经济及影响后续沉铅时氢氧化钠用量外,另一主要原因是
(4)“沉铅”时反应的离子方程式为
您最近一年使用:0次
【推荐1】磷锌白[Zn3(PO4)2]可用于生产无毒防锈颜料和水溶性涂料。一种利用烧铸灰(主要含ZnO,还含少量Fe3O4、PbO、SnO2、CuO及SiO2等)为原料制取磷锌白的工艺流程如下图所示:

回答下列问题:
(1)为提高“酸溶”时锌的浸出率,可采取的措施有_______ (列举1条),“滤渣1”的主要成分为_______ (填化学式)。
(2)写出“沉锰”步骤的离子方程式:_______ 。
(3)几种金属离子开始沉淀与沉淀完全的pH如下表所示:
“调pH”为4.0的目的是除去Fe3+和_______ ,为检验“过滤2”后的滤液中是否含有Fe3+,可选用的化学试剂是_______ 。
(4)“制备”时,加Na2HPO4至Zn2+恰好沉淀完全的离子方程式为_______ 。
(5)本实验采用过量的锌粉除去铜离子杂质,还可以通入H2S除铜离子,当通入H2S达到饱和时测得溶液的pH = 1,此时溶液中c(Cu2+)为_______ 。[已知:25℃,H2S溶于水形成饱和溶液时,c(H2S) = 0.1 mol/L;H2S的电离平衡常数Ka1 = 1×10−7,Ka2 = 1×10−13;Ksp(CuS) = 6×10−36]
(6)某工厂用7 t烧铸灰(氧化锌的质量分数为81%)进行上述工艺流程,最终制得Zn3(PO4)2 7.7 t,则产率为_______ (保留三位有效数字)。

回答下列问题:
(1)为提高“酸溶”时锌的浸出率,可采取的措施有
(2)写出“沉锰”步骤的离子方程式:
(3)几种金属离子开始沉淀与沉淀完全的pH如下表所示:
| 金属离子 | Sn4+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 0.5 | 2.2 | 4.8 | 6.5 |
| 沉淀完全的pH | 1.3 | 3.6 | 6.4 | 8.5 |
(4)“制备”时,加Na2HPO4至Zn2+恰好沉淀完全的离子方程式为
(5)本实验采用过量的锌粉除去铜离子杂质,还可以通入H2S除铜离子,当通入H2S达到饱和时测得溶液的pH = 1,此时溶液中c(Cu2+)为
(6)某工厂用7 t烧铸灰(氧化锌的质量分数为81%)进行上述工艺流程,最终制得Zn3(PO4)2 7.7 t,则产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
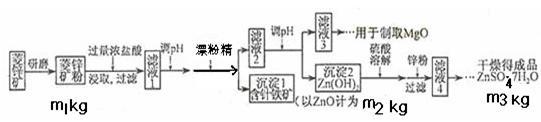
(1)将菱锌矿研磨成粉的目的是_______ ,滤液1后两步操作的目是:__________________ 。
(2)完成加漂粉精反应的离子方程式:
_____ Fe(OH)2+_____ ____ +____ _____ →_____ Fe(OH)3+______ Cl-
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是_______ 。
(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据_______________________ ,________________________ (用文字叙述)
(5)“滤液4”之后的操作依次为______ 、_______ 、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________ 。

(1)将菱锌矿研磨成粉的目的是
(2)完成加漂粉精反应的离子方程式:
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是
(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据
(5)“滤液4”之后的操作依次为
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】废弃化学品循环再利用对节约资源和保护环境有重要意义。钴盐在新能源、催化、印染等领域应用广泛。利用电解工业产生的钴、镍废渣(含Fe、Cu等)制备CoCl2·6H2O,流程如下图所示:
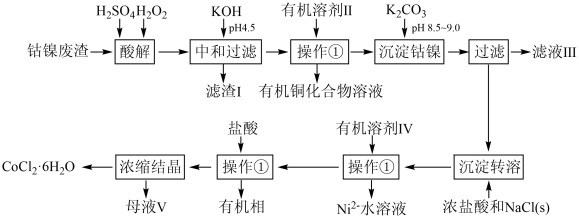
已知:通常认为溶液中离子浓度小于10-5mol·L-1为沉淀完全;室温下相关物质的Ksp见下表。
回答下列问题:
(1)基态Co原子的电子排布式为___________ 。
(2)滤渣Ⅰ的主要成分为Fe(OH)3,H2O2氧化Fe2+的离子方程式为___________ 。
(3)操作①是___________ ;滤液III对应溶质的主要成分是___________ (填化学式)。
(4)K2CO3与钴、镍离子反应的产物是氢氧化物沉淀,室温下,在pH8.5~9.0范围内Co2+___________ (填“能”或“不能”)沉淀完全,Co(OH)2易被氧化Co(OH)3,Co(OH)3可氧化浓盐酸,其化学方程式为___________ 。
(5)浓缩结晶后的母液V可返回___________ 工序循环利用。
(6)利用硫化物分离钴镍离子,向浓度同为0.1mol·L-1的Ni2+和Co2+混合溶液中逐滴加入(NH4)2S溶液(忽略溶液体积变化),首先生成硫化物沉淀的离子___________ ;当第二种离子生成硫化物沉淀时,第一种离子的浓度为___________ mol·L-1。

已知:通常认为溶液中离子浓度小于10-5mol·L-1为沉淀完全;室温下相关物质的Ksp见下表。
| 物质 | Co(OH)2 | NiS | CoS |
| Ksp | 1×10-14.2 | 1×10-18.5 | 1×10-20.4 |
回答下列问题:
(1)基态Co原子的电子排布式为
(2)滤渣Ⅰ的主要成分为Fe(OH)3,H2O2氧化Fe2+的离子方程式为
(3)操作①是
(4)K2CO3与钴、镍离子反应的产物是氢氧化物沉淀,室温下,在pH8.5~9.0范围内Co2+
(5)浓缩结晶后的母液V可返回
(6)利用硫化物分离钴镍离子,向浓度同为0.1mol·L-1的Ni2+和Co2+混合溶液中逐滴加入(NH4)2S溶液(忽略溶液体积变化),首先生成硫化物沉淀的离子
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa、C6H5COONa+HCl→C6H5COOH+NaCl,有关物质物理性质如表:
实验流程如下: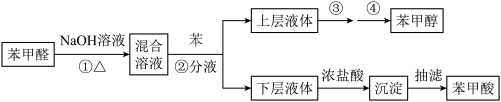
(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。若将仪器B改为仪器C,效果不如B,说明原因________ 。

(2)操作中有关分液漏斗的使用不正确的是___ 。
A.分液漏斗在使用之前必须检查是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时等下层液体放完后立即关闭旋塞,换一个烧杯再打开旋塞使上层液体流下
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集___ ℃的馏分。图2中有一处明显错误,正确的应改为_______ 。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用___ 冲洗杯壁上残留的晶体,抽滤完成后洗涤晶体。
(5)用电子天平准确称取0.244 0 g苯甲酸样品于锥形瓶中,加100 mL蒸馏水溶解(必要时可以加热),再用0.100 0 mol•L﹣1的标准NaOH溶液滴定,共消耗NaOH溶液19.20 mL,则苯甲酸样品的纯度为___ %(保留4位有效数字)。
| 苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
| 沸点/℃ | 178 | 205 | 249 | 80 |
| 熔点/℃ | 26 | ﹣15 | 12 | 5.5 |
| 苯甲酸在水中的溶解度 | ||
| 17℃ | 25℃ | 100℃ |
| 0.21 g | 0.34 g | 5.9 g |
实验流程如下:

(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。若将仪器B改为仪器C,效果不如B,说明原因

(2)操作中有关分液漏斗的使用不正确的是
A.分液漏斗在使用之前必须检查是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时等下层液体放完后立即关闭旋塞,换一个烧杯再打开旋塞使上层液体流下
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用
(5)用电子天平准确称取0.244 0 g苯甲酸样品于锥形瓶中,加100 mL蒸馏水溶解(必要时可以加热),再用0.100 0 mol•L﹣1的标准NaOH溶液滴定,共消耗NaOH溶液19.20 mL,则苯甲酸样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
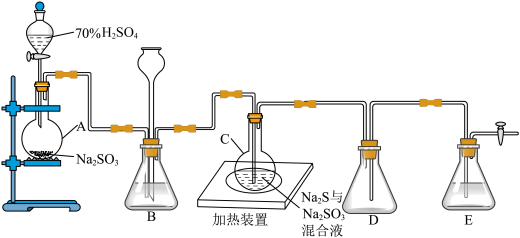
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)装置A中发生的化学反应方程式为______
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为______ 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择______
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是______ 。
(4)已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是______ ,装置E的作用为 ______
(5)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:______ 。
已知:Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↓+SO2↑+H2O,供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)
 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ) (1)装置A中发生的化学反应方程式为
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是
(4)已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是
(5)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:
已知:Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↓+SO2↑+H2O,供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】硫代硫酸钠( )可用作分析试剂及还原剂,受热、遇酸易分解。学习小组用如图装置模拟古法制硫酸,同时利用生成的
)可用作分析试剂及还原剂,受热、遇酸易分解。学习小组用如图装置模拟古法制硫酸,同时利用生成的 气体制备硫代硫酸钠(
气体制备硫代硫酸钠( )。
)。
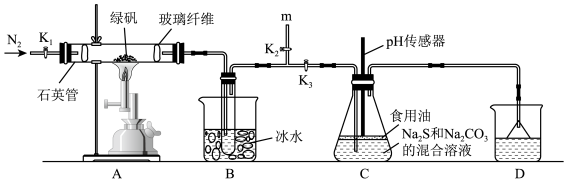
已知:
①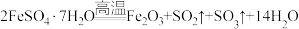 ;
;
② 的沸点为44.8℃;
的沸点为44.8℃;
③ 中S元素的化合价分别为-2价和+6价。
中S元素的化合价分别为-2价和+6价。
回答下列问题:
(1)检查装置气密性,加入药品。 和
和 混合溶液用煮沸过的蒸馏水配制,目的是
混合溶液用煮沸过的蒸馏水配制,目的是___________ ,D装置中试剂为___________ 。
(2)实验过程操作:①打开活塞 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 ;②关闭活塞
;②关闭活塞 、
、 ,打开活塞
,打开活塞 ,加热绿矾;③C处溶液pH约为8时停止加热;④在m处连接盛有NaOH溶液的容器,……;⑤从锥形瓶中得到
,加热绿矾;③C处溶液pH约为8时停止加热;④在m处连接盛有NaOH溶液的容器,……;⑤从锥形瓶中得到 晶体。使用pH传感器始终观测混合溶液pH的原因是
晶体。使用pH传感器始终观测混合溶液pH的原因是___________ ;补充完善操作④___________ 。
(3)步骤⑤中需水浴加热浓缩至液体表面出现结晶为止,使用水浴加热的原因是___________ 。
(4)学习小组探究 的性质:取
的性质:取 晶体,溶解配成0.2mol/L的溶液;取4mL溶液,向其中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊。对溶液变浑浊的原因,提出假设:
晶体,溶解配成0.2mol/L的溶液;取4mL溶液,向其中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊。对溶液变浑浊的原因,提出假设:
假设1:氯水氧化了-2价硫元素;
假设2:酸性条件下 分解产生S。
分解产生S。
实验验证:a、b试管均盛有4mL 0.2mol/L 溶液。
溶液。
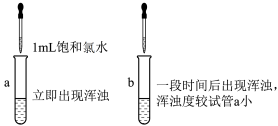
①用胶头滴管向试管b中加入的试剂为___________ 。
②依据现象,S产生的主要原因是___________ (用离子方程式表示)。
 )可用作分析试剂及还原剂,受热、遇酸易分解。学习小组用如图装置模拟古法制硫酸,同时利用生成的
)可用作分析试剂及还原剂,受热、遇酸易分解。学习小组用如图装置模拟古法制硫酸,同时利用生成的 气体制备硫代硫酸钠(
气体制备硫代硫酸钠( )。
)。
已知:
①
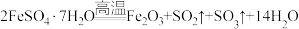 ;
;②
 的沸点为44.8℃;
的沸点为44.8℃;③
 中S元素的化合价分别为-2价和+6价。
中S元素的化合价分别为-2价和+6价。回答下列问题:
(1)检查装置气密性,加入药品。
 和
和 混合溶液用煮沸过的蒸馏水配制,目的是
混合溶液用煮沸过的蒸馏水配制,目的是(2)实验过程操作:①打开活塞
 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 ;②关闭活塞
;②关闭活塞 、
、 ,打开活塞
,打开活塞 ,加热绿矾;③C处溶液pH约为8时停止加热;④在m处连接盛有NaOH溶液的容器,……;⑤从锥形瓶中得到
,加热绿矾;③C处溶液pH约为8时停止加热;④在m处连接盛有NaOH溶液的容器,……;⑤从锥形瓶中得到 晶体。使用pH传感器始终观测混合溶液pH的原因是
晶体。使用pH传感器始终观测混合溶液pH的原因是(3)步骤⑤中需水浴加热浓缩至液体表面出现结晶为止,使用水浴加热的原因是
(4)学习小组探究
 的性质:取
的性质:取 晶体,溶解配成0.2mol/L的溶液;取4mL溶液,向其中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊。对溶液变浑浊的原因,提出假设:
晶体,溶解配成0.2mol/L的溶液;取4mL溶液,向其中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊。对溶液变浑浊的原因,提出假设:假设1:氯水氧化了-2价硫元素;
假设2:酸性条件下
 分解产生S。
分解产生S。实验验证:a、b试管均盛有4mL 0.2mol/L
 溶液。
溶液。
①用胶头滴管向试管b中加入的试剂为
②依据现象,S产生的主要原因是
您最近一年使用:0次



