某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___ 和____ 。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为________ 。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是_________
(2)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度________ (填“增大”“减小”或“不变”)。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
| 醋酸溶液浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
(2)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度
18-19高二上·吉林通化·期末 查看更多[2]
更新时间:2019-01-14 18:47:50
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】纯过氧化氢( )是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体,用途广泛。回答下列问题:
)是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体,用途广泛。回答下列问题:
(1)实验室中用过氧化氢制取氧气的化学方程式为___________ ,当生成标准状况下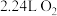 时,转移电子为
时,转移电子为___________  。
。
(2)该兴趣小组的同学查阅资料后发现 为二元弱酸,其酸性比碳酸弱。写出
为二元弱酸,其酸性比碳酸弱。写出 在水溶液中的电离方程式:
在水溶液中的电离方程式:___________ 。
(3)同学们用 的
的 标准溶液(硫酸酸化)滴定某试样中过氧化氢的含量,反应原理为
标准溶液(硫酸酸化)滴定某试样中过氧化氢的含量,反应原理为 。
。
①在该反应中, 被
被___________ (填“氧化”或“还原”)。
②用移液管吸取 试样置于锥形瓶中,重复滴定四次,每次消耗的酸性
试样置于锥形瓶中,重复滴定四次,每次消耗的酸性 标准溶液体积如下表所示:
标准溶液体积如下表所示:
则试样中过氧化氢的浓度为___________  。
。
③若滴定前尖嘴中有气泡,滴定后消失,则测定结果___________ (填“偏低”“偏高”或“不变”)。
(4)同学们发现向滴加了酚酞的 溶液中加入
溶液中加入 后,溶液中红色消失。关于褪色原因,甲同学认为
后,溶液中红色消失。关于褪色原因,甲同学认为 是二元弱酸,消耗了
是二元弱酸,消耗了 使红色消失;乙同学认为
使红色消失;乙同学认为 具有漂白性使溶液褪色(酚酞生成了其他物质)。请设计一个简单的实验方案判断甲、乙同学的说法是否正确:
具有漂白性使溶液褪色(酚酞生成了其他物质)。请设计一个简单的实验方案判断甲、乙同学的说法是否正确:___________ 。
 )是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体,用途广泛。回答下列问题:
)是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体,用途广泛。回答下列问题:(1)实验室中用过氧化氢制取氧气的化学方程式为
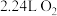 时,转移电子为
时,转移电子为 。
。(2)该兴趣小组的同学查阅资料后发现
 为二元弱酸,其酸性比碳酸弱。写出
为二元弱酸,其酸性比碳酸弱。写出 在水溶液中的电离方程式:
在水溶液中的电离方程式:(3)同学们用
 的
的 标准溶液(硫酸酸化)滴定某试样中过氧化氢的含量,反应原理为
标准溶液(硫酸酸化)滴定某试样中过氧化氢的含量,反应原理为 。
。①在该反应中,
 被
被②用移液管吸取
 试样置于锥形瓶中,重复滴定四次,每次消耗的酸性
试样置于锥形瓶中,重复滴定四次,每次消耗的酸性 标准溶液体积如下表所示:
标准溶液体积如下表所示:| 第一次 | 第二次 | 第三次 | 第四次 | |
体积( ) ) | 17.10 | 18.10 | 18.00 | 17.90 |
 。
。③若滴定前尖嘴中有气泡,滴定后消失,则测定结果
(4)同学们发现向滴加了酚酞的
 溶液中加入
溶液中加入 后,溶液中红色消失。关于褪色原因,甲同学认为
后,溶液中红色消失。关于褪色原因,甲同学认为 是二元弱酸,消耗了
是二元弱酸,消耗了 使红色消失;乙同学认为
使红色消失;乙同学认为 具有漂白性使溶液褪色(酚酞生成了其他物质)。请设计一个简单的实验方案判断甲、乙同学的说法是否正确:
具有漂白性使溶液褪色(酚酞生成了其他物质)。请设计一个简单的实验方案判断甲、乙同学的说法是否正确:
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某学习小组研究NaOH与某些酸之间的反应。
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+ OH─(aq)= H2O(l) △H =-57.3kJ·mol−1。按照图所示装置进行实验。
(1)仪器A的名称是______ 。
(2)碎泡沫塑料的作用是___________ 。
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L−1 CH3COOH溶液、50mL 0.55 mol·L−1 NaOH溶液进行实验,测得的中和热△H____ -57.3kJ·mol−1(填“>”“=”或“<”)。
Ⅱ.中和滴定
(1)用酸式滴定管量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
该盐酸的浓度约为_________ (保留两位有效数字)。滴定达到终点的标志是__________ 。
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ 。
A. 滴定终点读数时俯视读数
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E. 配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F. 碱式滴定管尖嘴部分有气泡,滴定后消失
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+ OH─(aq)= H2O(l) △H =-57.3kJ·mol−1。按照图所示装置进行实验。

(1)仪器A的名称是
(2)碎泡沫塑料的作用是
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L−1 CH3COOH溶液、50mL 0.55 mol·L−1 NaOH溶液进行实验,测得的中和热△H
Ⅱ.中和滴定
(1)用酸式滴定管量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A. 滴定终点读数时俯视读数
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E. 配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F. 碱式滴定管尖嘴部分有气泡,滴定后消失
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(C1O2)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为NaClO2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:
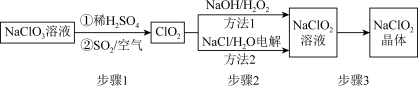
已知:I.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
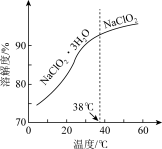
II.长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
(1)步骤1中,生成C1O2的离子方程式是______ ,通入空气的作用是_____ 。
(2)方法1中,反应的离子方程式是_____ ,利用方法1制NaClO2时,温度不能超过20℃,可能的原因是_______ 。
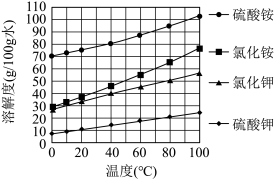
(3)NaClO2的溶解度曲线如图所示,步骤3中从NaClO2溶液中获得NaClO2的操作是______ 。
(4)为测定制得的晶体中NaClO2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmol•L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2 =2I-+
=2I-+ )。样品中NaClO2的质量分数为
)。样品中NaClO2的质量分数为______ 。(用含a、b、c的代数式表小)。在滴定操作正确无误的情况下,测得结果偏高,可能的原因是______ (用离子方程式和文字表示)。

已知:I.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
II.长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
(1)步骤1中,生成C1O2的离子方程式是
(2)方法1中,反应的离子方程式是
(3)NaClO2的溶解度曲线如图所示,步骤3中从NaClO2溶液中获得NaClO2的操作是

(4)为测定制得的晶体中NaClO2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmol•L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2
 =2I-+
=2I-+ )。样品中NaClO2的质量分数为
)。样品中NaClO2的质量分数为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】联氨(H2N—NH2,二元弱碱,无色油状液体)是一种用途广泛的化工原料,可用作火箭和燃料电池的燃料,在空气中能燃烧且产物无污染。
(1)已知:
联氨高温热分解,N2H4(l)+O2(l)=N2(g)+2H2O(g) ∆H=________ kJ∙mol-1。
(2)联氨属于________ (填“强电解质”或“弱电解质”),联氨在水中可分步电离,联氨在D2O中的第一步电离方程式为________ 。
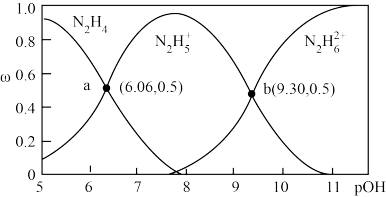
(3)常温下,向 的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数(ω)变化如图所示[
的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数(ω)变化如图所示[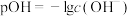 ]。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为
]。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为________ ;联氨的一级电离常数Kb1=________ 。
(4)常温下,浓度均为0.1mol∙L-1的NH3∙H2O (Kb=1.8×10-5)溶液和联氨水溶液中,c(OH-)较大的溶液是________ (填“NH3∙H2O溶液”或“联氨水溶液”,下同);均稀释至原溶液浓度的一半,稀释后溶液中c(OH-)较大的溶液是________ 。
(1)已知:
| 共价键 |  |  |  |  |  |
| 键能/( kJ∙mol-1) | 157 | 391 | 497 | 463 | 946 |
(2)联氨属于
(3)常温下,向
 的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数(ω)变化如图所示[
的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数(ω)变化如图所示[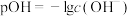 ]。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为
]。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为
(4)常温下,浓度均为0.1mol∙L-1的NH3∙H2O (Kb=1.8×10-5)溶液和联氨水溶液中,c(OH-)较大的溶液是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】近期发现, 是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是___________ (填标号)
a.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
b.常温下,氢硫酸的导电能力低于相同浓度的亚硫酸
c.常温下, 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的 分别为4.5和2.1
分别为4.5和2.1
d.氢硫酸的还原性强于亚硫酸
(2)向 的水溶液中缓慢通入
的水溶液中缓慢通入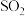 至饱和,再继续通一段时间,整个过程中
至饱和,再继续通一段时间,整个过程中 的变化情况为
的变化情况为___________
(3)常温下,向 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图(忽略溶液体积的变化及
的关系如图(忽略溶液体积的变化及 的挥发)。请计算:
的挥发)。请计算:
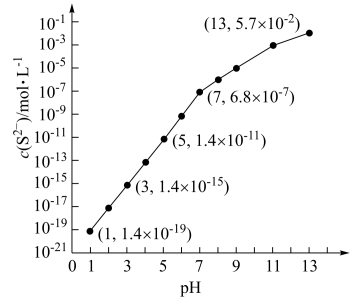
①当溶液中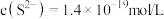 ,溶液中,水电离产生的
,溶液中,水电离产生的
___________ 
②当 时,溶液中
时,溶液中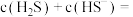
___________ 
(4)向 溶液中滴加饱和
溶液中滴加饱和 溶液,没有沉淀生成,继续滴加一定量的氨水后,生成
溶液,没有沉淀生成,继续滴加一定量的氨水后,生成 沉淀。用电离平衡原理解释上述现象
沉淀。用电离平衡原理解释上述现象___________
 是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是
a.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
b.常温下,氢硫酸的导电能力低于相同浓度的亚硫酸
c.常温下,
 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的 分别为4.5和2.1
分别为4.5和2.1d.氢硫酸的还原性强于亚硫酸
(2)向
 的水溶液中缓慢通入
的水溶液中缓慢通入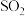 至饱和,再继续通一段时间,整个过程中
至饱和,再继续通一段时间,整个过程中 的变化情况为
的变化情况为(3)常温下,向
 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图(忽略溶液体积的变化及
的关系如图(忽略溶液体积的变化及 的挥发)。请计算:
的挥发)。请计算:
①当溶液中
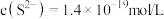 ,溶液中,水电离产生的
,溶液中,水电离产生的

②当
 时,溶液中
时,溶液中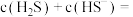

(4)向
 溶液中滴加饱和
溶液中滴加饱和 溶液,没有沉淀生成,继续滴加一定量的氨水后,生成
溶液,没有沉淀生成,继续滴加一定量的氨水后,生成 沉淀。用电离平衡原理解释上述现象
沉淀。用电离平衡原理解释上述现象
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氨是重要的基础化工原料,工业上常用于制备氨水、亚硝酸( )、连二次硝酸(
)、连二次硝酸(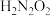 )、尿素[
)、尿素[ ]等多种含氮的化工产品。回答下列问题:
]等多种含氮的化工产品。回答下列问题:
(1)常温下,0.01 的氨水中
的氨水中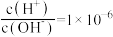 ,则该溶液的pH=
,则该溶液的pH=_______ ;将pH=4的盐酸 L与0.01
L与0.01  氨水
氨水 L混合,若混合溶液pH=7,则
L混合,若混合溶液pH=7,则
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)已知:25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
①若 和
和 两种溶液的物质的量浓度相同,则
两种溶液的物质的量浓度相同,则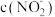
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②0.1
 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为_______ 。
(3)尿素溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是_______ 。向浓度均为0.1  的
的 和
和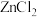 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中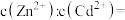
_______ 。[已知: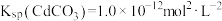 ,
,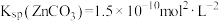 ]
]
 )、连二次硝酸(
)、连二次硝酸(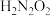 )、尿素[
)、尿素[ ]等多种含氮的化工产品。回答下列问题:
]等多种含氮的化工产品。回答下列问题:(1)常温下,0.01
 的氨水中
的氨水中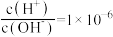 ,则该溶液的pH=
,则该溶液的pH= L与0.01
L与0.01  氨水
氨水 L混合,若混合溶液pH=7,则
L混合,若混合溶液pH=7,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)已知:25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
| 化学式 |  | 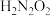 |
| 电离常数 | 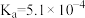 | 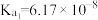 、 、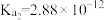 |
 和
和 两种溶液的物质的量浓度相同,则
两种溶液的物质的量浓度相同,则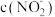
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②0.1

 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为(3)尿素溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是
 的
的 和
和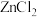 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中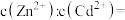
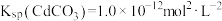 ,
,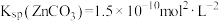 ]
]
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I.工业上采用高温活性炭催化CO与C12合成光气(COCl2))。
(1)COCl2中的原子最外层都达到8电子稳定结构,光气分子的电子式为_____ 。
(2)工业上利用天然气(CH4)与CO2进行高温重整制备CO的反应为:
CH4(g) + CO2(g)=2CO(g) + 2H2(g) ΔH=+247.3 kJ/mol。已知:C—H、C≡O、H—H键的键能依次为413 kJ·mol-1、1076 kJ·mol-1、436 kJ·mol-1,则C=O键的键能为________ kJ·mol-1。
(3)光气为窒息性毒剂,极易水解生成氯化氢,泄漏后可用水雾吸收,化学方程式为:_______ 。
II.电离平衡常数是衡量弱电解质电离程度的物理量。已知:
(1)25℃时,pH相等的下列溶液,溶液浓度大小由大到小的顺序为_______ (填字母)。
A.HCN B.HClO C.H2CO3D.CH3COOH
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式为_______ 。
(3)将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是_______ (填字母)。
A.HCN B.HClO C.H2CO3D.CH3COOH
(4)依据表格数据分析以下粒子结合质子能力的大小,并按照能力由小到大的顺序排列______ (填字母)
A.CH3COO-B. C.CN-D.
C.CN-D.
(1)COCl2中的原子最外层都达到8电子稳定结构,光气分子的电子式为
(2)工业上利用天然气(CH4)与CO2进行高温重整制备CO的反应为:
CH4(g) + CO2(g)=2CO(g) + 2H2(g) ΔH=+247.3 kJ/mol。已知:C—H、C≡O、H—H键的键能依次为413 kJ·mol-1、1076 kJ·mol-1、436 kJ·mol-1,则C=O键的键能为
(3)光气为窒息性毒剂,极易水解生成氯化氢,泄漏后可用水雾吸收,化学方程式为:
II.电离平衡常数是衡量弱电解质电离程度的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
| HClO | Ka= 3.0×10-8 |
A.HCN B.HClO C.H2CO3D.CH3COOH
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式为
(3)将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是
A.HCN B.HClO C.H2CO3D.CH3COOH
(4)依据表格数据分析以下粒子结合质子能力的大小,并按照能力由小到大的顺序排列
A.CH3COO-B.
 C.CN-D.
C.CN-D.
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
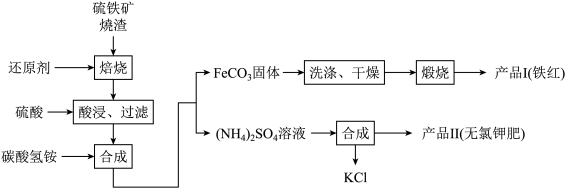
已知几种盐的溶解度随温度变化的曲线如右图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________ 。
(2)煅烧FeCO3生成产品 I的化学反应方程式为_______ 。
实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有__________ 。
(3)产品Ⅱ的化学式为_______________ ,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:________ 。
(4)检验产品Ⅱ中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,________________________________ 。

已知几种盐的溶解度随温度变化的曲线如右图所示:

回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是
(2)煅烧FeCO3生成产品 I的化学反应方程式为
实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有
(3)产品Ⅱ的化学式为
(4)检验产品Ⅱ中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钾是其常见的盐。请回答下列问题:
(1)0. 2 mol· L-1CH3COOK溶液中离子浓度由大到小的顺序为___________ 。
(2)物质的量浓度均为0.2 mol·L-1的CH3COOH和CH3COOK溶液等体积混合(混合前后忽略溶液体积变化),混合液中的下列关系式正确的是___________ (填字母)。
A. c(CH3COOH) +c(H+ )= c(CH3COO- ) +c(OH- )
B.c(H+)+c(K+ )=c(CH3COO- ) +c(OH- )
C.c(CH3COO- )+c(CH3COOH)=0.2 mol·L-1
(3)常温下0. 1 mol·L-1的CH3COOH溶液加水稀释的过程,下列表达式的数值一定变大的是______(填字母)。
(4)常温时,pH=3的醋酸溶液和pH=11的KOH溶液等体积混合后,溶液中c(K+)___________ c(CH3COO-)(填“>”“<”或“=”,下同)。
(5)常温时,将m mol· L-1的醋酸溶液和n mol·L-1的KOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是m___________ n。
(6)已知25° C时,三种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是___________ (填字 母)。
A. HCO B. CO
B. CO C. ClO- D. CH3COO-
C. ClO- D. CH3COO-
写出HClO+Na2CO3 (少量)反应离子方程式:___________ 。
(1)0. 2 mol· L-1CH3COOK溶液中离子浓度由大到小的顺序为
(2)物质的量浓度均为0.2 mol·L-1的CH3COOH和CH3COOK溶液等体积混合(混合前后忽略溶液体积变化),混合液中的下列关系式正确的是
A. c(CH3COOH) +c(H+ )= c(CH3COO- ) +c(OH- )
B.c(H+)+c(K+ )=c(CH3COO- ) +c(OH- )
C.c(CH3COO- )+c(CH3COOH)=0.2 mol·L-1
(3)常温下0. 1 mol·L-1的CH3COOH溶液加水稀释的过程,下列表达式的数值一定变大的是______(填字母)。
| A.c(H+ ) | B. |
| C.c(H+) · c(OH -) | D.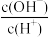 |
(5)常温时,将m mol· L-1的醋酸溶液和n mol·L-1的KOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是m
(6)已知25° C时,三种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| Ka1 | 1.8 ×10-5 | 4.3 ×10-7 | 3.0 ×10-8 |
| Ka2 | — | 5.6 ×10-11 | — |
A. HCO
 B. CO
B. CO C. ClO- D. CH3COO-
C. ClO- D. CH3COO-写出HClO+Na2CO3 (少量)反应离子方程式:
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】实验室要配制480 mL 0.2 mol/L HCl溶液,请回答下列问题:
(1)配制溶液时的步骤有:①计算 ②溶解 ③洗涤 ④(恢复室温后)移液 ⑤定容 ⑥摇匀 ⑦称量,正确的顺序是___________ 。
A. ①②③④⑤⑥⑦ B. ①⑦②④③⑤⑥ C. ①⑦②④③⑥⑤
(2)配制过程中不需要使用的化学仪器有____________ (填选项的字母)。
A. 烧杯 B. 500 mL容量瓶 C. 漏斗 D. 胶头滴管 E. 玻璃棒
(3)从所配HCl溶液中取出10 mL溶液,与原溶液相比,还会发生变化的是_________ 。
A. 溶液中HCl的物质的量 B. 溶液中HCl的物质的量浓度
C. 溶液中Cl-的数目 D. HCl的质量
(4)在配制上述溶液的过程中,下列情况对HCl溶液物质的量浓度有何影响(填“偏高”、“偏低”、或“无影响”)
①转移溶液后,未洗涤烧杯和玻璃棒就直接定容___________ 。
②容量瓶用蒸馏洗涤后残留有少量的水:___________ 。
③定容时,水未加到刻度___________ 。
(5)如果定容时加水超过容量瓶的刻度线,需要采取措施是__________ 。
(1)配制溶液时的步骤有:①计算 ②溶解 ③洗涤 ④(恢复室温后)移液 ⑤定容 ⑥摇匀 ⑦称量,正确的顺序是
A. ①②③④⑤⑥⑦ B. ①⑦②④③⑤⑥ C. ①⑦②④③⑥⑤
(2)配制过程中不需要使用的化学仪器有
A. 烧杯 B. 500 mL容量瓶 C. 漏斗 D. 胶头滴管 E. 玻璃棒
(3)从所配HCl溶液中取出10 mL溶液,与原溶液相比,还会发生变化的是
A. 溶液中HCl的物质的量 B. 溶液中HCl的物质的量浓度
C. 溶液中Cl-的数目 D. HCl的质量
(4)在配制上述溶液的过程中,下列情况对HCl溶液物质的量浓度有何影响(填“偏高”、“偏低”、或“无影响”)
①转移溶液后,未洗涤烧杯和玻璃棒就直接定容
②容量瓶用蒸馏洗涤后残留有少量的水:
③定容时,水未加到刻度
(5)如果定容时加水超过容量瓶的刻度线,需要采取措施是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】实验室配制500mL 0.2mol/L的NaOH溶液。
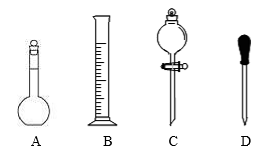
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_____________ (填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________ 、____________ 。
(2)填写下述过程中的空白;
具体步骤如下:
①计算需要称量NaOH固体的质量___________ g;
②用托盘天平称量NaOH固体;
③将称好的NaOH固体放入烧杯中,加适量蒸馏水溶解、搅拌,并_________ 至室温;
④将NaOH溶液沿玻璃棒注入____________ 中;
⑤用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
⑥将蒸馏水注入容量瓶,液面离刻度线下_______ cm时,改用____________ 滴加蒸馏水至液面于刻度线相切;
⑦盖好瓶塞,反复上下颠倒,摇匀;
(3)经精确测量,最后所得溶液物质的量浓度为0.192mol/L,原因可能是_____________
A.使用滤纸称量NaOH固体;
B.溶解NaOH后的烧杯未经多次洗涤;
C.容量瓶中原来有少量蒸馏水;
D.称量时所用的砝码生锈;
E.未冷却直接转移至容量瓶,立即配好。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是

(2)填写下述过程中的空白;
具体步骤如下:
①计算需要称量NaOH固体的质量
②用托盘天平称量NaOH固体;
③将称好的NaOH固体放入烧杯中,加适量蒸馏水溶解、搅拌,并
④将NaOH溶液沿玻璃棒注入
⑤用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
⑥将蒸馏水注入容量瓶,液面离刻度线下
⑦盖好瓶塞,反复上下颠倒,摇匀;
(3)经精确测量,最后所得溶液物质的量浓度为0.192mol/L,原因可能是
A.使用滤纸称量NaOH固体;
B.溶解NaOH后的烧杯未经多次洗涤;
C.容量瓶中原来有少量蒸馏水;
D.称量时所用的砝码生锈;
E.未冷却直接转移至容量瓶,立即配好。
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】为了测定某未知NaOH溶液的浓度,需要0.200mol·L-1的盐酸溶液500mL。某学生用实验室中常用的36.5%(密度为1.20g·cm-3)的浓盐酸配制所需稀盐酸,并设计了以下步骤完成实验。
⑴请你帮助该同学完成以下各步中的内容,并将其所设计的实验步骤正确排序。
A.用_____ (从以下备选仪器中选取适当仪器,将其序号填入空格中)量取36.5%(密度为1.20g·cm-3)的浓盐酸________ mL。a.50mL量筒; b.10mL量筒; c.托盘天平。
B.将取好的浓盐酸在烧杯中加适量蒸馏水稀释。
C.轻轻振荡后继续加蒸馏水到液面距离仪器刻线1~2cm处。
D.等溶液恢复至室温。
E.将溶液用玻璃棒引流转入______________________ (填写所需仪器)中,再用适量蒸馏水洗涤烧杯和玻璃棒2~3次一并转入其中。
F.用胶头滴管加蒸馏水直到溶液液面恰好与刻线相切,塞好瓶塞摇匀即可。
以上各实验步骤的正确排列顺序是___________________________________ 。
⑵准确移取20.00mL待测NaOH溶液于锥形瓶中,用所配标准盐酸溶液进行滴定(以酚酞为指示剂)。滴定结果如下表:据此计算未知NaOH溶液的物质的量浓度为____ mol·L-1(精确到0.01)。
⑶下列操作或叙述正确的是_____ (填写序号)。
A.滴定过程中,眼睛注视滴定管内溶液并使视线与液面的凹面水平。
B.滴定过程中由于摇动锥形瓶使少许溶液溅起沾在瓶内壁,为使测定结果正确,可用少许蒸馏水将其冲入锥形瓶内的溶液中。
C.容量瓶和滴定管在使用前洗净后都要检查是否漏液。
D.向锥形瓶中移取NaOH溶液前,用少许NaOH溶液润洗锥形瓶2~3次。
⑷下列操作或现象会导致测定结果偏高的是_____________________ (填写序号)。
A.滴定过程中不小心将一滴溶液滴在锥形瓶外;
B.滴定结束时,发现在滴定管尖嘴处有小气泡;
C.滴定结束后仰视滴定管液面读数;
D.溶液褪色立即读数,摇动锥形瓶后看到溶液红色复出;
E.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,直接加入标准液进行滴定。
⑴请你帮助该同学完成以下各步中的内容,并将其所设计的实验步骤正确排序。
A.用
B.将取好的浓盐酸在烧杯中加适量蒸馏水稀释。
C.轻轻振荡后继续加蒸馏水到液面距离仪器刻线1~2cm处。
D.等溶液恢复至室温。
E.将溶液用玻璃棒引流转入
F.用胶头滴管加蒸馏水直到溶液液面恰好与刻线相切,塞好瓶塞摇匀即可。
以上各实验步骤的正确排列顺序是
⑵准确移取20.00mL待测NaOH溶液于锥形瓶中,用所配标准盐酸溶液进行滴定(以酚酞为指示剂)。滴定结果如下表:据此计算未知NaOH溶液的物质的量浓度为
| 实验序号 | 滴定管液面起始读数 | 滴定管液面终点读数 |
| 1 | 1.32mL | 23.36mL |
| 2 | 2.26mL | 24.22mL |
A.滴定过程中,眼睛注视滴定管内溶液并使视线与液面的凹面水平。
B.滴定过程中由于摇动锥形瓶使少许溶液溅起沾在瓶内壁,为使测定结果正确,可用少许蒸馏水将其冲入锥形瓶内的溶液中。
C.容量瓶和滴定管在使用前洗净后都要检查是否漏液。
D.向锥形瓶中移取NaOH溶液前,用少许NaOH溶液润洗锥形瓶2~3次。
⑷下列操作或现象会导致测定结果偏高的是
A.滴定过程中不小心将一滴溶液滴在锥形瓶外;
B.滴定结束时,发现在滴定管尖嘴处有小气泡;
C.滴定结束后仰视滴定管液面读数;
D.溶液褪色立即读数,摇动锥形瓶后看到溶液红色复出;
E.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,直接加入标准液进行滴定。
您最近半年使用:0次



