醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钾是其常见的盐。请回答下列问题:
(1)0. 2 mol· L-1CH3COOK溶液中离子浓度由大到小的顺序为___________ 。
(2)物质的量浓度均为0.2 mol·L-1的CH3COOH和CH3COOK溶液等体积混合(混合前后忽略溶液体积变化),混合液中的下列关系式正确的是___________ (填字母)。
A. c(CH3COOH) +c(H+ )= c(CH3COO- ) +c(OH- )
B.c(H+)+c(K+ )=c(CH3COO- ) +c(OH- )
C.c(CH3COO- )+c(CH3COOH)=0.2 mol·L-1
(3)常温下0. 1 mol·L-1的CH3COOH溶液加水稀释的过程,下列表达式的数值一定变大的是______(填字母)。
(4)常温时,pH=3的醋酸溶液和pH=11的KOH溶液等体积混合后,溶液中c(K+)___________ c(CH3COO-)(填“>”“<”或“=”,下同)。
(5)常温时,将m mol· L-1的醋酸溶液和n mol·L-1的KOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是m___________ n。
(6)已知25° C时,三种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是___________ (填字 母)。
A. HCO B. CO
B. CO C. ClO- D. CH3COO-
C. ClO- D. CH3COO-
写出HClO+Na2CO3 (少量)反应离子方程式:___________ 。
(1)0. 2 mol· L-1CH3COOK溶液中离子浓度由大到小的顺序为
(2)物质的量浓度均为0.2 mol·L-1的CH3COOH和CH3COOK溶液等体积混合(混合前后忽略溶液体积变化),混合液中的下列关系式正确的是
A. c(CH3COOH) +c(H+ )= c(CH3COO- ) +c(OH- )
B.c(H+)+c(K+ )=c(CH3COO- ) +c(OH- )
C.c(CH3COO- )+c(CH3COOH)=0.2 mol·L-1
(3)常温下0. 1 mol·L-1的CH3COOH溶液加水稀释的过程,下列表达式的数值一定变大的是______(填字母)。
| A.c(H+ ) | B. |
| C.c(H+) · c(OH -) | D.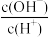 |
(5)常温时,将m mol· L-1的醋酸溶液和n mol·L-1的KOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是m
(6)已知25° C时,三种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| Ka1 | 1.8 ×10-5 | 4.3 ×10-7 | 3.0 ×10-8 |
| Ka2 | — | 5.6 ×10-11 | — |
A. HCO
 B. CO
B. CO C. ClO- D. CH3COO-
C. ClO- D. CH3COO-写出HClO+Na2CO3 (少量)反应离子方程式:
更新时间:2022-01-13 17:21:29
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】碳是一种极其重要的元素,工业上,生活中到处可见。2020年9月,习近平总书记在联合国大会上作出“努力争取2030年前实现碳达峰,2060年前实现碳中和”的承诺。碳达峰是指全球或一个地区的二氧化碳排放总量,在某一时间点达到历史最高点,即碳峰值。
碳中和是指将人类经济社会活动所必需的碳排放,通过植树造林和其他人工技术或工程加以捕集利用或封存,从而使排放到大气中的二氧化碳净增量为零。
近期,中国科学院天津工业生物技术研究所在淀粉人工合成方面取得重大突破性进展,国际上首次实现了二氧化碳和水到淀粉(C6H10O5)n的从头合成。相关工作于2021年9月24日发表于国际学术期刊《科学》,实现 “从0到1”的突破。
(1)减少碳排放的方法有很多,CO2转化成有机物的以下4例可有效实现碳循环。
a. 6CO2+6H2O C6H12O6 b.CO2+3H2
C6H12O6 b.CO2+3H2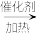 CH3OH十H2O
CH3OH十H2O
c.CO2+CH4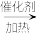 C6H12COOH d.2CO2+6H2
C6H12COOH d.2CO2+6H2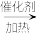 CH2=CH2+ 4H2O
CH2=CH2+ 4H2O
以上反应中,最节能的是___________ ,原子利用率最高的是___________ 。(填编号)
(2)虽然光合作用合成淀粉的表达式看起来很简单,但如果仔细探索其中的过程,会发现其反应非常复杂,需要60多个步骤。而我国科学家,不用生物细胞,单纯用工业的方式实现了二氧化碳到淀粉的合成。并且,大大缩短了自然光合作用的步骤,设计出一条只有11个步骤的“捷径”。请你设计简单实验证明第十一个步骤已经成功完成___________ 。
第一个步骤是把二氧化碳还原为甲醇(CH3OH),该方法的化学方程式是: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ∆H=-49.0 kJ;某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
CH3OH(g) + H2O(g) ∆H=-49.0 kJ;某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:

(3)该反应平衡常数表达式K=_____ ,该反应在0~3 min内H2的平均反应速率是_____ molL-1•min-1)(保留3位有效数字);a点、b点、c点反应速率最大的是______ (选“a” “b” 或“c”)并解释原因_____ 。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是___________ ,曲线Ⅱ改变的条件可能是_______ 。
(5)金属钠既可以与水反应又可以与甲醇反应,_____ (填“水”、或“甲醇”)与钠反应速率更剧烈。在温度t℃下,某NaOH的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,t_____ 25℃(填“大于”、“小于”或“等于”)。向该溶液中逐滴加入pH=x的盐酸(t℃),测得混合溶液的部分pH如表所示。
假设溶液混合前后的体积变化忽略不计,则x为___________
碳中和是指将人类经济社会活动所必需的碳排放,通过植树造林和其他人工技术或工程加以捕集利用或封存,从而使排放到大气中的二氧化碳净增量为零。
近期,中国科学院天津工业生物技术研究所在淀粉人工合成方面取得重大突破性进展,国际上首次实现了二氧化碳和水到淀粉(C6H10O5)n的从头合成。相关工作于2021年9月24日发表于国际学术期刊《科学》,实现 “从0到1”的突破。
(1)减少碳排放的方法有很多,CO2转化成有机物的以下4例可有效实现碳循环。
a. 6CO2+6H2O
 C6H12O6 b.CO2+3H2
C6H12O6 b.CO2+3H2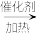 CH3OH十H2O
CH3OH十H2Oc.CO2+CH4
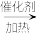 C6H12COOH d.2CO2+6H2
C6H12COOH d.2CO2+6H2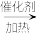 CH2=CH2+ 4H2O
CH2=CH2+ 4H2O以上反应中,最节能的是
(2)虽然光合作用合成淀粉的表达式看起来很简单,但如果仔细探索其中的过程,会发现其反应非常复杂,需要60多个步骤。而我国科学家,不用生物细胞,单纯用工业的方式实现了二氧化碳到淀粉的合成。并且,大大缩短了自然光合作用的步骤,设计出一条只有11个步骤的“捷径”。请你设计简单实验证明第十一个步骤已经成功完成
第一个步骤是把二氧化碳还原为甲醇(CH3OH),该方法的化学方程式是: CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ∆H=-49.0 kJ;某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
CH3OH(g) + H2O(g) ∆H=-49.0 kJ;某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题: 
(3)该反应平衡常数表达式K=
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
(5)金属钠既可以与水反应又可以与甲醇反应,
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则x为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】 、
、 是中学化学中常见的弱酸,请回答下列问题:
是中学化学中常见的弱酸,请回答下列问题:
(1)常温下,下列叙述能证明 为弱酸是
为弱酸是___________ 。
a. 溶液的pH大于7;
溶液的pH大于7;
b.相同体积相同浓度的盐酸和醋酸溶液,分别与足量锌粉反应,放出相同体积的氢气;
c.相同体积、相同pH的盐酸和醋酸,醋酸中和NaOH的物质的量多;
d.0.01mol/L的 溶液,pH>2
溶液,pH>2
(2)常温下,向0.1
 溶液中加蒸馏水稀释,稀释后,下列各量增大的是
溶液中加蒸馏水稀释,稀释后,下列各量增大的是___________ :
a. b.
b. c.
c.
(3)将浓度均为0.1mol/L 和
和 溶液等体积混合,测得混合液中
溶液等体积混合,测得混合液中 ,则下列关系式中正确的是___________
,则下列关系式中正确的是___________
(4)若等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,溶液呈___________ (填“酸性”,“中性”或“碱性”),原因是___________ (用离子方程式表示)。若将pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈___________ (填“酸性”,“中性”或“碱性”),溶液中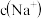
___________ 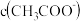 (填“>”或“=”或“<”)。
(填“>”或“=”或“<”)。
(5)25℃时, 的电离常数
的电离常数 ,
, ,则该温度下
,则该温度下 的水解平衡常数
的水解平衡常数
___________ mol/L。
Ⅱ.常温下,将NaOH溶液滴加到亚磷酸( )溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则:
)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则:

(6)表示 的是曲线
的是曲线___________ (填“Ⅰ”或“Ⅱ”);
(7)亚磷酸( )的
)的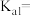
___________  。
。
 、
、 是中学化学中常见的弱酸,请回答下列问题:
是中学化学中常见的弱酸,请回答下列问题:(1)常温下,下列叙述能证明
 为弱酸是
为弱酸是a.
 溶液的pH大于7;
溶液的pH大于7;b.相同体积相同浓度的盐酸和醋酸溶液,分别与足量锌粉反应,放出相同体积的氢气;
c.相同体积、相同pH的盐酸和醋酸,醋酸中和NaOH的物质的量多;
d.0.01mol/L的
 溶液,pH>2
溶液,pH>2(2)常温下,向0.1

 溶液中加蒸馏水稀释,稀释后,下列各量增大的是
溶液中加蒸馏水稀释,稀释后,下列各量增大的是a.
 b.
b. c.
c.
(3)将浓度均为0.1mol/L
 和
和 溶液等体积混合,测得混合液中
溶液等体积混合,测得混合液中 ,则下列关系式中正确的是___________
,则下列关系式中正确的是___________A. | B. |
C. | D. |
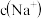
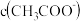 (填“>”或“=”或“<”)。
(填“>”或“=”或“<”)。(5)25℃时,
 的电离常数
的电离常数 ,
, ,则该温度下
,则该温度下 的水解平衡常数
的水解平衡常数
Ⅱ.常温下,将NaOH溶液滴加到亚磷酸(
 )溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则:
)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则:
(6)表示
 的是曲线
的是曲线(7)亚磷酸(
 )的
)的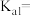
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】以下是生产、生活中常见的化学物质:①冰醋酸② ③
③ ④盐酸⑤
④盐酸⑤ ⑥熔融
⑥熔融 ⑦石墨⑧酒精⑨
⑦石墨⑧酒精⑨ ⑩
⑩ 。按要求回答下列问题:
。按要求回答下列问题:
(1)能导电的有___________ ,属于强电解质的有___________ (用序号填空)。
(2)等体积等 的醋酸和盐酸
的醋酸和盐酸
①与足量大理石反应,生成气体的物质的量:醋酸___________ 盐酸(填>、<或=);
②加水稀释醋酸的过程中,随着水量的增加而增大的是___________ (填字母)。
A. B.
B. C.
C.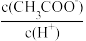 D.
D.
(3)在常温下, 的
的 溶液中由水电离出的
溶液中由水电离出的 浓度为
浓度为___________  ;在常温下,将
;在常温下,将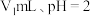 的盐酸
的盐酸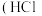 )溶液与
)溶液与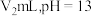 的
的 溶液充分混合后
溶液充分混合后 ,则
,则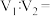
___________ 。
(4)常温下,向 溶液中逐滴滴加
溶液中逐滴滴加 溶液,溶液中的H2C2O4、HC2O
溶液,溶液中的H2C2O4、HC2O 、C2O
、C2O 的物质的量分数
的物质的量分数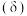 与
与 的关系如下图所示(δ(C2O
的关系如下图所示(δ(C2O )=
)=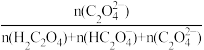 )。
)。
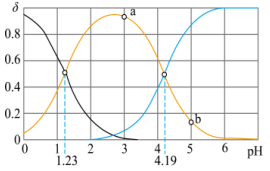
已知 ,向等体积、等浓度的
,向等体积、等浓度的 和
和 溶液中分别加水稀释至相同
溶液中分别加水稀释至相同 ,加入水的体积CH3COOH
,加入水的体积CH3COOH___________ H2C2O4(填>、<或=)。
 ③
③ ④盐酸⑤
④盐酸⑤ ⑥熔融
⑥熔融 ⑦石墨⑧酒精⑨
⑦石墨⑧酒精⑨ ⑩
⑩ 。按要求回答下列问题:
。按要求回答下列问题:(1)能导电的有
(2)等体积等
 的醋酸和盐酸
的醋酸和盐酸①与足量大理石反应,生成气体的物质的量:醋酸
②加水稀释醋酸的过程中,随着水量的增加而增大的是
A.
 B.
B. C.
C.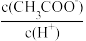 D.
D.
(3)在常温下,
 的
的 溶液中由水电离出的
溶液中由水电离出的 浓度为
浓度为 ;在常温下,将
;在常温下,将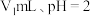 的盐酸
的盐酸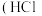 )溶液与
)溶液与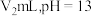 的
的 溶液充分混合后
溶液充分混合后 ,则
,则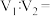
(4)常温下,向
 溶液中逐滴滴加
溶液中逐滴滴加 溶液,溶液中的H2C2O4、HC2O
溶液,溶液中的H2C2O4、HC2O 、C2O
、C2O 的物质的量分数
的物质的量分数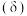 与
与 的关系如下图所示(δ(C2O
的关系如下图所示(δ(C2O )=
)=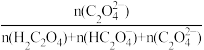 )。
)。
已知
 ,向等体积、等浓度的
,向等体积、等浓度的 和
和 溶液中分别加水稀释至相同
溶液中分别加水稀释至相同 ,加入水的体积CH3COOH
,加入水的体积CH3COOH
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】以下是生产、生活中常见的化学物质:①冰醋酸② ③
③ ④盐酸⑤
④盐酸⑤ ⑥熔融
⑥熔融 ⑦石墨⑧酒精⑨
⑦石墨⑧酒精⑨ ⑩
⑩ 。按要求回答下列问题:
。按要求回答下列问题:
(1)能导电的有___________ ,属于强电解质的有___________ (用序号填空)。
(2)等体积等 的醋酸和盐酸
的醋酸和盐酸
①与足量大理石反应,生成气体的物质的量:醋酸___________ 盐酸(填>、<或=);
②加水稀释醋酸的过程中,随着水量的增加而增大的是___________ (填字母)。
A. B.
B. C.
C.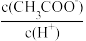 D.
D.
(3)在常温下, 的
的 溶液中由水电离出的
溶液中由水电离出的 浓度为
浓度为___________  ;在常温下,将
;在常温下,将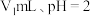 的盐酸
的盐酸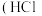 )溶液与
)溶液与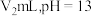 的
的 溶液充分混合后
溶液充分混合后 ,则
,则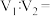
___________ 。
(4)常温下,向 溶液中逐滴滴加
溶液中逐滴滴加 溶液,溶液中的H2C2O4、HC2O
溶液,溶液中的H2C2O4、HC2O 、C2O
、C2O 的物质的量分数
的物质的量分数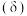 与
与 的关系如下图所示(δ(C2O
的关系如下图所示(δ(C2O )=
)=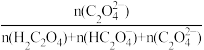 )。
)。

已知 ,向等体积、等浓度的
,向等体积、等浓度的 和
和 溶液中分别加水稀释至相同
溶液中分别加水稀释至相同 ,加入水的体积CH3COOH
,加入水的体积CH3COOH___________ H2C2O4(填>、<或=)。
 ③
③ ④盐酸⑤
④盐酸⑤ ⑥熔融
⑥熔融 ⑦石墨⑧酒精⑨
⑦石墨⑧酒精⑨ ⑩
⑩ 。按要求回答下列问题:
。按要求回答下列问题:(1)能导电的有
(2)等体积等
 的醋酸和盐酸
的醋酸和盐酸①与足量大理石反应,生成气体的物质的量:醋酸
②加水稀释醋酸的过程中,随着水量的增加而增大的是
A.
 B.
B. C.
C.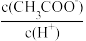 D.
D.
(3)在常温下,
 的
的 溶液中由水电离出的
溶液中由水电离出的 浓度为
浓度为 ;在常温下,将
;在常温下,将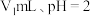 的盐酸
的盐酸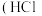 )溶液与
)溶液与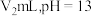 的
的 溶液充分混合后
溶液充分混合后 ,则
,则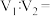
(4)常温下,向
 溶液中逐滴滴加
溶液中逐滴滴加 溶液,溶液中的H2C2O4、HC2O
溶液,溶液中的H2C2O4、HC2O 、C2O
、C2O 的物质的量分数
的物质的量分数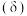 与
与 的关系如下图所示(δ(C2O
的关系如下图所示(δ(C2O )=
)=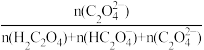 )。
)。
已知
 ,向等体积、等浓度的
,向等体积、等浓度的 和
和 溶液中分别加水稀释至相同
溶液中分别加水稀释至相同 ,加入水的体积CH3COOH
,加入水的体积CH3COOH
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色、微溶于水的配合物,是合成其他一些含钴配合物的原料。下图是某小组以含钴废料( 含少量 Fe 、Al 等杂质) 制取[Co(NH3)6]Cl3的工艺流程:

回答下列问题:
(1)写出加“适量 NaClO3”后发生反应的离子方程式_________________ 。
(2)“加Na2CO3调 pH 至 a”会生成两种沉淀,分别为________________ (填化学式)。
(3)操作Ⅰ的步骤包括________________ 、冷却结晶、减压过滤。
(4) 流程中 NH4Cl 除作反应物外, 还可防止加氨水时 c(OH- ) 过大, 其原理是_______________ 。
(5)“氧化”步骤,甲同学认为应先加入氨水再加入 H2O2,乙同学认为试剂添加顺序对产物无影响。你认 为____________ ( 填 “ 甲 ” 或 “ 乙 ”) 同学观点正确,理由是____________ 。写出该步骤的化学方程式_____________________ 。

回答下列问题:
(1)写出加“适量 NaClO3”后发生反应的离子方程式
(2)“加Na2CO3调 pH 至 a”会生成两种沉淀,分别为
(3)操作Ⅰ的步骤包括
(4) 流程中 NH4Cl 除作反应物外, 还可防止加氨水时 c(OH- ) 过大, 其原理是
(5)“氧化”步骤,甲同学认为应先加入氨水再加入 H2O2,乙同学认为试剂添加顺序对产物无影响。你认 为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】白醋的功效有多种,如能够健脾开胃、抗菌和除菌等,经常少量饮醋对人体有益。其有效成分主要为醋酸CH3COOH。
(1)配制并测定醋酸中CH3COOH的浓度。
25℃下,将少量冰醋酸加入适量蒸馏水中稀释,用0.1000 mol/L NaOH溶液滴定20.00 mL稀释的醋酸溶液。
①该实验应选用___________ 作指示剂。判断酸碱中和滴定反应到达滴定终点时的现象是___________ 。
②四次滴定消耗NaOH溶液的体积如下表:
则该醋酸中CH3COOH的浓度为___________ mol/L。
(2)误差分析。从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显少于其他三次,其原因可能是___________。
(3)探究浓度对醋酸电离平衡的影响。
①提出假设 稀释醋酸溶液,CH3COOH的电离平衡发生移动。
理论推测:以稀释10倍时浓度熵与电离平衡常数的相对大小来定量判断平衡移动的方向,其推测过程为___________ 。
②设计方案并完成实验 用0.1000 mol·L−1 CH3COOH溶液,按下表进行实验,测定pH,记录数据。
根据表中信息,补充数据:x =___________ 。
③实验分析 由实验Ⅰ和Ⅱ可知,稀释CH3COOH溶液,电离平衡___________ (填“正”或“逆”)向移动;结合表中数据,给出判断理由:___________ 。
实验结论 假设成立。
(1)配制并测定醋酸中CH3COOH的浓度。
25℃下,将少量冰醋酸加入适量蒸馏水中稀释,用0.1000 mol/L NaOH溶液滴定20.00 mL稀释的醋酸溶液。
①该实验应选用
②四次滴定消耗NaOH溶液的体积如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗NaOH溶液的体积/mL | 19.95 | 18.40 | 20.05 | 20.00 |
(2)误差分析。从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显少于其他三次,其原因可能是___________。
| A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积 |
| B.滴定前碱式滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液 |
| C.盛装醋酸溶液的滴定管用蒸馏水洗过,未用醋酸溶液润洗 |
| D.锥形瓶预先用醋酸溶液润洗过 |
①提出假设 稀释醋酸溶液,CH3COOH的电离平衡发生移动。
理论推测:以稀释10倍时浓度熵与电离平衡常数的相对大小来定量判断平衡移动的方向,其推测过程为
②设计方案并完成实验 用0.1000 mol·L−1 CH3COOH溶液,按下表进行实验,测定pH,记录数据。
| 序号 | V(醋酸溶液)/mL | V(H2O)/mL | pH |
| Ⅰ | 10.00 | 0 | 2.88 |
| Ⅱ | 1.00 | x | 3.38 |
③实验分析 由实验Ⅰ和Ⅱ可知,稀释CH3COOH溶液,电离平衡
实验结论 假设成立。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】在常温25℃下,回答下列问题:
(1) 的水解常数
的水解常数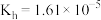 。含等物质的量浓度的
。含等物质的量浓度的 与
与 的混合溶液显
的混合溶液显________ (填“酸”“碱”或“中”)性,该溶液中各离子浓度由大到小的顺序为________________________ 。
(2) 可用氨水吸收生成
可用氨水吸收生成 ,将
,将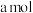
 溶于水,溶液显酸性,原因是
溶于水,溶液显酸性,原因是________________ (用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________  (
( 的电离平衡常数取
的电离平衡常数取 )。
)。
(3)向氨水中加入 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
________ (填“>”“<”或“=”)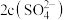 ,此时混合溶液中
,此时混合溶液中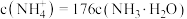 ,则
,则 的电离常数
的电离常数 为
为________ 。
氨气的催化氧化是工业制取硝酸的重要步骤,假设只会发生以下两个竞争反应Ⅰ、Ⅱ。
反应Ⅰ: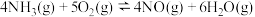

反应Ⅱ: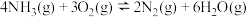

为分析某催化剂对该反应的选择性,将
 和
和
 充入2L密闭容器中,在不同温度,相同时间下,测得有关物质的量关系如图所示。
充入2L密闭容器中,在不同温度,相同时间下,测得有关物质的量关系如图所示。

(4)该催化剂在低温时对反应________ (填“Ⅰ”或“Ⅱ”)的选择性更好。
(5)高于840℃时, 的产率降低的可能原因是________。
的产率降低的可能原因是________。
(6) 也是造成水体富营养化的重要原因之一,用
也是造成水体富营养化的重要原因之一,用 溶液氧化可除去氨。为了提高氨的去除率,在实际工艺过程中温度控制在15℃~30℃时,其可能的原因是
溶液氧化可除去氨。为了提高氨的去除率,在实际工艺过程中温度控制在15℃~30℃时,其可能的原因是__________________________________ 。
(1)
 的水解常数
的水解常数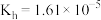 。含等物质的量浓度的
。含等物质的量浓度的 与
与 的混合溶液显
的混合溶液显(2)
 可用氨水吸收生成
可用氨水吸收生成 ,将
,将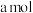
 溶于水,溶液显酸性,原因是
溶于水,溶液显酸性,原因是 (
( 的电离平衡常数取
的电离平衡常数取 )。
)。(3)向氨水中加入
 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
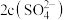 ,此时混合溶液中
,此时混合溶液中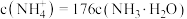 ,则
,则 的电离常数
的电离常数 为
为氨气的催化氧化是工业制取硝酸的重要步骤,假设只会发生以下两个竞争反应Ⅰ、Ⅱ。
反应Ⅰ:
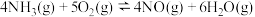

反应Ⅱ:
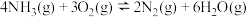

为分析某催化剂对该反应的选择性,将

 和
和
 充入2L密闭容器中,在不同温度,相同时间下,测得有关物质的量关系如图所示。
充入2L密闭容器中,在不同温度,相同时间下,测得有关物质的量关系如图所示。
(4)该催化剂在低温时对反应
(5)高于840℃时,
 的产率降低的可能原因是________。
的产率降低的可能原因是________。A. 溶于水 溶于水 | B.反应活化能增大 |
| C.反应Ⅰ的平衡常数变小 | D.催化剂活性降低 |
(6)
 也是造成水体富营养化的重要原因之一,用
也是造成水体富营养化的重要原因之一,用 溶液氧化可除去氨。为了提高氨的去除率,在实际工艺过程中温度控制在15℃~30℃时,其可能的原因是
溶液氧化可除去氨。为了提高氨的去除率,在实际工艺过程中温度控制在15℃~30℃时,其可能的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】请回答下列问题:
(1)某温度时,测得pH=11的Ba(OH)2溶液浓度是0.005 mol·L-1。
①该温度下水的离子积常数Kw=_______ 。
②在此温度下,将pH=12的Ba(OH)2溶液与pH=2的硫酸溶液等体积混合,所得混合液呈_______ 性(填“酸”,“碱”或“中”)。
(2)25 ℃时,部分物质的电离平衡常数如表所示。请回答下列问题:
①下列说法正确的是_______ 。
A.25 ℃时,向CH3COOH溶液中加入适量的NaOH溶液,CH3COOH的电离程度增大,电离平衡常数不变
B.0.1 mol·L-1 CH3COOH溶液加水稀释,稀释后的溶液中水的电离程度减小
C.0.1 mol·L-1 HClO溶液和0.1 mol·L-1 NaClO溶液等体积混合溶液呈碱性
D.碳酸氢钠溶液中阴、阳离子数目相等
②同浓度的CH3COO-、HCO 、CO
、CO 、ClO-结合H+的能力由强到弱顺序为
、ClO-结合H+的能力由强到弱顺序为_______ 。
③25 ℃时,某CH3COOH和CH3COOK混合溶液呈中性,则该混合溶液中: =
=_______ 。
(3)25 ℃时,HF的Ka=6.4×10-4 则此温度下0.1 mol·L-1 HF溶液的c(H+)为_______ mol·L-1。
(1)某温度时,测得pH=11的Ba(OH)2溶液浓度是0.005 mol·L-1。
①该温度下水的离子积常数Kw=
②在此温度下,将pH=12的Ba(OH)2溶液与pH=2的硫酸溶液等体积混合,所得混合液呈
(2)25 ℃时,部分物质的电离平衡常数如表所示。请回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
A.25 ℃时,向CH3COOH溶液中加入适量的NaOH溶液,CH3COOH的电离程度增大,电离平衡常数不变
B.0.1 mol·L-1 CH3COOH溶液加水稀释,稀释后的溶液中水的电离程度减小
C.0.1 mol·L-1 HClO溶液和0.1 mol·L-1 NaClO溶液等体积混合溶液呈碱性
D.碳酸氢钠溶液中阴、阳离子数目相等
②同浓度的CH3COO-、HCO
 、CO
、CO 、ClO-结合H+的能力由强到弱顺序为
、ClO-结合H+的能力由强到弱顺序为③25 ℃时,某CH3COOH和CH3COOK混合溶液呈中性,则该混合溶液中:
 =
=(3)25 ℃时,HF的Ka=6.4×10-4 则此温度下0.1 mol·L-1 HF溶液的c(H+)为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】硫的很多化合物有重要的作用。
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅱ)制氢气、硫黄的热化学方程式为____________ ,制得等量H2所需能量较少的是____________ 。
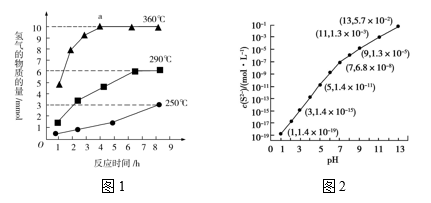
(2)硫化钠是生产硫代硫酸钠、多硫化钠、硫化染料等的原料。加热硫化钠溶液可以生成硫代硫酸钠溶液(Na2S2O3)和氢气,图1是在不同反应温度下,生成的H2产量与反应时间的关系(Na2S初始含量为3 mmol)。由图象分析可知,a点时溶液中除 外,还有
外,还有____________ (填含硫微粒的离子符号)。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L−1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2−)关系如图2所示(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS−)=____________ 。
②某溶液含0.020 mol·L−1 Mn2+、0.10 mol·L−1 H2S,当溶液pH=____________ 时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10−13]。
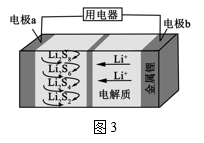
(4)全固态锂硫电池能量密度高、成本低,其工作原理如图3所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8 8Li2Sx(2≤x≤8),电池工作时,正极可发生反应为
8Li2Sx(2≤x≤8),电池工作时,正极可发生反应为____________ (写出其中电极反应式之一就可)。
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅱ)制氢气、硫黄的热化学方程式为
(2)硫化钠是生产硫代硫酸钠、多硫化钠、硫化染料等的原料。加热硫化钠溶液可以生成硫代硫酸钠溶液(Na2S2O3)和氢气,图1是在不同反应温度下,生成的H2产量与反应时间的关系(Na2S初始含量为3 mmol)。由图象分析可知,a点时溶液中除
 外,还有
外,还有
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L−1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2−)关系如图2所示(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS−)=
②某溶液含0.020 mol·L−1 Mn2+、0.10 mol·L−1 H2S,当溶液pH=
(4)全固态锂硫电池能量密度高、成本低,其工作原理如图3所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8
 8Li2Sx(2≤x≤8),电池工作时,正极可发生反应为
8Li2Sx(2≤x≤8),电池工作时,正极可发生反应为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】C元素是组成化合物种类最多的元素,含C元素的酸有也多种,其中氢氰酸(HCN)和草酸(H2C2O4)是两种比较特殊的酸。
(1)氢氰酸有剧毒,25℃时,该酸的电离常数为Ka=6.2×10-10。
①25℃时KCN溶液中CN-的水解常数Kh= =
=______ (保留一位小数)。
②0.2mol•L-1的KOH溶液与0.4mol•L-1的HCN溶液等体积混合后,恢复到25℃,混合溶液中c(K+)和c(HCN)浓度大小关系是c(K+)______ c(HCN)(填“>”、“<”或“=”)。
(2)为测定某草酸晶体产品中H2C2O4·2H2O的质量分数,称取14.00g产品溶于水,配制成500mL溶液,用浓度为0.1000mol•L-1的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表。已知2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,杂质不与高锰酸钾反应,H2C2O4·2H2O相对分子质量为126。
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,杂质不与高锰酸钾反应,H2C2O4·2H2O相对分子质量为126。
①滴定终点的现象是:当最后半滴KMnO4溶液滴入时,______ 。
②通过实验数据,计算该产品中H2C2O4·2H2O的质量分数为______ 。
③下列操作会导致测定结果偏低的是_____ 。
A.锥形瓶用待测液润洗
B.装酸性高锰酸钾溶液的滴定管没有润洗
C.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
D.滴定前平视,滴定结束时俯视
(1)氢氰酸有剧毒,25℃时,该酸的电离常数为Ka=6.2×10-10。
①25℃时KCN溶液中CN-的水解常数Kh=
 =
=②0.2mol•L-1的KOH溶液与0.4mol•L-1的HCN溶液等体积混合后,恢复到25℃,混合溶液中c(K+)和c(HCN)浓度大小关系是c(K+)
(2)为测定某草酸晶体产品中H2C2O4·2H2O的质量分数,称取14.00g产品溶于水,配制成500mL溶液,用浓度为0.1000mol•L-1的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表。已知2MnO
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,杂质不与高锰酸钾反应,H2C2O4·2H2O相对分子质量为126。
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,杂质不与高锰酸钾反应,H2C2O4·2H2O相对分子质量为126。| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 20.05 | 19.95 | 24.36 |
②通过实验数据,计算该产品中H2C2O4·2H2O的质量分数为
③下列操作会导致测定结果偏低的是
A.锥形瓶用待测液润洗
B.装酸性高锰酸钾溶液的滴定管没有润洗
C.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
D.滴定前平视,滴定结束时俯视
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
①写出H2S的Ka1的表达式:________________ 。
②常温下,浓度相同的三种溶液NaF、Na2CO3、CH3COONa,pH由大到小的顺序是___________ 。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是_______________________________ 。
(2)室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.100 mol·L-1的氨水溶液,滴定曲线如图所示。
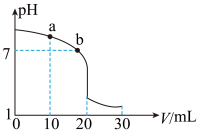
(忽略溶液体积的变化,①②填“>”“<”或“=”)
①a点所示的溶液中c (NH3·H2O)___________ c (Cl-)。
②b点所示的溶液中c (Cl-)___________ c (NH )。
)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c (H+)之比为__________ 。
(3)雌黄(As2S3)可转化为用于治疗白血病的亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH 关系如下图所示:
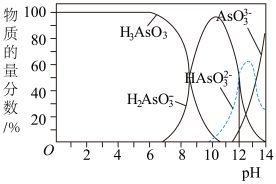
①人体血液的pH在7.35 -7.45之间,用药后人体中含砷元素的主要微粒是_________ 。
②将KOH 溶液滴入亚砷酸溶液,当pH 调至11 时发生反应的离子方程式是_________ 。
③下列说法正确的是_________ (填字母序号)
a.n(H3AsO3)∶n(H2AsO )=1∶1时,溶液显碱性
)=1∶1时,溶液显碱性
b.pH=12时,溶液中c(H2AsO )+2c(HAsO
)+2c(HAsO )+3c(AsO
)+3c(AsO )+c(OH-)=c(H+)
)+c(OH-)=c(H+)
c.在K3AsO3溶液中,c(AsO )>c(HAsO
)>c(HAsO )>c(H2AsO
)>c(H2AsO )
)
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HF | CH3COOH | H2CO3 | H2S |
| 电离平衡常数(25℃) | Ka=7.2×10-4 | Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-12 |
②常温下,浓度相同的三种溶液NaF、Na2CO3、CH3COONa,pH由大到小的顺序是
③将过量H2S通入Na2CO3溶液,反应的离子方程式是
(2)室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.100 mol·L-1的氨水溶液,滴定曲线如图所示。

(忽略溶液体积的变化,①②填“>”“<”或“=”)
①a点所示的溶液中c (NH3·H2O)
②b点所示的溶液中c (Cl-)
 )。
)。③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c (H+)之比为
(3)雌黄(As2S3)可转化为用于治疗白血病的亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH 关系如下图所示:

①人体血液的pH在7.35 -7.45之间,用药后人体中含砷元素的主要微粒是
②将KOH 溶液滴入亚砷酸溶液,当pH 调至11 时发生反应的离子方程式是
③下列说法正确的是
a.n(H3AsO3)∶n(H2AsO
 )=1∶1时,溶液显碱性
)=1∶1时,溶液显碱性b.pH=12时,溶液中c(H2AsO
 )+2c(HAsO
)+2c(HAsO )+3c(AsO
)+3c(AsO )+c(OH-)=c(H+)
)+c(OH-)=c(H+)c.在K3AsO3溶液中,c(AsO
 )>c(HAsO
)>c(HAsO )>c(H2AsO
)>c(H2AsO )
)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路、陶瓷等生产领域。工业上由氧化铝与焦炭在氮气流中高温制得:Al2O3+3C+N2 2AlN+3CO。请回答:
2AlN+3CO。请回答:
(1)上述反应中氧化剂与还原剂的物质的量之比___________________ 。
(2)制得的氮化铝产品中常含有Al4C3、Al2O3和C等杂质,已知:
为测定产品中AlN和Al4C3的含量,设计了如下两套实验装置(在通风橱进行,可适当微热,忽略空气中水蒸气、CO2的影响及NH3在强碱性溶液中的溶解)。

装置I、II在反应前后的质量差分别为m1 g和m2 g,则m g产品中AlN的质量分数为______ (用含m、m1、m2的代数式表示)。
(3)取装置I中反应后的滤液,先加入少量(NH4)2SO4溶液,然后依次进行蒸发浓缩、冷却结晶、过滤、用少量酒精洗涤、滤纸吸干,得到铵明矾晶体[NH4Al(SO4)2·12H2O]。
①蒸发浓缩操作时,除需铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒外,还需要_______ (填仪器名称);蒸发浓缩的操作;小火加热,不断搅拌,_________ 。
②用少量酒精洗涤的目的__________________________ 。
(4)已知:25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.8×10-5,Kb(Al(OH)3]=1.4×10-9。
① NH4Al(SO4)2溶液中离子浓度由大到小的顺序_________________ 。
②(NH4)2SO4溶液中存在水解平衡,则水解平衡常数为_____________ 。
 2AlN+3CO。请回答:
2AlN+3CO。请回答:(1)上述反应中氧化剂与还原剂的物质的量之比
(2)制得的氮化铝产品中常含有Al4C3、Al2O3和C等杂质,已知:
| 稀硫酸(过量) | 浓NaOH溶液(过量) | |
| AlN | 2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4 | AlN+NaOH+H2O=NaAlO2+NH3 ↑ |
| Al4C3 | Al4C3+6H2SO4=2Al2(SO4)3+3CH4 ↑ | Al4C3+4NaOH+4H2O=4NaAlO2+3CH4 ↑ |
为测定产品中AlN和Al4C3的含量,设计了如下两套实验装置(在通风橱进行,可适当微热,忽略空气中水蒸气、CO2的影响及NH3在强碱性溶液中的溶解)。

装置I、II在反应前后的质量差分别为m1 g和m2 g,则m g产品中AlN的质量分数为
(3)取装置I中反应后的滤液,先加入少量(NH4)2SO4溶液,然后依次进行蒸发浓缩、冷却结晶、过滤、用少量酒精洗涤、滤纸吸干,得到铵明矾晶体[NH4Al(SO4)2·12H2O]。
①蒸发浓缩操作时,除需铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒外,还需要
②用少量酒精洗涤的目的
(4)已知:25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.8×10-5,Kb(Al(OH)3]=1.4×10-9。
① NH4Al(SO4)2溶液中离子浓度由大到小的顺序
②(NH4)2SO4溶液中存在水解平衡,则水解平衡常数为
您最近一年使用:0次



