磷酸铁锂电池是绿色环保型电池,电池的总反应为:Li1-xFePO4+LixC6= LiFePO4+C6。
(1)LiFepO4中Fe2+的价电子排布图(轨道表达式)为___________ ,该电池反应物中涉及第二周期的元素的第一电离能由大到小的顺序是___________ (用元素符号表示)。
(2)H3PO4和H2CO3中P和C原子的杂化方式_____ (填“相同”或“不相同”)。PO43-的空间结构为___________ 。
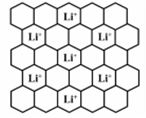
(3)石墨可用作锂离子电池的负极材料,Li+嵌入石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物。某石墨嵌入化合物的平面结构如右图所示,则x=___________ ;若每个六元环都对应一个L i+,则化学式为___________ 。
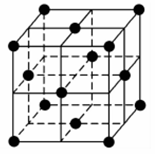
(4)某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中位置如图所示,其堆积方式为___________ ,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为___________ (用最简整数比表示)。假设晶胞边长为a nm,则两个最近的Li+的距离为___________ nm。
(1)LiFepO4中Fe2+的价电子排布图(轨道表达式)为
(2)H3PO4和H2CO3中P和C原子的杂化方式
(3)石墨可用作锂离子电池的负极材料,Li+嵌入石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物。某石墨嵌入化合物的平面结构如右图所示,则x=
(4)某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中位置如图所示,其堆积方式为
更新时间:2019-01-24 15:34:20
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】I.一些酸的酸性可以用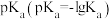 的大小来衡量,一些酸的
的大小来衡量,一些酸的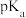 数据如下:
数据如下:
说明:乙二酸为二元羧酸,有两级电离常数。
(1)酸性:甲酸___________ 乙酸(填>、=或<)。乙酸分子中最多有___________ 个原子共平面。
(2)二氯乙酸中所含元素电负性由小到大顺序为___________ ,分子中碳原子的杂化方式为___________ 。
(3)一氟二氯乙酸分子式为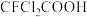 ,由表中数据可知其
,由表中数据可知其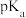 的最小范围是
的最小范围是___________ 。
(4)在乙二酸钠 溶液中加入足量氯乙酸溶液,反应的离子方程式为
溶液中加入足量氯乙酸溶液,反应的离子方程式为_____ 。
(5)用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是_____ 。
II.已知 、
、 、
、 均是工业制备电池常用的电极材料。回答下列相关问题:
均是工业制备电池常用的电极材料。回答下列相关问题:
(6)下列Li原子电子排布图表示的状态中,能量最高的为___________(填标号)。
(7)基态Co原子的核外电子排布式为_____ ;基态Co原子核外有_____ 种不同形状的电子云。
(8)科学家通过_____ 法可以得出太阳中存在较多的锂元素;第二周期元素中,第一电离能介于Li和O之间的元素有_____ (填写元素符号)
(9)通常情况下, 比FeO更稳定,原因是
比FeO更稳定,原因是_____ 。
(10)一种钙钛矿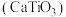 的立方晶胞结构如图,若取钛离子为晶胞顶点,则氧离子位于晶胞的
的立方晶胞结构如图,若取钛离子为晶胞顶点,则氧离子位于晶胞的_____ 位置,如果氧离子与钙离子的最短距离为b pm,阿伏加德罗常数为 ,则晶体的密度为
,则晶体的密度为_____  。
。

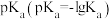 的大小来衡量,一些酸的
的大小来衡量,一些酸的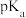 数据如下:
数据如下:| 酸 | 氯乙酸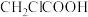 | 二氯乙酸 | 三氯乙酸 | 三氟乙酸 | 甲酸HCOOH | 乙酸 | 乙二酸 |
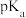 | 2.86 | 1.29 | 0.65 | 0.23 | 3.75 | 4.76 | 1.3;4.7 |
说明:乙二酸为二元羧酸,有两级电离常数。
(1)酸性:甲酸
(2)二氯乙酸中所含元素电负性由小到大顺序为
(3)一氟二氯乙酸分子式为
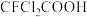 ,由表中数据可知其
,由表中数据可知其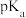 的最小范围是
的最小范围是(4)在乙二酸钠
 溶液中加入足量氯乙酸溶液,反应的离子方程式为
溶液中加入足量氯乙酸溶液,反应的离子方程式为(5)用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是
II.已知
 、
、 、
、 均是工业制备电池常用的电极材料。回答下列相关问题:
均是工业制备电池常用的电极材料。回答下列相关问题:(6)下列Li原子电子排布图表示的状态中,能量最高的为___________(填标号)。
A. | B. | C. | D. |
(8)科学家通过
(9)通常情况下,
 比FeO更稳定,原因是
比FeO更稳定,原因是(10)一种钙钛矿
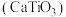 的立方晶胞结构如图,若取钛离子为晶胞顶点,则氧离子位于晶胞的
的立方晶胞结构如图,若取钛离子为晶胞顶点,则氧离子位于晶胞的 ,则晶体的密度为
,则晶体的密度为 。
。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置:_________________ ,其原子核外有______ 种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是________ (用元素符号表示)。
(2)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)__________
(3)Q与R两元素组成的分子构型可能是___________ (填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(4)元素M、Y在周期表中位于同一主族,且为短周期元素,化合物Cu2M和Cu2Y可发生如下转化(其中D是淀粉水解的最终产物): ,非金属M
,非金属M_______ Y(填“>”或“<”),请用事实说明该结论:________________________ .
(1)X在周期表中的位置:
(2)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(3)Q与R两元素组成的分子构型可能是
a.直线型 b.平面形 c.三角锥形 d.正四面体
(4)元素M、Y在周期表中位于同一主族,且为短周期元素,化合物Cu2M和Cu2Y可发生如下转化(其中D是淀粉水解的最终产物):
 ,非金属M
,非金属M
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】过渡元素在工业、农业、科学技术以及人类生活等方面有着重要作用。请回答下列问题:
(1)基态Cu原子的核外电子排布式为__ 。
(2)高密度磁记录材料纳米钴(Co)可通过亚肼(N2H2)还原氯化亚钴来制备。
①N2H2分子中氮原子的杂化形式为___ 。
②亚肼(N2H2)分子中四个原子在一个平面上,由于几何形状的不同,它有两种同分异构体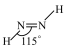 和
和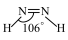 ,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是
,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是__ 。
③Co3+能与NH3和N 形成配离子[Co(N3)(NH3)5]2+,在该配离子中Co3+的配位数为
形成配离子[Co(N3)(NH3)5]2+,在该配离子中Co3+的配位数为__ ;写出与N 互为等电子体的分子:
互为等电子体的分子:___ (任写一种,填化学式);N 的空间构型是
的空间构型是__ 。
(3)FeO、NiO晶胞结构相同,晶体中r(Ni2+)和r(Fe2+)分别为69pm和78pm,则熔点:NiO___ FeO(填“>”或“<”),原因是___ ;已知NiO晶体结构中阴、阳离子的配位数均为6,则NiO晶胞的俯视图可能是__ (填字母序号)。

(4)CdS的立方晶胞结构如图所示,已知阿伏加 德罗常数的值为NA,该晶胞的晶胞参数为apm,该晶体的密度为ρg/cm-3,则Cd原子的相对原子质量的数值近似为___ (用含ρ、NA、a的代数式表示)。

(1)基态Cu原子的核外电子排布式为
(2)高密度磁记录材料纳米钴(Co)可通过亚肼(N2H2)还原氯化亚钴来制备。
①N2H2分子中氮原子的杂化形式为
②亚肼(N2H2)分子中四个原子在一个平面上,由于几何形状的不同,它有两种同分异构体
 和
和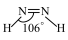 ,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是
,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是③Co3+能与NH3和N
 形成配离子[Co(N3)(NH3)5]2+,在该配离子中Co3+的配位数为
形成配离子[Co(N3)(NH3)5]2+,在该配离子中Co3+的配位数为 互为等电子体的分子:
互为等电子体的分子: 的空间构型是
的空间构型是(3)FeO、NiO晶胞结构相同,晶体中r(Ni2+)和r(Fe2+)分别为69pm和78pm,则熔点:NiO

(4)CdS的立方晶胞结构如图所示,已知阿伏加 德罗常数的值为NA,该晶胞的晶胞参数为apm,该晶体的密度为ρg/cm-3,则Cd原子的相对原子质量的数值近似为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氮族元素在化学领域具有重要的地位。请回答下列问题:
(1)基态氮原子的价层电子轨道表示式为_______ 。
(2)PH3分子的空间结构为_______ ,其中存在的共价键类型为_______ ,PH3的键角_______ (填“大于”或“小于”)NH3,原因是_______ 。
(3)雌黄的分子式为As2S3,其分子结构如图所示: ,As原子的杂化类型为
,As原子的杂化类型为_______ 。
(1)基态氮原子的价层电子轨道表示式为
(2)PH3分子的空间结构为
(3)雌黄的分子式为As2S3,其分子结构如图所示:
 ,As原子的杂化类型为
,As原子的杂化类型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】氰化钾是一种由剧毒的物质,贮存和使用时必须注意安全。已知:KCN+H2O2=KOCN+H2O,回答下列问题:
(1)OCN-中所含三种元素的第一电离能从大到小的顺序为__________ (用元素符号表示,下同),电负性从大到小的顺序为_______ ,基态氮原子外围电子排布式为______ 。
(2)H2O2中的共价键类型为__ (填“σ键”或“π键”),其中氧原子的杂化轨道类型为______ ;分子中4个原子_______ (填“在”或“不在”)同一条直线下;H2O2易溶于水除它们都是极性分子外,还因为_______ 。
(3)与OCN-键合方式相同且互为等电子体的分子为______ (任举一例);在与OCN-互为等电子体的微粒中,由一种元素组成的阴离子是_______ 。
(1)OCN-中所含三种元素的第一电离能从大到小的顺序为
(2)H2O2中的共价键类型为
(3)与OCN-键合方式相同且互为等电子体的分子为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_______ 。元素Mn与O中,第一电离能较大的是_______ ,基态原子核外未成对电子数较多的是_______ 。
(2)CO2和CH3OH分子中C原子的杂化形式分别为_______ 和_______ 。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_______
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在_______ 。
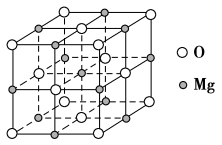
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为_______ nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为_______ nm。
(1)Co基态原子核外电子排布式为
(2)CO2和CH3OH分子中C原子的杂化形式分别为
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3,[Fe(H2NCONH2)6](NO3)3等。
(1)Fe2+基态核外电子排布式为___ 。
(2)与CN-互为等电子体的一种分子是:___ ,CN-可在TiO2作光催化剂下转化为OCN-,OCN-中三种元素的电负性由大到小的顺序为___ ,尿素(H2NCONH2)分子中C、N原子的杂化方式分别为___ 和___ 。
(3)NO3-的空间构型为___ ,1molFe(CN)63-中含有σ键的数目为___ 。
(4)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则X=___ ,已知该配合物的熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)X晶体属于___ (填晶体类型)。
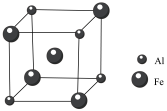
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。则这种晶胞中,离Al原子最近且距离相等的Fe原子有___ 个,该晶体的密度的计算式为:___ (不用化简,已知小立方体的边长为acm,阿伏加 德罗常数的值为NA)。
(1)Fe2+基态核外电子排布式为
(2)与CN-互为等电子体的一种分子是:
(3)NO3-的空间构型为
(4)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则X=
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。则这种晶胞中,离Al原子最近且距离相等的Fe原子有

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】Ag、 是两种重要的化工产品。某小组以含
是两种重要的化工产品。某小组以含 的废定影液为原料制备Ag和
的废定影液为原料制备Ag和 的流程如下。
的流程如下。
(1)现用15 mol⋅L 浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是
浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是____________ 。
(2)“焙烧”过程中发生反应的化学方程式为____________ 。
(3)“酸溶”中制备 的离子方程式为
的离子方程式为____________ 。
(4)粗银提取纯Ag分两步进行:第一步,用物理方法即______ 除去大量Fe粉;第二步,将含少量Fe粉的银溶于盐酸,经______ (填实验操作名称)、水洗、干燥得到纯银。
(5)“沉银1”发生的反应: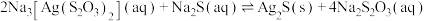 ,该反应的平衡常数
,该反应的平衡常数 为
为______ (结果保留两位有效数字)。
已知: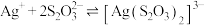 的平衡常数
的平衡常数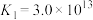 ,
,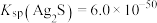 。
。
(6)利用重结晶法从“沉银1”的滤液中提取大苏打,测定大苏打纯度。称取W g产品溶于水配制成250 mL溶液,准确量取25.00 mL溶液于锥形瓶中,滴加几滴淀粉溶液,用c mol⋅L
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。已知滴定反应:
溶液V mL。已知滴定反应: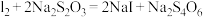 ,该产品中
,该产品中 的质量分数为
的质量分数为______ (用含c、V、W的式子表示)。三次平行实验发现,测得的产品纯度均大于实际值(实验操作均正确),其原因可能是______ 。
(7)银晶胞为面心立方最密堆积晶胞,如图所示。该晶胞中原子空间利用率为______(填标号)。(提示:原子空间利用率=原子总体积与晶胞体积之比)
 是两种重要的化工产品。某小组以含
是两种重要的化工产品。某小组以含 的废定影液为原料制备Ag和
的废定影液为原料制备Ag和 的流程如下。
的流程如下。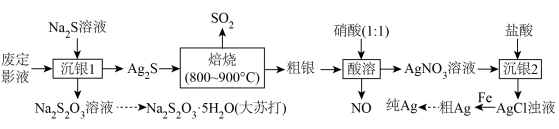
(1)现用15 mol⋅L
 浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是
浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是(2)“焙烧”过程中发生反应的化学方程式为
(3)“酸溶”中制备
 的离子方程式为
的离子方程式为(4)粗银提取纯Ag分两步进行:第一步,用物理方法即
(5)“沉银1”发生的反应:
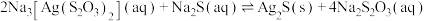 ,该反应的平衡常数
,该反应的平衡常数 为
为已知:
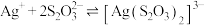 的平衡常数
的平衡常数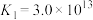 ,
,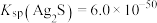 。
。(6)利用重结晶法从“沉银1”的滤液中提取大苏打,测定大苏打纯度。称取W g产品溶于水配制成250 mL溶液,准确量取25.00 mL溶液于锥形瓶中,滴加几滴淀粉溶液,用c mol⋅L

 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。已知滴定反应:
溶液V mL。已知滴定反应: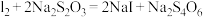 ,该产品中
,该产品中 的质量分数为
的质量分数为(7)银晶胞为面心立方最密堆积晶胞,如图所示。该晶胞中原子空间利用率为______(填标号)。(提示:原子空间利用率=原子总体积与晶胞体积之比)
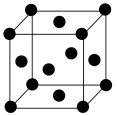
A. | B.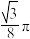 | C. | D.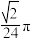 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】2022年北京冬季奥运会场馆使用了大量不锈钢材质,不锈钢属于合金钢,其基体是铁碳合金,常用的不锈钢中含铬(Cr) 18%、含镍(Ni) 8%。回答下列问题:
(1)碳的价电子层的电子排布式为_______ ;石墨烯(即单层石墨)是一种碳原子构成的单层二维蜂窝状晶格结构的新材料,其中碳原子采取_______ 杂化。
(2)铁的氯化物FeCl3蒸汽状态下以双聚分子形式存在(如图),其中Fe的配位数为_______ ,双聚分子中存在配位键,提供空轨道的是_______ 原子。

(3)甘氨酸亚铁[(H2NCH2COO)2Fe]中非金属元素的电负性由大到小的顺序是_______ 。甘氨酸(H2NCH2COOH)比其同分异构体硝基乙烷(C2H5NO2)熔沸点高,其原因主要是_______ 。
(4)FeCO3的阴离子的空间构型为_______ ,写出一种与该阴离子互为等电子体的分子的化学式_______ 。
(5)工业上常用羰基镍[Ni(CO)4]制备高纯镍,其熔点-19°C, 沸点43℃,试分析晶体中σ键与π键数目的比值为_______ ,羰基镍属于_______ 晶体。
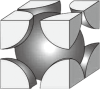
(6)金属铬属于体心立方晶体(如图),已知其密度为7.2 g/cm3,阿伏加德罗常数的值为NA,则晶体中铬原子的半径为_______ cm(用含NA的表达式表示)。
(1)碳的价电子层的电子排布式为
(2)铁的氯化物FeCl3蒸汽状态下以双聚分子形式存在(如图),其中Fe的配位数为

(3)甘氨酸亚铁[(H2NCH2COO)2Fe]中非金属元素的电负性由大到小的顺序是
(4)FeCO3的阴离子的空间构型为
(5)工业上常用羰基镍[Ni(CO)4]制备高纯镍,其熔点-19°C, 沸点43℃,试分析晶体中σ键与π键数目的比值为
(6)金属铬属于体心立方晶体(如图),已知其密度为7.2 g/cm3,阿伏加德罗常数的值为NA,则晶体中铬原子的半径为

您最近一年使用:0次



