许多含氮物质是农作物生长的营养物质。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g) 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1
③2NO2(g)⇌N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________________ 。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)⇌N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:

①a、b、c三点逆反应速率由大到小的顺序为_______ 。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡_______ 移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________ ,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________ Pa-1。
(3)已知在一定温度下的可逆反应N2O4(g)⇌2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______ k逆。升高温度,k正增大的倍数_______ (填“大于”“小于”或“等于”)k逆增大的倍数。
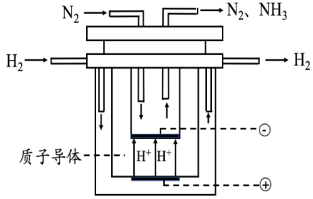
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:
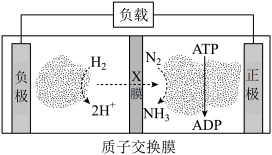
则X膜为___________ 交换膜,正极上的电极反应式为______________________ 。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g)
 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1③2NO2(g)⇌N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)⇌N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:

①a、b、c三点逆反应速率由大到小的顺序为
②a点时NO2的转化率为
(3)已知在一定温度下的可逆反应N2O4(g)⇌2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:

则X膜为
更新时间:2019-04-03 15:53:22
|
相似题推荐
【推荐1】镍在工业生产中有重要作用,以粗氧化镍(主要含NiO、CoO、Fe2O3等)为原料制备纯镍的流程示意图如下:

回答下列问题:
(1)已知C与CO的燃烧热分别为393.5 kJ·mol-1 、283.0 kJ·mol-1。则反应C(s)+CO2(g) 2CO(g)ΔH=
2CO(g)ΔH=____ kJ·mol-1,既有利于提高该反应的速率,又有利于提高CO2平衡转化率的措施是______ 。
(2)碱洗过程中发生反应的离子方程式为:______ 。
(3)羰化反应为:Ni(s)+4CO(g) Ni(CO)4(g) ΔH<0。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
Ni(CO)4(g) ΔH<0。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
①反应Ⅰ在该温度下的平衡常数K=_____ (含x的表达式表示)。
②下列不能说明反应Ⅲ达到平衡状态的是_______ 。
a 平衡常数K不再改变 b Ni的质量不再改变
c v生成[Ni(CO)4]=4 v生成(CO) d 容器内的压强不再改变
③比较平衡时下列物理量的大小: CO的体积分数Ⅰ_____ Ⅱ;Ni(CO)4的浓度Ⅰ______ Ⅲ(填 “大于”、“等于”或“小于”)。
(4)羰化后的产物为Fe(CO)5、Co2(CO)8、Ni(CO)4,有关性质如下:
蒸馏提取Ni(CO)4应选择的适宜温度范围是___________ 。
(5)采用较高温度下分解Ni(CO)4(g)制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:____________ 。

回答下列问题:
(1)已知C与CO的燃烧热分别为393.5 kJ·mol-1 、283.0 kJ·mol-1。则反应C(s)+CO2(g)
 2CO(g)ΔH=
2CO(g)ΔH=(2)碱洗过程中发生反应的离子方程式为:
(3)羰化反应为:Ni(s)+4CO(g)
 Ni(CO)4(g) ΔH<0。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
Ni(CO)4(g) ΔH<0。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:| 反应时间 | Ni | CO | Ni(CO)4 | |
| 反应Ⅰ:恒温恒容 | 0 min | 足量 | 4 mol | 0 |
| ∞ | x mol | |||
| 反应Ⅱ:恒温恒压 | 0 min | 足量 | 4 mol | 0 |
| 反应Ⅲ:绝热恒容 | 0 min | 0 | 0 | 1 mol |
①反应Ⅰ在该温度下的平衡常数K=
②下列不能说明反应Ⅲ达到平衡状态的是
a 平衡常数K不再改变 b Ni的质量不再改变
c v生成[Ni(CO)4]=4 v生成(CO) d 容器内的压强不再改变
③比较平衡时下列物理量的大小: CO的体积分数Ⅰ
(4)羰化后的产物为Fe(CO)5、Co2(CO)8、Ni(CO)4,有关性质如下:
| 物质 | Fe(CO)5 | Ni(CO)4 | Co2(CO)8 |
| 沸点/℃ | 106 | 43.2 | 52 |
| 熔点/℃ | -20 | -19.3 | 31 |
| 分解温度/℃ | >160 | 135 | - |
蒸馏提取Ni(CO)4应选择的适宜温度范围是
(5)采用较高温度下分解Ni(CO)4(g)制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义,利用甲烷催化还原NOx消除氮氧化物的污染:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
③CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)ΔH3
N2(g)+CO2(g)+2H2O(g)ΔH3
(1)上述三个反应中ΔH3=___ ,第三个反应的平衡常数表达式为K3=___ 。
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。
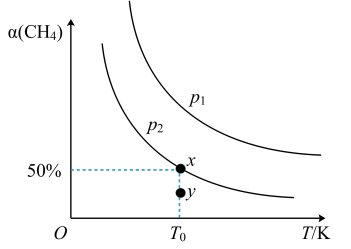
若容器中的压强为p2,y点:v正(填“大于”“等于”或“小于”)___ v逆。
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=___ ;
②30min后只改变某一条件,根据上表数据判断改变的条件可能是__ (填序号)。
A.加入一定量的活性炭 B.恒温恒压充入氩气
C.适当缩小容器的体积 D.加入合适的催化剂
①CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1②CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1③CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g)ΔH3
N2(g)+CO2(g)+2H2O(g)ΔH3(1)上述三个反应中ΔH3=
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。

若容器中的压强为p2,y点:v正(填“大于”“等于”或“小于”)
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)
 N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:| 时间 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=
②30min后只改变某一条件,根据上表数据判断改变的条件可能是
A.加入一定量的活性炭 B.恒温恒压充入氩气
C.适当缩小容器的体积 D.加入合适的催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】利用工业废气 或
或 和
和 在一定条件下可制备燃料甲醇。
在一定条件下可制备燃料甲醇。
(1)25℃,101kPa,CO(g)、H2(g)、CH3OH(l)的燃烧热依次为 。则
。则
___________  。该反应的能量变化图像如图所示,其中
。该反应的能量变化图像如图所示,其中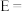
___________ ;由曲线a到曲线b的措施是___________ 。

(2)一定条件下,向1L恒容密闭容器中充入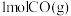 和
和 ,发生反应:
,发生反应: ,经
,经 达到平衡,此时
达到平衡,此时 的转化率为
的转化率为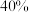 。
。
①能说明该反应已达平衡状态的是___________ (填序号)。
A.容器内 和
和 的分压保持不变 B.
的分压保持不变 B.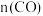 与
与 的比值保持不变
的比值保持不变
C. 的消耗速率与
的消耗速率与 的消耗速率之比为
的消耗速率之比为 D.容器内的密度保持不变
D.容器内的密度保持不变
②下列措施可以加快反应速率的是___________ (填序号,下同),能提高 平衡转化率的是
平衡转化率的是___________ 。
a.升高温度 b.将 从体系中分离出来
从体系中分离出来
c.充入 ,使体系总压强增大 d.再充入一定量的
,使体系总压强增大 d.再充入一定量的
③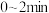 内平均反应速率
内平均反应速率
___________ ,平衡对应温度下,
___________ (K为平衡常数,保留2位小数)。
 或
或 和
和 在一定条件下可制备燃料甲醇。
在一定条件下可制备燃料甲醇。(1)25℃,101kPa,CO(g)、H2(g)、CH3OH(l)的燃烧热依次为
 。则
。则
 。该反应的能量变化图像如图所示,其中
。该反应的能量变化图像如图所示,其中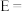

(2)一定条件下,向1L恒容密闭容器中充入
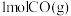 和
和 ,发生反应:
,发生反应: ,经
,经 达到平衡,此时
达到平衡,此时 的转化率为
的转化率为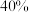 。
。①能说明该反应已达平衡状态的是
A.容器内
 和
和 的分压保持不变 B.
的分压保持不变 B.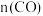 与
与 的比值保持不变
的比值保持不变C.
 的消耗速率与
的消耗速率与 的消耗速率之比为
的消耗速率之比为 D.容器内的密度保持不变
D.容器内的密度保持不变②下列措施可以加快反应速率的是
 平衡转化率的是
平衡转化率的是a.升高温度 b.将
 从体系中分离出来
从体系中分离出来c.充入
 ,使体系总压强增大 d.再充入一定量的
,使体系总压强增大 d.再充入一定量的
③
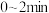 内平均反应速率
内平均反应速率

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g) 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为_____ 。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是_____ 。
(3)对于反应N2(g)+3H2(g) 2NH3(g)在一定条件下氨的平衡含量如下表。
2NH3(g)在一定条件下氨的平衡含量如下表。
①该反应为_____ (填“吸热”或“放热”)反应。
②其他条件不变时,温度升高氨的平衡含量减小的原因是_____ (填字母序号)。
A.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
B.温度升高,K变小。平衡逆向移动
C.温度升高,活化分子数增多,反应速率加快
(4)在合成氨工业中,原料气(N2、H2及少量CO、NH3混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO,其反应为: [CuNH3)2]++CO+NH3 [Cu(NH3)3CO]+ΔH<0,则利用铜氨液吸收CO适宜的生产条件是
[Cu(NH3)3CO]+ΔH<0,则利用铜氨液吸收CO适宜的生产条件是_________ 。
(5)科学家持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为_____ 。
(1)反应N2(g)+3H2(g)
 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 序号 | 化学反应 | K(298K)的数值 |
| ① | N2(g)+O2(g) 2NO(g) 2NO(g) | 5×10-31 |
| ② | N2(g)+3H2(g) 2NH3(g) 2NH3(g) | 4.1×106 |
 2NH3(g)在一定条件下氨的平衡含量如下表。
2NH3(g)在一定条件下氨的平衡含量如下表。| 温度/°C | 压强MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②其他条件不变时,温度升高氨的平衡含量减小的原因是
A.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
B.温度升高,K变小。平衡逆向移动
C.温度升高,活化分子数增多,反应速率加快
(4)在合成氨工业中,原料气(N2、H2及少量CO、NH3混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO,其反应为: [CuNH3)2]++CO+NH3
 [Cu(NH3)3CO]+ΔH<0,则利用铜氨液吸收CO适宜的生产条件是
[Cu(NH3)3CO]+ΔH<0,则利用铜氨液吸收CO适宜的生产条件是(5)科学家持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______ 。
(2)该反应为_______ 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是_______。
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _______ ℃。
Ⅱ.完成下列填空
(5)Na2CO3的水溶液呈_______ 性,原因是(用离子方程式表示):_______ ;
(6)实验室在配制Na2CO3溶液时,为了抑制水解应向溶液中加入少量的_______ 。
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K =
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是_______。
| A.容器中压强不变 | B.混合气体中 c(CO)不变 |
| C.v正(H2)=v逆(H2O) | D.c(CO2)=c(CO) |
Ⅱ.完成下列填空
(5)Na2CO3的水溶液呈
(6)实验室在配制Na2CO3溶液时,为了抑制水解应向溶液中加入少量的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称_______ ,可作为碱使用的原因是_______ (用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ·mol-1
②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5 kJ·mol-1
反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=_______ kJ·mol−1,该反应的平衡常数表达式K=_______ 。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中 =
=_______ 。已知Ksp(BaCO3)=2.6×10−9,Ksp(BaSO4)=1.1×10−10。
(4)溶液中Cu2+的浓度可采用碘量法测得:①2Cu2++5I-=2CuI↓+I ②I
②I +2S2O
+2S2O = S4O
= S4O +3I-;反应①中的氧化剂为
+3I-;反应①中的氧化剂为 _______ 。现取20.00 mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol• L-1的Na2S2O3,标准溶液滴定至终点,消耗Na2S2O3溶液25.00 mL,此溶液中Cu2+的浓度为_______ mol• L-1。
(1)碳酸钠俗称
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ·mol-1
②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5 kJ·mol-1
反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中
 =
=(4)溶液中Cu2+的浓度可采用碘量法测得:①2Cu2++5I-=2CuI↓+I
 ②I
②I +2S2O
+2S2O = S4O
= S4O +3I-;反应①中的氧化剂为
+3I-;反应①中的氧化剂为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一
I.
(1)利用CH4催化还原氮氧化物消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(l) ΔH=-662kJ/mol
4NO(g)+CO2(g)+2H2O(l) ΔH=-662kJ/mol
②CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(l) ΔH=-955kJ/mol
N2(g)+CO2(g)+2H2O(l) ΔH=-955kJ/mol
则反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+H2O(l) ΔH=_____ 。
II.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) ΔH<0
5N2(g)+6H2O(l) ΔH<0
(2)一定温度下,在恒容密闭容器中按照n(NH3)∶n(NO)=2∶3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是_____。
(3)实验测得v正=k正·c4(NH3)·c6(NO),v逆=k逆·c5(N2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____ (填“>”“<”或“=”)k逆增大的倍数。
②若在1L的恒容密闭容器中充入2molNH3和3molNO,在一定温度下达到平衡时,NH3的转化率为80%,则k正︰k逆=_____ L/mol(只需列表达式)。
Ⅲ.利用燃料电池的原理来处理氮氧化物是一种新方向。装置如图所示,在处理过程中石墨电极I上反应生成一种氧化物Y。

(4)石墨II电极为_____ (填“正”或“负”)极,该电极反应为_____ 。
(5)写出该电池反应的方程式_____ 。
I.
(1)利用CH4催化还原氮氧化物消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(l) ΔH=-662kJ/mol
4NO(g)+CO2(g)+2H2O(l) ΔH=-662kJ/mol②CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(l) ΔH=-955kJ/mol
N2(g)+CO2(g)+2H2O(l) ΔH=-955kJ/mol则反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+H2O(l) ΔH=
II.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) ΔH<0
5N2(g)+6H2O(l) ΔH<0(2)一定温度下,在恒容密闭容器中按照n(NH3)∶n(NO)=2∶3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是_____。
| A.c(NH3)∶c(NO)=2∶3 |
| B.1molN—H键断裂的同时,断裂1molO—H键 |
| C.容器内压强不变 |
| D.容器内混合气体的密度不变 |
①达到平衡后,仅升高温度,k正增大的倍数
②若在1L的恒容密闭容器中充入2molNH3和3molNO,在一定温度下达到平衡时,NH3的转化率为80%,则k正︰k逆=
Ⅲ.利用燃料电池的原理来处理氮氧化物是一种新方向。装置如图所示,在处理过程中石墨电极I上反应生成一种氧化物Y。

(4)石墨II电极为
(5)写出该电池反应的方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如表所示[t=∞时,N2O5(g)完全分解]:
已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH=-4.4 kJ·mol-1
2NO2(g) N2O4(g) ΔH=-55.3 kJ·mol-1
N2O4(g) ΔH=-55.3 kJ·mol-1
(1)若提高反应温度至35 ℃,则 N2O5(g)完全分解后体系压强p∞(35 ℃)___________ 63.1 kPa(填“大于”“等于”或“小于”),原因是___________
(2)25 ℃时N2O4(g) 2NO2(g)反应的平衡常数Kp=
2NO2(g)反应的平衡常数Kp=___________ kPa,该温度下,2NO2(g)  N2O4(g)的Kp为
N2O4(g)的Kp为___________ (Kp为以分压表示的平衡常数,计算结果保留1位小数)
(3)对于N2O4(g) 2NO2(g)反应达到平衡时Kp(35 ℃)
2NO2(g)反应达到平衡时Kp(35 ℃)___________ Kp(25 ℃)(填“>”“<”或“=”)

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如表所示[t=∞时,N2O5(g)完全分解]:
| t/min | 0 | 40 | 80 | 160 | 260 | 1 300 | 1 700 | ∞ |
| p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
2NO2(g)
 N2O4(g) ΔH=-55.3 kJ·mol-1
N2O4(g) ΔH=-55.3 kJ·mol-1(1)若提高反应温度至35 ℃,则 N2O5(g)完全分解后体系压强p∞(35 ℃)
(2)25 ℃时N2O4(g)
 2NO2(g)反应的平衡常数Kp=
2NO2(g)反应的平衡常数Kp= N2O4(g)的Kp为
N2O4(g)的Kp为(3)对于N2O4(g)
 2NO2(g)反应达到平衡时Kp(35 ℃)
2NO2(g)反应达到平衡时Kp(35 ℃)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氢气是重要的工业原料,同时也是一种理想的二次能源。“制氢”“储氢”“”用氢”一直都是能源研究的重点。甲烷水汽重整反应是我国主要的制氢技术,有关反应如下:
反应i:
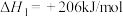
反应ⅱ:
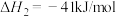
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式:___________ 。
(2)一定温度下,向恒容密闭反应器中通入CH4和H2O(g),起始时CH4和H2O(g)的分压分别为2MPa、3MPa,发生反应i和反应ⅱ。反应进行t1min时达到平衡状态,此时CO、CO2的分压分别为mMPa、nMPa。
①CH4的平衡分压为___________ MPa(用含m,n的代数式表示,下同)。
②反应ⅱ的Kp=___________ (用平衡时各物质的分压代替物质的量浓度)。
(3)镧镍合金是一种良好的储氢材料。向体积恒定的密闭容器中充入氢气发生如下反应: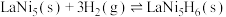 。H2的平衡转化率与其初始充入的物质的量(n)、反应温度(T)的关系如图所示。
。H2的平衡转化率与其初始充入的物质的量(n)、反应温度(T)的关系如图所示。

①该反应平衡常数的大小关系K(T1)________ K(T2)(填“>”“=”或“<”,下同)。
②氢气初始充入量n1___________ n2___________ n3。
(4)工业用二氧化碳加氢可合成乙醇: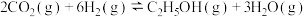 。保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比m(起始加入的H2与CO2的物质的量之比)的关系如图所示。
。保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比m(起始加入的H2与CO2的物质的量之比)的关系如图所示。
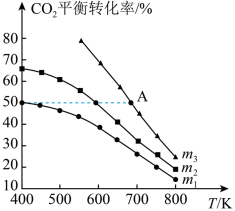
①投料比m1、m2与m3由大到小的顺序为________ 。
②若投料比m=1,一定温度下发生反应。下列说法不能确定反应是否达平衡的是_______ (填标号)。
A.容器内气体密度不再变化
B.CO2的体积分数不再变化
C.容器内气体平均相对分子质量不再变化
D.容器内H2与CO2的物质的量之比不再变化
E.断裂3NA个H—H键的同时生成1.5NA个水分子
③若m3=3,其他条件不变,A点对应起始反应物置于某恒容密闭容器中,则平衡时CO2的转化率________ 50%(填“>”“=”或“<”)。
反应i:

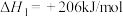
反应ⅱ:

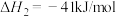
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式:
(2)一定温度下,向恒容密闭反应器中通入CH4和H2O(g),起始时CH4和H2O(g)的分压分别为2MPa、3MPa,发生反应i和反应ⅱ。反应进行t1min时达到平衡状态,此时CO、CO2的分压分别为mMPa、nMPa。
①CH4的平衡分压为
②反应ⅱ的Kp=
(3)镧镍合金是一种良好的储氢材料。向体积恒定的密闭容器中充入氢气发生如下反应:
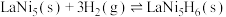 。H2的平衡转化率与其初始充入的物质的量(n)、反应温度(T)的关系如图所示。
。H2的平衡转化率与其初始充入的物质的量(n)、反应温度(T)的关系如图所示。
①该反应平衡常数的大小关系K(T1)
②氢气初始充入量n1
(4)工业用二氧化碳加氢可合成乙醇:
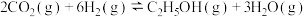 。保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比m(起始加入的H2与CO2的物质的量之比)的关系如图所示。
。保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比m(起始加入的H2与CO2的物质的量之比)的关系如图所示。
①投料比m1、m2与m3由大到小的顺序为
②若投料比m=1,一定温度下发生反应。下列说法不能确定反应是否达平衡的是
A.容器内气体密度不再变化
B.CO2的体积分数不再变化
C.容器内气体平均相对分子质量不再变化
D.容器内H2与CO2的物质的量之比不再变化
E.断裂3NA个H—H键的同时生成1.5NA个水分子
③若m3=3,其他条件不变,A点对应起始反应物置于某恒容密闭容器中,则平衡时CO2的转化率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】红磷P(s)和Cl2(g)可以发生反应生成PCl3(g)和PCl5(g),反应过程中能量的变化如图甲所示。

回答下列回题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式为___ 。
(2)三氯化磷与氯气反应制备五氯化磷的化学方程式为PCl3(g)+Cl2(g) PCl5(g),向某一恒容密闭容器内充入一定量的氯气和三氯化磷,发生上述反应,则下列说法中能表明反应达到平衡状态的是
PCl5(g),向某一恒容密闭容器内充入一定量的氯气和三氯化磷,发生上述反应,则下列说法中能表明反应达到平衡状态的是___ (填序号)。
(3)一定温度下,向容积为2L的容器中充入2molPCl3和1molCl2,一段时间后反应达到平衡状态,不同时刻容器中PCl5的物质的量如表所示:
①0~150s内PCl3的平均反应速率为___ 。
②该温度下,反应的平衡常数为___ (用分数表示)。
③在起始温度相同时,在甲、乙(容积均为2L)两个容器中发生反应:PCl3(g)+Cl2(g) PCl5(g),甲容器为绝热容器,乙容器为恒温容器且各反应物起始物质的量相同,反应一段时间后,相对于乙容器而言,甲容器中PCl3的浓度迅速减小的原因是
PCl5(g),甲容器为绝热容器,乙容器为恒温容器且各反应物起始物质的量相同,反应一段时间后,相对于乙容器而言,甲容器中PCl3的浓度迅速减小的原因是___ 。
(4)如图乙为Ca—LiFePO4可充电电池的工作原理示意图,锂离子导体膜只允许Li+通过。
已知:放电时Ca转化成Ca2+

①放电时,电池的总反应式为___ 。
②LiPF6—LiAsF6为非水电解质,其主要作用为___ 。

回答下列回题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式为
(2)三氯化磷与氯气反应制备五氯化磷的化学方程式为PCl3(g)+Cl2(g)
 PCl5(g),向某一恒容密闭容器内充入一定量的氯气和三氯化磷,发生上述反应,则下列说法中能表明反应达到平衡状态的是
PCl5(g),向某一恒容密闭容器内充入一定量的氯气和三氯化磷,发生上述反应,则下列说法中能表明反应达到平衡状态的是| A.混合气体的密度保持不变 |
| B.氯气与五氯化磷的消耗速率之比为1∶1 |
| C.混合气体的压强保持不变 |
| D.混合气体中c(PCl3)=c(PCl5) |
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.401 | 0.40 |
①0~150s内PCl3的平均反应速率为
②该温度下,反应的平衡常数为
③在起始温度相同时,在甲、乙(容积均为2L)两个容器中发生反应:PCl3(g)+Cl2(g)
 PCl5(g),甲容器为绝热容器,乙容器为恒温容器且各反应物起始物质的量相同,反应一段时间后,相对于乙容器而言,甲容器中PCl3的浓度迅速减小的原因是
PCl5(g),甲容器为绝热容器,乙容器为恒温容器且各反应物起始物质的量相同,反应一段时间后,相对于乙容器而言,甲容器中PCl3的浓度迅速减小的原因是(4)如图乙为Ca—LiFePO4可充电电池的工作原理示意图,锂离子导体膜只允许Li+通过。
已知:放电时Ca转化成Ca2+

①放电时,电池的总反应式为
②LiPF6—LiAsF6为非水电解质,其主要作用为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述_____ (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为_____ 。
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CH3OH、O2为原料,KOH溶液为电解质设计成燃料电池,则负极的电极反应式为_____ 。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。

①图2电池负极区的电极反应为_____ 。
②若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现_____ 色,c位置的电极反应式为_____ 。
③若用KI-淀粉常液漫湿速纸,用导线将b与A.B电极相连,铅笔芯c点处出现蓝色,则b接的_____ 填"A"或“B")电极。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CH3OH、O2为原料,KOH溶液为电解质设计成燃料电池,则负极的电极反应式为
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。

①图2电池负极区的电极反应为
②若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现
③若用KI-淀粉常液漫湿速纸,用导线将b与A.B电极相连,铅笔芯c点处出现蓝色,则b接的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】NO和NO2都是有毒气体,氨气可作为脱硝剂,如NO和 ,在一定条件下发生反应:6NO(g)+4NH3(g)
,在一定条件下发生反应:6NO(g)+4NH3(g) 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
(1)在恒温恒容的条件下,下列能说明该反应已达到平衡状态的是___________ (填字母)。
a.反应速率
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6
e.有12molN-H键断裂的同时生成5molN≡N键
f.混合气体的密度不随时间的变化而变化
(2)利用该原理,设计如下原电池,除掉NO的同时,还可以提供电能。
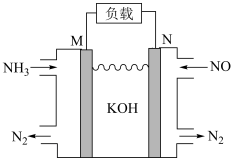
N电极上发生的电极反应为___________ 。
(3)已知拆开1molH-H键、1molN≡N键、1molN-H键需要的能量依次为436kJ、946kJ、391kJ,在该温度下,制备所需NH3时,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总小于92kJ(理论消耗1molN2放出92kJ的热量),其原因是___________ 。
(4)一定条件下,在2L密闭容器内,反应2NO2(g) N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:
①用N2O4表示0~2s内该反应的平均速率v(N2O4)=___________ ,在第5s时,NO2的转化率为___________ 。(转化率是指某一反应物转化量占及其总量的百分比)
②根据上表可以看出,随着反应的进行,反应速率逐渐减小,其原因是___________ 。
 ,在一定条件下发生反应:6NO(g)+4NH3(g)
,在一定条件下发生反应:6NO(g)+4NH3(g) 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。(1)在恒温恒容的条件下,下列能说明该反应已达到平衡状态的是
a.反应速率

b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6
e.有12molN-H键断裂的同时生成5molN≡N键
f.混合气体的密度不随时间的变化而变化
(2)利用该原理,设计如下原电池,除掉NO的同时,还可以提供电能。

N电极上发生的电极反应为
(3)已知拆开1molH-H键、1molN≡N键、1molN-H键需要的能量依次为436kJ、946kJ、391kJ,在该温度下,制备所需NH3时,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总小于92kJ(理论消耗1molN2放出92kJ的热量),其原因是
(4)一定条件下,在2L密闭容器内,反应2NO2(g)
 N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 0.040 | 0.0140 | 0.008 | 0.005 | 0.005 | 0.005 |
②根据上表可以看出,随着反应的进行,反应速率逐渐减小,其原因是
您最近一年使用:0次



