(1)已知室温下BaSO4的Ksp =1.1×10−10,欲使溶液中c(SO42-)≤1.0×10−6 mol·L−1,应保持溶液中c(Ba2+)≥___________ 。
(2)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应的离子方程式为_______________
(3)25℃时,有c(CH3COOH)+c(CH3COO-)= 0.1mol·L−1的醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。
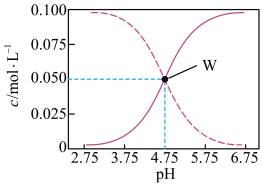
下列有关溶液中离子浓度关系的叙述正确的是_____________ 。(错选不得分)
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 点所表示的溶液中:c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C.pH = 3.5的溶液中:c(Na+) +c(H+) −c(OH-) +c(CH3COOH)= 0.1mol·L−1
D.向W点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)= c(CH3COOH)+c(OH-)
(2)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应的离子方程式为
(3)25℃时,有c(CH3COOH)+c(CH3COO-)= 0.1mol·L−1的醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。

下列有关溶液中离子浓度关系的叙述正确的是
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 点所表示的溶液中:c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C.pH = 3.5的溶液中:c(Na+) +c(H+) −c(OH-) +c(CH3COOH)= 0.1mol·L−1
D.向W点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)= c(CH3COOH)+c(OH-)
更新时间:2019-09-04 20:54:35
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】有效去除大气中的NOx和水体中的氮,并且转化为可利用的资源是重要课题。
(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=_______ kJ·mol-1
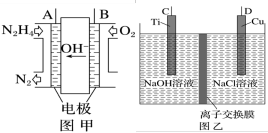
(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。_______ (请填“C”或“D”)极相连。
②该电解池的阳极反应式为_______ 。
③该电解池(图乙)中离子交换膜为_______ (请填“阴”或“阳”)离子交换膜。
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)_______ mol。
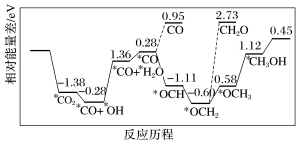
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的活化能。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮( 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。_______ 。
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是_______ 。
(1)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: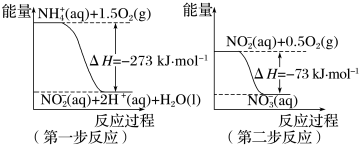
 (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。
②该电解池的阳极反应式为
③该电解池(图乙)中离子交换膜为
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(
 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。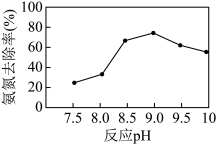
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】树德中学化学兴趣小组设计不同实验方案比较Cu2+、Ag+的氧化性。(本实验忽略Cu2+、Ag+在此条件下的水解)
(1)方案1:通过置换反应比较:向AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是______ ,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+分别与同一物质反应进行比较
①经检验,I中溶液不含I2,黄色沉淀是______ 。
②取II中棕黄色溶液,加入少量______ 溶液,变为______ 色,说明生成了I2。推测Cu2+做氧化剂,沉淀A有CuI。该反应的离子方程式为:________________
查阅资料得知: CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出假设并证明假设是否成立,取部分棕黑色沉淀进行实验二:

已知: CuI难溶于CCl4;I2+2S2O32-=2I-+S4O62-(无色);Cu++2S2O32-=Cu(S2O3)23-(无色)。
由实验二得出结论: 棕黑色沉淀是___________________ 。现象ⅲ为______________ 。用化学平衡移动原理解释产生现象ii的原因:________________ 。
③白色沉淀CuI与AgNO3 溶液反应生成AgI和一种固体单质,该反应的离子方程式是______ ,说明氧化性Ag+>Cu2+。
(1)方案1:通过置换反应比较:向AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是
(2)方案2:通过Cu2+、Ag+分别与同一物质反应进行比较
| 实验 | 试剂 | 编号及现象 | |
| 试管 | 滴管 | ||
 | 1.0mol/L KI溶液 | 1.0mol/L AgNO3溶液1mL | I.产生黄色沉淀,溶液无色 |
| 1.0mol/L CuSO4溶液1mL | II.产生棕黑色沉淀A,溶液变棕黄 | ||
②取II中棕黄色溶液,加入少量
查阅资料得知: CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出假设并证明假设是否成立,取部分棕黑色沉淀进行实验二:

已知: CuI难溶于CCl4;I2+2S2O32-=2I-+S4O62-(无色);Cu++2S2O32-=Cu(S2O3)23-(无色)。
由实验二得出结论: 棕黑色沉淀是
③白色沉淀CuI与AgNO3 溶液反应生成AgI和一种固体单质,该反应的离子方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
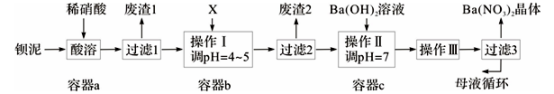
已知:i .Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii .Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii. Kap(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)Ba(FeO2)2中Fe的化合价是____ 。
(2)二氧化碳与水作用形成的碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式________________________ 。
(3)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理:__________________ 。
(4)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为:__________ 。
(5)该厂结合本厂实际,选用的X为_____ (从下列选项中选择);废渣2为______ (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(6)过滤3后的母液应循环到容器____ 中。(填“a”、“b”或“c”)
(7)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为____ 。

已知:i .Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii .Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii. Kap(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)Ba(FeO2)2中Fe的化合价是
(2)二氧化碳与水作用形成的碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式
(3)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理:
(4)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为:
(5)该厂结合本厂实际,选用的X为
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(6)过滤3后的母液应循环到容器
(7)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
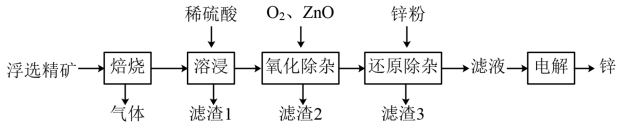
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________ 。
(2)滤渣1的主要成分除SiO2外还有___________ ;氧化除杂工序中ZnO的作用是____________ ,若不通入氧气,其后果是________________ 。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________ 。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________ ;沉积锌后的电解液可返回_______ 工序继续使用。

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为
(2)滤渣1的主要成分除SiO2外还有
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铜冶炼过程产生的粗硫酸镍废液中含有Cu2+、Fe2+、Ca2+、Mg2+、H3AsO3等微粒。工业上以此为原料精制硫酸镍的主要流程如图:
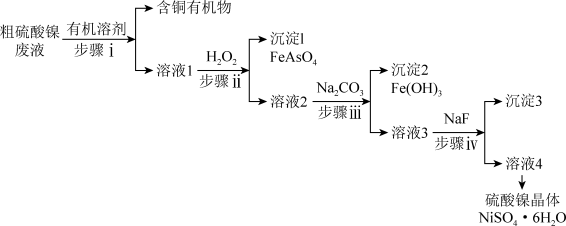
已知:①常温下,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Ni(OH)3]=5.48×10-16;②H3AsO3是一种三元弱酸。
(1)可选择______ (填标号)检验粗硫酸镍废液中是否存在Fe2+。
A.NaOH溶液 B.硫氰化钾溶液 C.K3[Fe(CN)6]溶液 D.稀硫酸
(2)步骤ii温度不能过高的原因______ 。写出步骤ii生成沉淀FeAsO4的离子方程式_____ 。
(3)步骤iii加入Na2CO3的目的是______ 。若不考虑溶液体积的变化,溶液3中c(Fe3+)≤2.6×10-9mol·L-1,溶液2中c(Ni2+)=0.0548mol·L-1,则步骤iii需控制pH的范围为______ 。
(4)步骤iv在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是______ 。
(5)结合图像分析由溶液4得到NiSO4·6H2O的操作是______ ,过滤、洗涤、干燥。


已知:①常温下,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Ni(OH)3]=5.48×10-16;②H3AsO3是一种三元弱酸。
(1)可选择
A.NaOH溶液 B.硫氰化钾溶液 C.K3[Fe(CN)6]溶液 D.稀硫酸
(2)步骤ii温度不能过高的原因
(3)步骤iii加入Na2CO3的目的是
(4)步骤iv在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是
(5)结合图像分析由溶液4得到NiSO4·6H2O的操作是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
(1)探究BaCO3和BaSO4之间的转化
实验操作:
①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,___________ 。
②写出实验Ⅱ中加入C溶液后发生反应的离子方程式是___________ 。
③现有0.34mol的BaSO4沉淀,使用1L饱和Na2CO3溶液(物质的量浓度为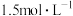 )处理,需要反复处理
)处理,需要反复处理___________ 次,才能使BaSO4全部转化为BaCO3.
(2)探究AgCl和AgI之间的转化
①用化学用语表示AgI的沉淀溶解平衡___________ 。
②25℃时,若使Ag+沉淀完全,则溶液中Cl﹣的浓度至少为___________  。
。
实验Ⅲ: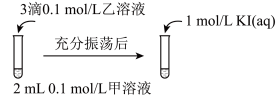
可供选择的试剂有:a.AgNO3溶液 b.NaCl溶液 c.KI溶液
③若要用实验Ⅲ证明AgCl能够转化为AgI,甲溶液应选择___________ (填上方试剂的编号);应用实验Ⅲ的方式,无论怎样选择试剂,学生都无法观察到AgI转化为AgCl,于是又设计了如下实验。
实验Ⅳ:
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
④查阅有关资料可知,Ag+可氧化I﹣,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率___________ (填“大于”或“小于”)沉淀反应速率。设计原电池实验(使用盐桥阻断Ag+与I﹣的相互接触)如上图所示,则该原电池总反应的离子方程式为___________ 。
已知:实验测得电压表读数:a>c>b>0.
⑤结合信息,解释实验Ⅳ中b<a的原因:___________ 。
⑥实验Ⅳ的现象能说明AgI可向AgCl转化,理由是:___________ 。
综合实验Ⅰ~Ⅳ,可得出结论:溶解度小的沉淀容易转化成溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现。
| 物质 | BaSO4 | BaCO3 | AgI | AgCl |
 (25℃) (25℃) | 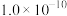 |  | 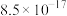 |  |
(1)探究BaCO3和BaSO4之间的转化
实验操作:

| 试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
| 实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
| 实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生沉淀部分溶解 |
②写出实验Ⅱ中加入C溶液后发生反应的离子方程式是
③现有0.34mol的BaSO4沉淀,使用1L饱和Na2CO3溶液(物质的量浓度为
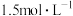 )处理,需要反复处理
)处理,需要反复处理(2)探究AgCl和AgI之间的转化
①用化学用语表示AgI的沉淀溶解平衡
②25℃时,若使Ag+沉淀完全,则溶液中Cl﹣的浓度至少为
 。
。实验Ⅲ:

可供选择的试剂有:a.AgNO3溶液 b.NaCl溶液 c.KI溶液
③若要用实验Ⅲ证明AgCl能够转化为AgI,甲溶液应选择
实验Ⅳ:
| 装置 | 步骤 | 电压表读数 |
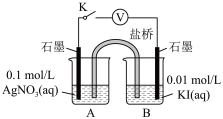 | i.如图连接装置并加入试剂,闭合K | a |
| ii.向B中滴入AgNO3溶液,至沉淀完全 | b | |
| iii.再向B中投入一定量NaCl固体 | c | |
| iv。重复i,再向B中加入与iii等量NaCl固体 | a |
④查阅有关资料可知,Ag+可氧化I﹣,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率
已知:实验测得电压表读数:a>c>b>0.
⑤结合信息,解释实验Ⅳ中b<a的原因:
⑥实验Ⅳ的现象能说明AgI可向AgCl转化,理由是:
综合实验Ⅰ~Ⅳ,可得出结论:溶解度小的沉淀容易转化成溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铅及其化合物有着优异的性能和广泛的应用。工业上利用铅浮渣(主要成分是PbO、Pb,还含有少量的Ag、CaO)制备硫酸铅。制备流程图如下
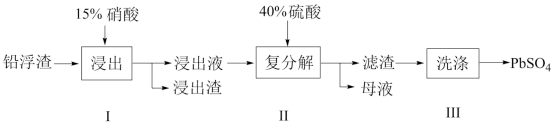
已知:Ksp(PbSO4)=1.6×10-8 Ksp(CaSO4)=4.9×10-5
(1)步骤I有NO产生浸出液中含量最多的金属阳离子为Pb2+,写出Pb参加反应的化学方程式___________________________ ,为防止Ag被溶解进入溶液,步骤I操作时应注意_______________________ 。
(2)粗PbSO4产品含有的杂质是____________ ;要得到纯净的PbSO4,需要用试剂进行多次洗涤,再用蒸馏水洗涤。最好选用的试剂是_________________ 。
A.稀硫酸 B.稀盐酸 C.硝酸铅溶液 D.酒精
(3)母液可循环利用的物质是HNO3,若母液中残留的 过多,循环利用时可能出现的问题是
过多,循环利用时可能出现的问题是______________________________ 。
(4)若将步骤Ⅱ中的Pb2+完全沉淀,则溶液中的c( )至少为
)至少为___________ mol/L。
(5)(CH3COO)2Pb是皮毛行业可溶于水的染色助剂,可用PbSO4与CH3COONH4反应制备,写出该反应的离子方程式_______________________ 。
(6)铅蓄电池是电压稳定、使用方便的二次电池。PbSO4在其中扮演了重要角色,写出铅蓄电池充电时阳极的电极反应_______________________ 。

已知:Ksp(PbSO4)=1.6×10-8 Ksp(CaSO4)=4.9×10-5
(1)步骤I有NO产生浸出液中含量最多的金属阳离子为Pb2+,写出Pb参加反应的化学方程式
(2)粗PbSO4产品含有的杂质是
A.稀硫酸 B.稀盐酸 C.硝酸铅溶液 D.酒精
(3)母液可循环利用的物质是HNO3,若母液中残留的
 过多,循环利用时可能出现的问题是
过多,循环利用时可能出现的问题是(4)若将步骤Ⅱ中的Pb2+完全沉淀,则溶液中的c(
 )至少为
)至少为(5)(CH3COO)2Pb是皮毛行业可溶于水的染色助剂,可用PbSO4与CH3COONH4反应制备,写出该反应的离子方程式
(6)铅蓄电池是电压稳定、使用方便的二次电池。PbSO4在其中扮演了重要角色,写出铅蓄电池充电时阳极的电极反应
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】某蓄电池的反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是_______ (填选项字母)。放电时生成Fe(OH)2的质量为18 g,则外电路中转移的电子数是_______ 。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)精炼铜时,精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
电解液 溶液A
溶液A
 溶液B
溶液B
已知:
则加入H2O2的目的是_______ 。乙同学认为应将方案中的pH调节到8,甲同学认为不合理,他的理由是_______
(3)如图所示为一电解池装置,若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试剂,试判断:

①B电极是_______ 极(填“阴”或“阳”);
②该电解的总反应离子方程式为_______ ,
(4)若图示装置为用惰性电极电解CuSO4溶液的装置,其中阴极上析出Cu的质量为3.2 g,则阳极上产生的气体在标准状况下的体积为_______ ;常温下,若将电解后的溶液稀释至1 L,则溶液的pH约为_______ 。
 Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2(1)该蓄电池充电时,发生还原反应的物质是
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)精炼铜时,精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
电解液
 溶液A
溶液A
 溶液B
溶液B已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是
(3)如图所示为一电解池装置,若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试剂,试判断:

①B电极是
②该电解的总反应离子方程式为
(4)若图示装置为用惰性电极电解CuSO4溶液的装置,其中阴极上析出Cu的质量为3.2 g,则阳极上产生的气体在标准状况下的体积为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】利用含锶(Sr)废渣制备 晶体的流程如下:
晶体的流程如下:

已知:i.含锶废渣中Sr主要以 和
和 的形式存在;
的形式存在;
ii.25℃,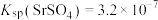 ,
,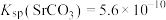 。
。
请回答下列问题:
(1)转化
①转化前,含锶废渣需要粉碎研磨的目的是___________ 。
②转化过程中,向 溶液中加入氨水,提高溶液pH,目的是提高
溶液中加入氨水,提高溶液pH,目的是提高___________ (填粒子符号)的浓度,将 转化为
转化为 。
。
(2)溶出
溶出过程发生反应的离子方程式是___________ 。
(3)纯化
溶出液中除含有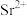 外,还含有
外,还含有 和少量的
和少量的 、
、 等杂质,其中
等杂质,其中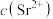 与
与 近似相等。纯化过程涉及操作如下:
近似相等。纯化过程涉及操作如下:

已知:iii.25℃, 和
和 沉淀时的pH(当金属离子浓度为
沉淀时的pH(当金属离子浓度为 时,可认为沉淀完全):
时,可认为沉淀完全):
iv. 和
和 在不同温度下的溶解度:
在不同温度下的溶解度:
①为除去溶液中的 和
和 ,应调节pH的范围为
,应调节pH的范围为___________ 。25℃时,
___________ 。
②滤液1中加入适量NaOH调节pH至14和升温至90℃有利于 析出的原因是
析出的原因是___________ 。
③90℃时,
___________ (填“>”或“<”) 。
。
④操作X是加热浓缩、___________ 、___________ 、洗涤、干燥。
 晶体的流程如下:
晶体的流程如下:
已知:i.含锶废渣中Sr主要以
 和
和 的形式存在;
的形式存在;ii.25℃,
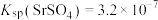 ,
,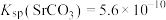 。
。请回答下列问题:
(1)转化
①转化前,含锶废渣需要粉碎研磨的目的是
②转化过程中,向
 溶液中加入氨水,提高溶液pH,目的是提高
溶液中加入氨水,提高溶液pH,目的是提高 转化为
转化为 。
。(2)溶出
溶出过程发生反应的离子方程式是
(3)纯化
溶出液中除含有
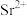 外,还含有
外,还含有 和少量的
和少量的 、
、 等杂质,其中
等杂质,其中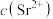 与
与 近似相等。纯化过程涉及操作如下:
近似相等。纯化过程涉及操作如下:
已知:iii.25℃,
 和
和 沉淀时的pH(当金属离子浓度为
沉淀时的pH(当金属离子浓度为 时,可认为沉淀完全):
时,可认为沉淀完全):| 氢氧化物 | 开始沉淀 | 沉淀完全 | 沉淀开始溶解 |
 | 2.3 | 4.1 | —— |
 | 4.0 | 5.2 | 7.8 |
 和
和 在不同温度下的溶解度:
在不同温度下的溶解度:| 温度/℃ 溶解度/g 氢氧化物 | 20 | 40 | 60 | 80 | 90 |
 | 1.77 | 3.95 | 8.42 | 20.2 | 44.5 |
 | 0.173 | 0.141 | 0.121 | 0.094 | 0.086 |
 和
和 ,应调节pH的范围为
,应调节pH的范围为
②滤液1中加入适量NaOH调节pH至14和升温至90℃有利于
 析出的原因是
析出的原因是③90℃时,

 。
。④操作X是加热浓缩、
您最近一年使用:0次



