已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是
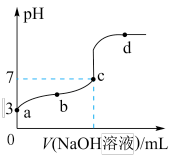
| A.a点表示的溶液中c(H+)等于10-3 mol·L-1 |
| B.b点表示的溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中 均等于K 均等于K |
10-11高二下·浙江杭州·期中 查看更多[16]
辽宁省建平县实验中学2023-2024学年高二上学期10月月考化学试题广东省揭阳市惠来县第一中学2021-2022学年高二下学期第一次阶段考试化学试题广东省汕尾市2021-2022学年高二上学期期末考试化学试题山东省临沂市罗庄区2019-2020学年高二上学期期末考试化学试题河北省武邑中学2019-2020学年高二12月月考化学试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(基础卷)试题广州省广州市石化中学2018-2019学年高二上学期期末考试化学试题【市级联考】吉林省公主岭市2018-2019学年高二上学期期末考试化学试题黑龙江省牡丹江市第一高级中学2017-2018学年高二上学期期中考试化学(理)试题湖北省襄阳市第四中学2017-2018学年高二10月月考化学试题安徽省巢湖市柘皋中学2018届高三上学期第一次月考化学试题(已下线)2012届高考化学一轮复习《溶液中的离子反应》专题综合测试(苏教版)(已下线)2010—2011学年浙江省杭州二中高二下二学期期中考试化学试卷2014-2015山东省潍坊一中高二上学期1月质量检测化学试卷(已下线)2014届山东济南外国语学校高三上学期质量检测化学试卷 2017届天津市武清区杨村第一中学高三下学期第一次月考化学试卷
更新时间:2019-11-04 16:20:43
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,用 的
的 溶液分别滴定
溶液分别滴定 的
的 溶液和
溶液和 的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
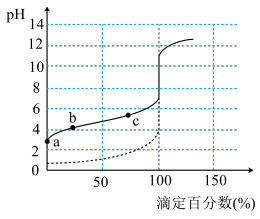
 的
的 溶液分别滴定
溶液分别滴定 的
的 溶液和
溶液和 的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
| A.实线表示滴定盐酸的曲线 |
| B.酸的强弱是影响突跃范围大小的重要因素 |
C.ab段的离子反应式是 |
| D.两个体系滴定终点的确定都可用甲基橙作指示剂 |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐2】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用 溶液以恒定速度来滴定,根据测定结果绘制出
溶液以恒定速度来滴定,根据测定结果绘制出 、
、 等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是
等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是

 溶液以恒定速度来滴定,根据测定结果绘制出
溶液以恒定速度来滴定,根据测定结果绘制出 、
、 等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是
等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是
A. 溶液和浓氯水可以使用同种滴定管盛装 溶液和浓氯水可以使用同种滴定管盛装 |
B.a点溶液中存在如下关系: |
C.b点溶液中各离子浓度: |
D. , , 生成速率越来越快 生成速率越来越快 |
您最近半年使用:0次
【推荐1】25℃时,用NaOH溶液分别滴定HX、 、
、 三种溶液,
三种溶液, [M表示
[M表示 、
、 、
、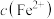 ]随pH变化关系如图所示,其中③的M代表
]随pH变化关系如图所示,其中③的M代表 。已知
。已知 ,下列有关分析不正确的是
,下列有关分析不正确的是
 、
、 三种溶液,
三种溶液, [M表示
[M表示 、
、 、
、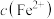 ]随pH变化关系如图所示,其中③的M代表
]随pH变化关系如图所示,其中③的M代表 。已知
。已知 ,下列有关分析不正确的是
,下列有关分析不正确的是
A.①代表滴定 溶液的变化关系 溶液的变化关系 |
B.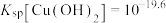 |
C.a点时,③中 与②中M的关系为 与②中M的关系为 |
D. 、 、 固体均易溶解于HX溶液 固体均易溶解于HX溶液 |
您最近半年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】在某温度时,将nmol/L的氨水滴入10mL0.1mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是


| A.a点KW=1.0×10-14 |
| B.水的电离程度:b>c>a>d |
| C.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| D.25℃时,一水合氨的电离平衡常数为10-7/(10n-1)(用n表示) |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐1】已知25℃时有关弱酸的电离常数如表所示:

则下列说法中正确的是

则下列说法中正确的是
| A.相同物质的量浓度溶液的pH大小比较:Na2B>NaA>NaHB |
| B.NaHB溶液中部分微粒浓度的大小比较:c(Na+)>c(HB-)>c(H2B)>c(B2-) |
| C.将a mol·L-1的HA溶液与a mol·L-1的NaA溶液等体积混合,混合液中的c(Na+)>c(A-) |
| D.向Na2B溶液中加入足量的HA溶液,发生反应的离子方程式为:B2-+2HA=2A-+H2B |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】下列实验操作正确且能达到实验目的的是
选项 | 实验操作 | 实验目的 |
A | 将 溶液置于蒸发皿中加热蒸干 溶液置于蒸发皿中加热蒸干 | 由 溶液制得 溶液制得 固体 固体 |
B | 取1mL KI溶液,加入5mL KI溶液,加入5mL 溶液,萃取分液后,向水层中滴入KSCN溶液 溶液,萃取分液后,向水层中滴入KSCN溶液 | 溶液变红色,说明 和 和 所发生的反应为可逆反应 所发生的反应为可逆反应 |
C | 用pH试纸测 溶液 溶液 , , 溶液 溶液 | 判断 和 和 酸性强弱 酸性强弱 |
D | 常温下测得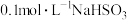 溶液的pH约为5 溶液的pH约为5 | 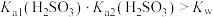 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】部分弱酸的电离平衡常数数据如下表,则下列选项正确的是
| 弱电解质 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7Ka2=5.6×10-11 |
| A.向NaCN溶液中通入CO2发生反应:2CN-+H2O+CO2=2HCN+CO32- |
| B.相同物质的量浓度的HCOONa、NaCN、Na2CO3溶液,pH值大小为:NaCN>Na2CO3>HCOONa |
| C.等体积等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
| D.中和等体积、等pH的HCOOH和HCN,消耗NaOH的物质的量前者大于后者 |
您最近半年使用:0次


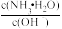 不断增大
不断增大

