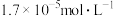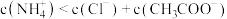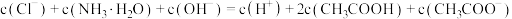常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )

| A.M点溶液中水的电离程度比原溶液小 |
| B.在M点时,n(OH-)-n(H+)=(a-0.05)mol |
C.随着NaOH的加入,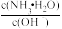 不断增大 不断增大 |
| D.当n(NaOH)=0.05mol时,溶液中有:c(Cl-)> c(NH4+)>c(Na+)>c(OH-)>c(H+) |
更新时间:2019-04-18 17:48:50
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】某实验小组用如下实验测定海带预处理后所得溶液的碘含量,实验步骤及现象如下:
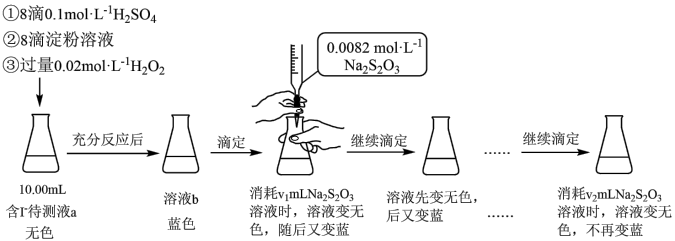
已知:I2+2Na2S2O3=2NaI+Na2S4O6,下列说法不正确 的是:

已知:I2+2Na2S2O3=2NaI+Na2S4O6,下列说法
| A.溶液b为蓝色是因为发生了反应:H2O2+2I-+2H+=I2+2H2O |
| B.该实验可证明蓝色恢复与空气无关 |
| C.溶液反复由无色变蓝的原因可能是H2O2氧化I-的反应速率比Na2S2O3还原I2的反应速率快 |
| D.上述实验不能准确测定待测液中的碘含量,应补充实验步骤:滴定前向溶液b中加少量MnO2,反应至不再产生气泡,过滤,对滤液进行滴定 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】电解质溶液电导率越大导电能力越强。常温下用0.100 mol/L盐酸分别滴定10.00mL浓度均为0.100mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb=1.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是
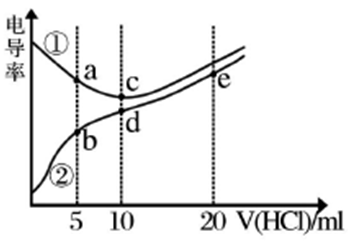

| A.a、d、e三点的溶液中,水的电离程度最大的是d点 |
| B.溶液温度c点高于d点 |
| C.b点溶液中:c[(CH3)2NH2+] +c[(CH3)2NH·H2O]=2c(Cl-) |
| D.d点溶液中: c(H+) + c[(CH3)2NH·H2O]=c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】HA是一元弱酸,微溶盐 的饱和溶液中
的饱和溶液中 随
随 而变化,
而变化, 不发生水解。25℃时,实验测得pM与
不发生水解。25℃时,实验测得pM与 的关系如图所示,其中a点对应的pH=5.0.[已知:
的关系如图所示,其中a点对应的pH=5.0.[已知: ,
,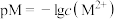 ,
,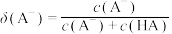 ]。下列说法正确的是
]。下列说法正确的是
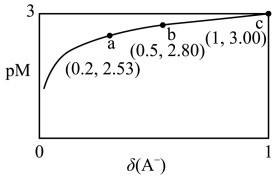
 的饱和溶液中
的饱和溶液中 随
随 而变化,
而变化, 不发生水解。25℃时,实验测得pM与
不发生水解。25℃时,实验测得pM与 的关系如图所示,其中a点对应的pH=5.0.[已知:
的关系如图所示,其中a点对应的pH=5.0.[已知: ,
,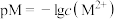 ,
,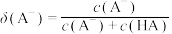 ]。下列说法正确的是
]。下列说法正确的是
A.25℃时,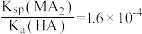 |
B.25℃时,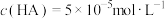 |
C.25℃时,b点溶液中, |
| D.a、b、c三点溶液中水的电离程度:a>b>c |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
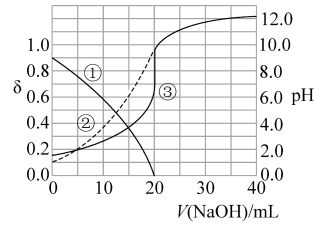
【推荐2】次磷酸(H3PO2)是一种精细磷化工产品。常温下,某实验小组以酚酞为指示剂,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的次磷酸(H3PO2)溶液。溶液pH、所有含磷微粒的分布系数δ随滴加NaOH溶液体积V(NaOH)的变化关系如图所示[比如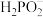 的分布系数:
的分布系数: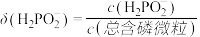 ],下列叙述正确的是
],下列叙述正确的是
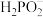 的分布系数:
的分布系数: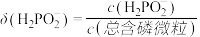 ],下列叙述正确的是
],下列叙述正确的是
A.曲线①代表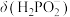 ,曲线②代表 ,曲线②代表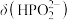 |
| B.NaH2PO2是酸式盐,其水溶液显碱性 |
C.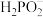 水解常数Kh≈1.0×10-9 水解常数Kh≈1.0×10-9 |
D.当滴定至中性时,溶液中存在: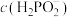 +c(H3PO2)>c(Na+) +c(H3PO2)>c(Na+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
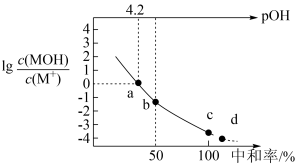
【推荐3】MOH是一种一元弱碱,常温下,向20mL0.5mol·L-1的MOH溶液中滴加浓度为0.25mol·L-1的HCl溶液,溶液中lg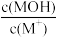 、pOH[pOH=-lgc(OH-)]、中和率(中和率=
、pOH[pOH=-lgc(OH-)]、中和率(中和率= )的变化如图所示。下列说法正确的是
)的变化如图所示。下列说法正确的是
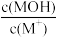 、pOH[pOH=-lgc(OH-)]、中和率(中和率=
、pOH[pOH=-lgc(OH-)]、中和率(中和率= )的变化如图所示。下列说法正确的是
)的变化如图所示。下列说法正确的是
| A.a点时,c(MOH)+c(M+)<2c(Cl-) |
| B.b点时,pOH>7 |
| C.b点时,2c(H+)+c(M+)=2c(OH-)+c(MOH) |
| D.溶液中M+物质的量的大小:d<c |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )
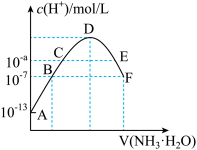

| A.NaHB溶液可能为酸性,也可能为碱性 |
| B.A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大 |
| C.E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+) |
| D.F点溶液c(NH4+)=2c(B2-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】已知磷与砷同主族。二者最高价含氧酸酸性:H3PO4强于砷酸(H3AsO4),25℃时,向10 mL 0.1 mol/L H3AsO4水溶液中滴加0.1mol/LNaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。下列说法正确的是
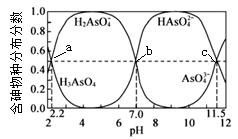

A.pH为9的溶液中c(H2AsO )/c(H3AsO4)=108.8 )/c(H3AsO4)=108.8 |
B.b点溶液中c(Na+)=3c(H2AsO )+3c(AsO )+3c(AsO ) ) |
C.图中任意一点均有c(H2AsO )+c(AsO )+c(AsO )+c(H3AsO4)+c(HAsO )+c(H3AsO4)+c(HAsO )=0.1 mol/L )=0.1 mol/L |
| D.如果将砷酸溶液换成等浓度的磷酸溶液进行滴定,则a点位置向右侧移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】下列有关说法正确的是
| A.醋酸溶液中:c(CH3COO-) + c(H+) = c(OH-) |
| B.向10 mL 0.10 mol·L-1醋酸溶液中加入10 mL 0.10 mol·L-1氢氧化钠溶液,溶液中离子浓度的大小顺序是:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.室温下,盐酸中c(Cl-) 与醋酸溶液中c(CH3COO-) 相等,则两溶液的pH相等 |
| D.中和相同物质的量浓度的盐酸和醋酸溶液,消耗氢氧化钠的物质的量相同 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】向0. 10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f与混合液pH的关系如图所示。下列说法正确的是( )
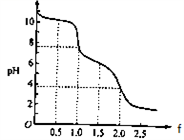

| A.f=0时,溶液中:c(Na+)=2c(CO32-) |
| B.f=0.5时,溶液中:2c(Cl-)=c(HCO3-)+c(CO32-)+ c(H2CO3) |
| C.f= 1时,溶液中:c(Cl-) > c(HCO3-)> c(CO32-)> c(H2CO3) |
| D.f=2时,溶液中:c(H2CO3) > c(HCO3-)> c(H+)> c(OH-) |
您最近一年使用:0次

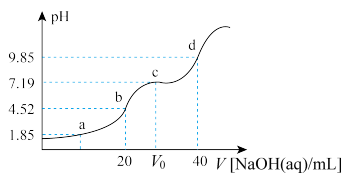

 溶液滴定25mL 0.25
溶液滴定25mL 0.25 溶液,加入的
溶液,加入的 时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的
时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的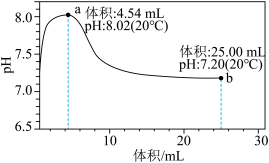
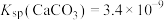 ,
,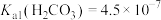 ,
,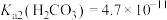 。
。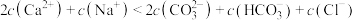
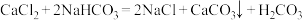
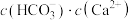 的数量级为
的数量级为
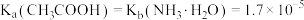 。向
。向 浓度均为
浓度均为 盐酸和醋酸的混合溶液中逐滴加入
盐酸和醋酸的混合溶液中逐滴加入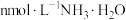 溶液,溶液电导率、
溶液,溶液电导率、 随氨水体积的变化如图。下列说法错误的是
随氨水体积的变化如图。下列说法错误的是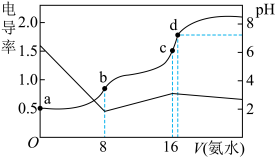
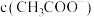 约为
约为