二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00molCO2和2.0 mol H2以及催化剂发生反应:CO2(g)+H2 (g) HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
(1)比较实验温度T1___ T2(填“>”、“<”),该反应的ΔH___ 0(填“>”、“=”、“<”)。
(2)实验I中0~60 min内用HCOOH表示的该反应的平均反应速率为_____ 。
(3)实验Ⅱ反应开始时体系压强为P0,第90min时体系压强为Pl,则Pl∶P0=___ 。
(4)比较实验I、Ⅱ在80min时的逆反应速率大小vl___ vⅡ(填“>”、“<”或“无法判断”),原因是_____ 。
 HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:| 60 min | 90 min | 120 min | 150 min | 180 min | ||
| 实验I | Tl/K | 1.50 mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
| 实验Ⅱ | T2/K | 1.45 mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)比较实验温度T1
(2)实验I中0~60 min内用HCOOH表示的该反应的平均反应速率为
(3)实验Ⅱ反应开始时体系压强为P0,第90min时体系压强为Pl,则Pl∶P0=
(4)比较实验I、Ⅱ在80min时的逆反应速率大小vl
更新时间:2019-09-04 11:24:33
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】烃基异构化是当前环保的急切要求,正戊烷异构化为异戊烷的热化学方程式是: CH3CH2CH2CH2CH3 CH3CH(CH3)CH2CH3△H=-7.1 kJ·mol-1
CH3CH(CH3)CH2CH3△H=-7.1 kJ·mol-1
(1)正戊烷异构化反应选择的温度条件是____________ 。
(2)由于副反应较为复杂,提高产率的最佳方法是____________ 。
(3)如果提高温度,反应速率___________ ,转化率___________ (填“升高"“不变”或“降低” ),同时还会产生积炭现象,假如在反应物中掺入一定量水,则可以减弱这种现象,理由是___________ (用化学方程式表示)。
(4)在573 K时,正戊烧转化率为54%,则此时平衡常数为___________ (保留两位有效数字)。
 CH3CH(CH3)CH2CH3△H=-7.1 kJ·mol-1
CH3CH(CH3)CH2CH3△H=-7.1 kJ·mol-1(1)正戊烷异构化反应选择的温度条件是
(2)由于副反应较为复杂,提高产率的最佳方法是
(3)如果提高温度,反应速率
(4)在573 K时,正戊烧转化率为54%,则此时平衡常数为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】复合催化是工业合成甲醇( )的重要反应,其原理为
)的重要反应,其原理为 。在2 L密闭容器中,充入
。在2 L密闭容器中,充入 和
和 ,在催化剂、
,在催化剂、 的条件下发生反应。部分反应物和产物随时间变化如图所示:
的条件下发生反应。部分反应物和产物随时间变化如图所示:

(1)写出 分子的电子式为
分子的电子式为___________ 。 分子的空间构型是
分子的空间构型是___________ (填选项编号)
A.三角锥形 B.直线形 C.平面形 D.正四面体
(2)反应开始至2 min末,以 的浓度变化表示该反应的平均速率是
的浓度变化表示该反应的平均速率是___________  。
。
(3)已知:某反应物A的平衡转化率 ,当反应达到平衡时,
,当反应达到平衡时, 的转化率是___________(填选项编号)
的转化率是___________(填选项编号)
(4)下列情况不能说明该反应达到化学平衡状态的是___________(填选项编号)。
(5)选择工业生产的适宜条件时需考虑既“快”又“多”地生成产物。
①在不改变上述反应条件(催化剂、温度、容积)前提下,要增大反应速率,还可以采取的措施是___________ (任写一种)。
②该合成甲醇的反应为放热反应,则有利于提高甲醇平衡转化率的条件是___________ (填选项编号)。
A.高温高压 B.低温高压 C.高温低压 D.低温低压
 )的重要反应,其原理为
)的重要反应,其原理为 。在2 L密闭容器中,充入
。在2 L密闭容器中,充入 和
和 ,在催化剂、
,在催化剂、 的条件下发生反应。部分反应物和产物随时间变化如图所示:
的条件下发生反应。部分反应物和产物随时间变化如图所示:
(1)写出
 分子的电子式为
分子的电子式为 分子的空间构型是
分子的空间构型是A.三角锥形 B.直线形 C.平面形 D.正四面体
(2)反应开始至2 min末,以
 的浓度变化表示该反应的平均速率是
的浓度变化表示该反应的平均速率是 。
。(3)已知:某反应物A的平衡转化率
 ,当反应达到平衡时,
,当反应达到平衡时, 的转化率是___________(填选项编号)
的转化率是___________(填选项编号)| A.20% | B.40% | C.60% | D.80% |
A.单位时间内消耗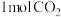 ,同时生成 ,同时生成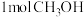 |
B. 的物质的量保持不变 的物质的量保持不变 |
C.密闭容器中 不发生变化时 不发生变化时 |
| D.密闭容器内气体压强不发生变化时 |
①在不改变上述反应条件(催化剂、温度、容积)前提下,要增大反应速率,还可以采取的措施是
②该合成甲醇的反应为放热反应,则有利于提高甲醇平衡转化率的条件是
A.高温高压 B.低温高压 C.高温低压 D.低温低压
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】过氧乙酸( CH3COOOH)是一种高效消毒剂,常温下易分解,可由乙酸与H2O2在硫酸催化下反应制得,化学方程式为CH3COOH(aq)+H2O2(aq) CH3COOOH(aq)+H2O(l)。
CH3COOOH(aq)+H2O(l)。
(1)该反应的能量变化如图所示。

①该反应为____________ (填“放热” 或“吸热”)反应。
②制备38 g CH3COOOH时,热量变化为6.85 kJ,则E =________ 。
(2)取a g冰醋酸和a g 50% H2O2混合均匀,加入一定量硫酸,测得混合溶液的体积为2 L。在25 °C时,测得不同时刻,溶液中的n(CH3COOOH)变化如图所示(反应前后溶液体积变化忽略不计)。
①0 ~6 h内,v(CH3COOOH)=______ 。
②若反应前后溶液的质量没有发生变化,则反应进行到6 h时,H2O2的转化率为____ 。
③若在40 °C下进行该实验,测得不同时刻n(CH3COOOH)均有所降低,可能的原因为____________ 。
 CH3COOOH(aq)+H2O(l)。
CH3COOOH(aq)+H2O(l)。(1)该反应的能量变化如图所示。

①该反应为
②制备38 g CH3COOOH时,热量变化为6.85 kJ,则E =
(2)取a g冰醋酸和a g 50% H2O2混合均匀,加入一定量硫酸,测得混合溶液的体积为2 L。在25 °C时,测得不同时刻,溶液中的n(CH3COOOH)变化如图所示(反应前后溶液体积变化忽略不计)。
①0 ~6 h内,v(CH3COOOH)=
②若反应前后溶液的质量没有发生变化,则反应进行到6 h时,H2O2的转化率为
③若在40 °C下进行该实验,测得不同时刻n(CH3COOOH)均有所降低,可能的原因为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法I.氨热分解法制氢气
相关化学键的键能数据
在一定温度下,利用催化剂将NH3分解为N2和H2。回答下列问题:
(1)反应2NH3(g) N2(g)+3H2(g) ∆H=
N2(g)+3H2(g) ∆H=___________ kJ/mol;
(2)已知该反应的∆S=198.9J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填标号);(T(K)=t(℃)+273.15)
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
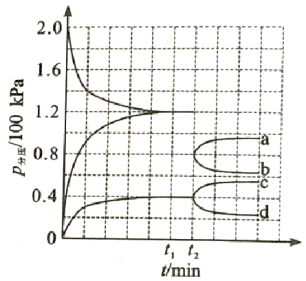
①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~ t1时间内的反应速率v(H2)=___________ mol·L-1·min-1 (用含t1的代数式表示);
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由是___________ ;
③在该温度下,反应的标准平衡常数KΘ=___________ 。
(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g)
gG(g)+hH(g)
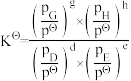 ,其中pΘ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pΘ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。
(4)NH3用途广泛,写出基于其物理性质的一种用途:___________ 。
方法I.氨热分解法制氢气
相关化学键的键能数据
| 化学键 | N≡N | H-H | N-H |
| 键能E/(kJ·mol-1) | 946 | 436.0 | 390.8 |
(1)反应2NH3(g)
 N2(g)+3H2(g) ∆H=
N2(g)+3H2(g) ∆H=(2)已知该反应的∆S=198.9J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填标号);(T(K)=t(℃)+273.15)
| A.25℃ | B.125℃ | C.225℃ | D.325℃ |

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~ t1时间内的反应速率v(H2)=
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
③在该温度下,反应的标准平衡常数KΘ=
(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)
 gG(g)+hH(g)
gG(g)+hH(g)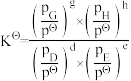 ,其中pΘ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pΘ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。(4)NH3用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次


 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:

