A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素。A、C两元素可形成原子个数之比为2∶1、1∶1型化合物。B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。F元素的最外层电子数是次外层电子数的0.75倍。请回答:
(1)D与F形成D2F的电子式为______________ ;A、C、D三种元素组成的化合物含有化学键的类型是________________ ;
(2)由E、F两种元素组成的化合物1 mol跟由A、C、D三种元素组成的化合物的溶液发生反应,消耗后者物质的量最大值为___________ mol。
(3)A、C、F间形成的甲、乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式为_________________________________ 。
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1 mol A2C和1 mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相同)。下列说法正确的是________________ 。
(1)D与F形成D2F的电子式为
(2)由E、F两种元素组成的化合物1 mol跟由A、C、D三种元素组成的化合物的溶液发生反应,消耗后者物质的量最大值为
(3)A、C、F间形成的甲、乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式为
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1 mol A2C和1 mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相同)。下列说法正确的是________________ 。
| A.达到平衡所需要的时间:Ⅰ>Ⅱ | B.达到平衡后A2C的转化率:Ⅰ=Ⅱ |
| C.达到平衡后BC的物质的量:Ⅰ>Ⅱ | D.达到平衡后A2的体积分数:Ⅰ<Ⅱ |
| E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ | F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ |
11-12高二上·四川·期末 查看更多[2]
更新时间:2016-12-09 02:38:25
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】1.氮的氧化物 如
如 、
、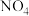 、
、 等
等 应用很广,在一定条件下可以相互转化.
应用很广,在一定条件下可以相互转化.
(1)从 可通过电解或臭氧氧化
可通过电解或臭氧氧化 的方法制备.电解装置如图1所示
的方法制备.电解装置如图1所示 隔膜用于阻止水分子通过
隔膜用于阻止水分子通过 ,其阳极反应式为
,其阳极反应式为______ .

已知:
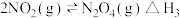
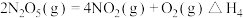
则反应 的
的
______ .
(2)从 在一定条件下发生分解:
在一定条件下发生分解: 某温度下测得恒容密闭容器中
某温度下测得恒容密闭容器中 浓度随时间的变化如下表:
浓度随时间的变化如下表:
设反应开始时体系压强为 ,第
,第 时体系压强为p,则p:
时体系压强为p,则p: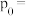
______ ; 内,
内, 的平均反应速率为
的平均反应速率为______ .
(3)从 与
与 之间存在反应
之间存在反应 将一定量的
将一定量的 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率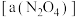 随温度变化如图2所示.
随温度变化如图2所示.

 图中a点对应温度下,已知
图中a点对应温度下,已知 的起始压强
的起始压强 为108kPa,列式计算该温度下反应的平衡常数
为108kPa,列式计算该温度下反应的平衡常数
______  用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数
物质的量分数 .
.
 由图推测
由图推测 是吸热反应还是放热反应,说明理由
是吸热反应还是放热反应,说明理由______ ,若要提高 转化率,除改变反应温度外,其他措施有
转化率,除改变反应温度外,其他措施有______  要求写出两条
要求写出两条 .
.
 对于反应
对于反应 ,在一定条件下
,在一定条件下 与
与 的消耗速率与自身压强间存在关系:
的消耗速率与自身压强间存在关系: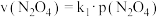 ,
, 其中,
其中, 、
、 是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,
是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是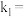
______ ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______ .

 如
如 、
、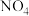 、
、 等
等 应用很广,在一定条件下可以相互转化.
应用很广,在一定条件下可以相互转化.(1)从
 可通过电解或臭氧氧化
可通过电解或臭氧氧化 的方法制备.电解装置如图1所示
的方法制备.电解装置如图1所示 隔膜用于阻止水分子通过
隔膜用于阻止水分子通过 ,其阳极反应式为
,其阳极反应式为
已知:

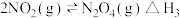
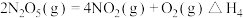
则反应
 的
的
(2)从
 在一定条件下发生分解:
在一定条件下发生分解: 某温度下测得恒容密闭容器中
某温度下测得恒容密闭容器中 浓度随时间的变化如下表:
浓度随时间的变化如下表: |  |  |  |  |  |  |
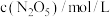 |  |  | 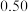 | 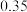 |  | 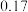 |
 ,第
,第 时体系压强为p,则p:
时体系压强为p,则p: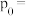
 内,
内, 的平均反应速率为
的平均反应速率为(3)从
 与
与 之间存在反应
之间存在反应 将一定量的
将一定量的 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率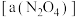 随温度变化如图2所示.
随温度变化如图2所示.
 图中a点对应温度下,已知
图中a点对应温度下,已知 的起始压强
的起始压强 为108kPa,列式计算该温度下反应的平衡常数
为108kPa,列式计算该温度下反应的平衡常数
 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数
物质的量分数 .
. 由图推测
由图推测 是吸热反应还是放热反应,说明理由
是吸热反应还是放热反应,说明理由 转化率,除改变反应温度外,其他措施有
转化率,除改变反应温度外,其他措施有 要求写出两条
要求写出两条 .
. 对于反应
对于反应 ,在一定条件下
,在一定条件下 与
与 的消耗速率与自身压强间存在关系:
的消耗速率与自身压强间存在关系: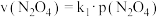 ,
, 其中,
其中, 、
、 是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,
是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是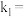

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) ΔH=−38.19kJ/mol
写出表示甲醇CH3OH(l)燃烧热的热化学方程式___________ 。
(2)甲醇可采用煤的气化、液化制取(CO+2H2 CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与
CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 的关系如图所示。
的关系如图所示。
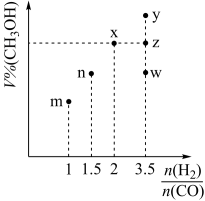
①当起始 =2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为
=2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为___________ ;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是___________ (填标号)
A.33% B.30% C.25% D.20%
②当 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________ 点(选填“y”、“z”或“w”)。
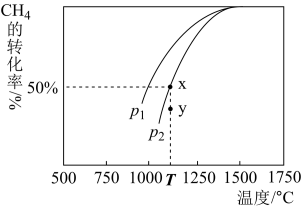
(3)制甲醇的CO和H2可用天然气来制取: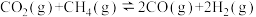 。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH
。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH___________ 0.(选填>、<或=,下同).当压强为p2时,在y点:V(正)___________ V(逆)。若p2=1.2Mpa,则T℃时该反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为 [反应Ⅰ]。
[反应Ⅰ]。
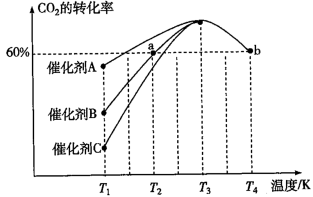
①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最低的反应所用的催化剂是___________ (填“A”、“B”或“C”)。
②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应 [反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是________ 。
(1)已知①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1③CH3OH(g)=CH3OH(l) ΔH=−38.19kJ/mol
写出表示甲醇CH3OH(l)燃烧热的热化学方程式
(2)甲醇可采用煤的气化、液化制取(CO+2H2
 CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与
CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 的关系如图所示。
的关系如图所示。
①当起始
 =2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为
=2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为A.33% B.30% C.25% D.20%
②当
 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的(3)制甲醇的CO和H2可用天然气来制取:
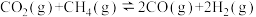 。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH
。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH
(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为
 [反应Ⅰ]。
[反应Ⅰ]。①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最低的反应所用的催化剂是

②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应
 [反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:| T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
(1)该反应的平衡常数表达式K=__________ 。该反应的正反应是______ 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,恒容、升高温度,原化学平衡向______ 反应方向移动(填“正”或“逆”),容器内混合气体的压强________ (填“增大”、“减小”或“不变”)。
(3)能判断该反应是否达到化学平衡状态的依据是( )
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有__________ (选填A、B、C、D)
 CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)该反应的平衡常数表达式K=
(2)某温度下,上述反应达到平衡后,恒容、升高温度,原化学平衡向
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一、
(1)将0.050 mol SO2和0.030 mol O2放入容积为1 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
①计算该条件下反应的平衡常数K=___________ 。
②已知:K(300℃)>K(350℃),该反应是___________ 热反应。若反应温度升高,SO2的转化率___________ (填“增大”、“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率( )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)___________ K(B)(填“>”、“<”或“=”,下同)。

(3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲___________ 乙。
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲___________ 乙。
(1)将0.050 mol SO2和0.030 mol O2放入容积为1 L的密闭容器中,反应2SO2(g)+O2(g)
 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。①计算该条件下反应的平衡常数K=
②已知:K(300℃)>K(350℃),该反应是
(2)某温度下,SO2的平衡转化率(
 )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)
(3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】已知丙烯(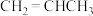 )、环丙烷(
)、环丙烷( )的燃烧热分别为
)的燃烧热分别为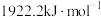 、
、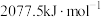 。
。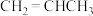 可表示为:
可表示为: ,
, 可表示为:
可表示为: ;环丙烷和丙烯有转化关系:
;环丙烷和丙烯有转化关系: (g)
(g)
 (g) ΔH
(g) ΔH
回答下列问题:
(1)燃烧热表示1mol纯物质完全燃烧生成稳定的化合物所释放出来的热,则 (g)转化为
(g)转化为 (g)的焓变
(g)的焓变
_______  。
。
(2)T℃时,向1L恒容的密闭容器中充入10mol环丙烷,反应过程中环丙烷的物质的量随时间的变化关系如下表所示:
①若起始时总压为 ,反应速率用单位时间内分压的变化表示,而某组分平衡分压=总压×该组分的物质的量分数,则40min内
,反应速率用单位时间内分压的变化表示,而某组分平衡分压=总压×该组分的物质的量分数,则40min内 (g)的反应速率v(
(g)的反应速率v( ,g)=
,g)=_______ 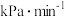 ;该反应的平衡常数
;该反应的平衡常数
_______ (用平衡分压代替平衡浓度来计算,保留两位有效数字)。
②若反应开始时只加入丙烯,且物质的量也为10mol,则平衡时,丙烯的转化率为_______ ;增大 的起始浓度,达平衡后
的起始浓度,达平衡后 的转化率将
的转化率将_______ (填“增大”、“减小”或“不变”)。
(3)一定条件下,通过 的催化加氢也可制得丙烯,某科研团队设计了如下工艺并成功制取了丙烯。
的催化加氢也可制得丙烯,某科研团队设计了如下工艺并成功制取了丙烯。

①反应炉中 催化加氢制取丙烯的化学方程式可表示为
催化加氢制取丙烯的化学方程式可表示为_______ 。
②T℃,当 和
和 分别以2mol/s、5mol/s的流速进入反应炉中进行反应,为了降低反应炉出口处
分别以2mol/s、5mol/s的流速进入反应炉中进行反应,为了降低反应炉出口处 的流速,结合工艺实际可采取的有效措施有
的流速,结合工艺实际可采取的有效措施有_______ 。(写出一条即可)
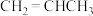 )、环丙烷(
)、环丙烷( )的燃烧热分别为
)的燃烧热分别为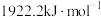 、
、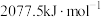 。
。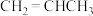 可表示为:
可表示为: ,
, 可表示为:
可表示为: ;环丙烷和丙烯有转化关系:
;环丙烷和丙烯有转化关系: (g)
(g)
 (g) ΔH
(g) ΔH回答下列问题:
(1)燃烧热表示1mol纯物质完全燃烧生成稳定的化合物所释放出来的热,则
 (g)转化为
(g)转化为 (g)的焓变
(g)的焓变
 。
。(2)T℃时,向1L恒容的密闭容器中充入10mol环丙烷,反应过程中环丙烷的物质的量随时间的变化关系如下表所示:
| 反应时间/min | 0 | 20 | 40 | 60 | 80 | ∞ |
| 环丙烷的物质的量/mol | 10 | 7.5 | 5.5 | 3.7 | 2.2 | 1.5 |
①若起始时总压为
 ,反应速率用单位时间内分压的变化表示,而某组分平衡分压=总压×该组分的物质的量分数,则40min内
,反应速率用单位时间内分压的变化表示,而某组分平衡分压=总压×该组分的物质的量分数,则40min内 (g)的反应速率v(
(g)的反应速率v( ,g)=
,g)=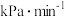 ;该反应的平衡常数
;该反应的平衡常数
②若反应开始时只加入丙烯,且物质的量也为10mol,则平衡时,丙烯的转化率为
 的起始浓度,达平衡后
的起始浓度,达平衡后 的转化率将
的转化率将(3)一定条件下,通过
 的催化加氢也可制得丙烯,某科研团队设计了如下工艺并成功制取了丙烯。
的催化加氢也可制得丙烯,某科研团队设计了如下工艺并成功制取了丙烯。
①反应炉中
 催化加氢制取丙烯的化学方程式可表示为
催化加氢制取丙烯的化学方程式可表示为②T℃,当
 和
和 分别以2mol/s、5mol/s的流速进入反应炉中进行反应,为了降低反应炉出口处
分别以2mol/s、5mol/s的流速进入反应炉中进行反应,为了降低反应炉出口处 的流速,结合工艺实际可采取的有效措施有
的流速,结合工艺实际可采取的有效措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下: (g)
(g)
 (g)+H2(g) ΔH=+17.6kJ·mol-1
(g)+H2(g) ΔH=+17.6kJ·mol-1
(1)该反应在___ 条件下能自发进行;既能提高该反应的速率又能提高乙苯的平衡转化率的单一措施 是___ 。
(2)工业上,通常在乙苯蒸气中掺混水蒸气,并让反应在恒压下进行。从平衡移动的角度说明这样操作的理由是___ 。
(3)当原料气中乙苯和水蒸气的物质的量之比为1∶4,反应在恒容容器中进行,测得容器总压P(总)和乙苯转化率α随时间变化结果如图所示。

已知:A物质的分压为P(A)= ×P(总)。
×P(总)。
回答下列问题:
①平衡时水的分压P(H2O)=___ kPa
②已知:v正=k正P(乙苯),v逆=k逆P(苯乙烯)×P(氢气),k正、k逆分别为正、逆反应速率常数。则: =
=___ kPa。
(4)在相同的温度和催化剂的情况下,amol乙苯在VL的恒容容器中发生反应。苯乙烯的浓度随时间的变化示意图如图。若其它条件不变,amol乙苯在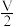 L的容器中发生该反应,在图中重新画出苯乙烯的浓度随时间的变化示意图
L的容器中发生该反应,在图中重新画出苯乙烯的浓度随时间的变化示意图___ 。

 (g)
(g)
 (g)+H2(g) ΔH=+17.6kJ·mol-1
(g)+H2(g) ΔH=+17.6kJ·mol-1(1)该反应在
(2)工业上,通常在乙苯蒸气中掺混水蒸气,并让反应在恒压下进行。从平衡移动的角度说明这样操作的理由是
(3)当原料气中乙苯和水蒸气的物质的量之比为1∶4,反应在恒容容器中进行,测得容器总压P(总)和乙苯转化率α随时间变化结果如图所示。

已知:A物质的分压为P(A)=
 ×P(总)。
×P(总)。回答下列问题:
①平衡时水的分压P(H2O)=
②已知:v正=k正P(乙苯),v逆=k逆P(苯乙烯)×P(氢气),k正、k逆分别为正、逆反应速率常数。则:
 =
=(4)在相同的温度和催化剂的情况下,amol乙苯在VL的恒容容器中发生反应。苯乙烯的浓度随时间的变化示意图如图。若其它条件不变,amol乙苯在
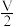 L的容器中发生该反应,在图中重新画出苯乙烯的浓度随时间的变化示意图
L的容器中发生该反应,在图中重新画出苯乙烯的浓度随时间的变化示意图
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是常用的食品调味剂。
回答下列问题:
(1)写出元素D在周期表中的位置____________________________________________ 。
(2)五种元素中,原子半径最大的是________ (填元素符号),非金属最强的是________ (填元素符号)。
(3)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是________ (用化学式表示)。
(4)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为________ ,其中存在的化学键类型为_______________ 和________________ 。
(5)单质E与水反应的离子方程式为____________________________________________
回答下列问题:
(1)写出元素D在周期表中的位置
(2)五种元素中,原子半径最大的是
(3)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是
(4)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为
(5)单质E与水反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】各城市为保持街道整洁、湿润,在路面或广场上喷洒含化学式为 的溶液作保湿剂。X原子的结构示意图为
的溶液作保湿剂。X原子的结构示意图为 ,X的阳离子与的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种
,X的阳离子与的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种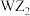 型分子。
型分子。
(1)m=___________ ,该保湿剂的化学式为___________ 。
(2)Z、W元素的名称为___________ 、___________ 。
(3)下列说法正确的是___________ (填字母)。
A. 和
和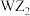 都为离子化合物
都为离子化合物
B. 分子中仅含离子键,
分子中仅含离子键,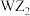 中仅含极性共价键
中仅含极性共价键
C. 比HY的稳定性强
比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是___________ (填字母)。
A. 的电子式:
的电子式:
B.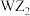 的结构式:Z-W-Z
的结构式:Z-W-Z
C. Y元素的单质与 水溶液反应的离子方程式为
水溶液反应的离子方程式为
D.用电子式表示 的形成过程为
的形成过程为

 的溶液作保湿剂。X原子的结构示意图为
的溶液作保湿剂。X原子的结构示意图为 ,X的阳离子与的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种
,X的阳离子与的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种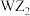 型分子。
型分子。(1)m=
(2)Z、W元素的名称为
(3)下列说法正确的是
A.
 和
和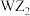 都为离子化合物
都为离子化合物B.
 分子中仅含离子键,
分子中仅含离子键,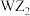 中仅含极性共价键
中仅含极性共价键C.
 比HY的稳定性强
比HY的稳定性强D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.
 的电子式:
的电子式:
B.
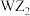 的结构式:Z-W-Z
的结构式:Z-W-ZC. Y元素的单质与
 水溶液反应的离子方程式为
水溶液反应的离子方程式为
D.用电子式表示
 的形成过程为
的形成过程为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】A、D、E、X、Y是原子序数依次增大的短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用。
(1)Y的离子结构示意图为_______________ 。
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有_____________ 。
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键。常温下甲是一种无色液体。
①甲是一种二元弱碱,写出其一级电离方程式:__________________ 。
②甲在碱性溶液中能够将CuO还原为Cu2O,已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:___________________________ 。
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1 g Y固体单质时放出8.4 kJ热量,此反应的热化学方程式为_______________________________ 。
(5)将0.050 mol YX2(g)和0.030 mol X2(g)放入容积为1 L的密闭容器中,反应: X2(g) +2YX2(g) 2YX3(g)在一定条件下达到平衡。
2YX3(g)在一定条件下达到平衡。
①若其他条件不变,增大体系的压强,平衡常数K______ (填“增大”、“减小”或“不变”)。
②平衡时测得c(X2)=0.010 mol·Lˉ1。该条件下反应的平衡常数K=__________ ,YX2的平衡转化率为_________________ 。
(1)Y的离子结构示意图为
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键。常温下甲是一种无色液体。
①甲是一种二元弱碱,写出其一级电离方程式:
②甲在碱性溶液中能够将CuO还原为Cu2O,已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1 g Y固体单质时放出8.4 kJ热量,此反应的热化学方程式为
(5)将0.050 mol YX2(g)和0.030 mol X2(g)放入容积为1 L的密闭容器中,反应: X2(g) +2YX2(g)
 2YX3(g)在一定条件下达到平衡。
2YX3(g)在一定条件下达到平衡。①若其他条件不变,增大体系的压强,平衡常数K
②平衡时测得c(X2)=0.010 mol·Lˉ1。该条件下反应的平衡常数K=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】下表为元素周期表的一部分,参照元素①~⑧在表中的位置,使用化学用语 回答下列问题:
(1)②的最高价氧化物的分子式为_______ ;③、⑥、⑧的简单离子半径由大到小的顺序为_______ 。
(2)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式_______ 。
(3)W是第四周期与⑦同主族的元素。推测元素W不可能具有的性质有_______(填字母序号)。
族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式
(3)W是第四周期与⑦同主族的元素。推测元素W不可能具有的性质有_______(填字母序号)。
| A.最高化合价为+4价 | B.最高价氧化物的水化物的酸性比硅酸弱 |
| C.气态氢化物很稳定 | D.单质在常温下可与氢气化合 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】X、Y、Z、M、Q、R均为前20号主族元素,其原子半径与化合价的关系如图所示。回答下列问题:

(1)上述六种元素中属于金属元素的有_______ (填元素符号)。
(2)Z元素在周期表中的位置是_______ 。
(3)Z、M、Q、R四种元素的最高价氧化物对应的水化物中酸性最强的是_______ (用化学符号表示,下同)。
(4)X、Y形成原子个数比为1∶1的化合物的电子式为_______ ,Y、Z两种元素形成的最简单氢化物中稳定性较强的是_______ 。
(5)由X、Y、Z三种元素中的两种组成的10电子微粒有多种,其中五核10电子的离子为_______ ,两核10电子的离子为_______ ,含有这两种离子的浓溶液反应的离子方程式为_______ 。
(6)Y、Z、M、Q四种元素的简单离子半径由大到小的顺序是_______ 。

(1)上述六种元素中属于金属元素的有
(2)Z元素在周期表中的位置是
(3)Z、M、Q、R四种元素的最高价氧化物对应的水化物中酸性最强的是
(4)X、Y形成原子个数比为1∶1的化合物的电子式为
(5)由X、Y、Z三种元素中的两种组成的10电子微粒有多种,其中五核10电子的离子为
(6)Y、Z、M、Q四种元素的简单离子半径由大到小的顺序是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】X、Y、Z、W均为短周期主族元素,X、Y、Z原子的最外层电子数之和为10,X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z,W的最外层电子数等于X的核外电子总数,且W单质常温下为固体。请回答下列问题:
(1)X、Y、Z三种元素对应的原子半径大小关系为___________ (填元素符号)。
(2)用电子式表示X的简单氢化物的形成过程___________ 。
(3)Y与X的最高价氧化物在点燃条件下的现象是剧烈燃烧,放出大量热,产生耀眼的白光,生成白色固体和黑色粉末,则该反应的化学方程式为___________ 。
(4)下列说法正确的是___________ 。
A.W的氢化物,所有原子均满足8e-稳定结构
B.最高价氧化物对应的水化物的酸性W>Z
C.由于Z的氧化物ZO2既可与酸反应,又能与碱反应,所以ZO2为两性氧化物
D.W的氧化物WO2,具有还原性,能使酸性KMnO4溶液褪色
(5)足量的单质Y与一定量的W的最高价氧化物对应的水化物的浓溶液,在一定条件下充分反应,所得气体的成分为___________ 。
(1)X、Y、Z三种元素对应的原子半径大小关系为
(2)用电子式表示X的简单氢化物的形成过程
(3)Y与X的最高价氧化物在点燃条件下的现象是剧烈燃烧,放出大量热,产生耀眼的白光,生成白色固体和黑色粉末,则该反应的化学方程式为
(4)下列说法正确的是
A.W的氢化物,所有原子均满足8e-稳定结构
B.最高价氧化物对应的水化物的酸性W>Z
C.由于Z的氧化物ZO2既可与酸反应,又能与碱反应,所以ZO2为两性氧化物
D.W的氧化物WO2,具有还原性,能使酸性KMnO4溶液褪色
(5)足量的单质Y与一定量的W的最高价氧化物对应的水化物的浓溶液,在一定条件下充分反应,所得气体的成分为
您最近一年使用:0次



