工业上利用焦炭与水蒸气生产H2的反应原理为C(s)+H2O(g)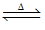 CO(g)+H2(g) ΔH>0;CO(g)+H2O(g)
CO(g)+H2(g) ΔH>0;CO(g)+H2O(g)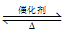 CO2(g)+H2(g) ΔH<0;第二步生产的原料CO来源于第一步的产物。为提高原料的利用率及H2的日产量,下列措施中不可取的是( )
CO2(g)+H2(g) ΔH<0;第二步生产的原料CO来源于第一步的产物。为提高原料的利用率及H2的日产量,下列措施中不可取的是( )
①第一步产生的混合气直接作为第二步的反应物
②第二步生产应采用适当的温度和催化剂
③第一、二步生产中均充入足量水蒸气
④第二步应在低温下进行
⑤第二步生产采用高压
⑥第二步生产中增大CO的浓度
 CO(g)+H2(g) ΔH>0;CO(g)+H2O(g)
CO(g)+H2(g) ΔH>0;CO(g)+H2O(g)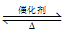 CO2(g)+H2(g) ΔH<0;第二步生产的原料CO来源于第一步的产物。为提高原料的利用率及H2的日产量,下列措施中不可取的是( )
CO2(g)+H2(g) ΔH<0;第二步生产的原料CO来源于第一步的产物。为提高原料的利用率及H2的日产量,下列措施中不可取的是( )①第一步产生的混合气直接作为第二步的反应物
②第二步生产应采用适当的温度和催化剂
③第一、二步生产中均充入足量水蒸气
④第二步应在低温下进行
⑤第二步生产采用高压
⑥第二步生产中增大CO的浓度
| A.①③⑤ | B.②④⑥ |
| C.②③⑤ | D.①④⑤⑥ |
2019高三·全国·专题练习 查看更多[1]
(已下线)专题7.2 化学平衡状态 化学平衡移动(讲)-《2020年高考一轮复习讲练测》
更新时间:2019-12-04 11:21:06
|
相似题推荐
【推荐1】一定温度下,在三个体积均为 的恒容密闭容器中发生反应:
的恒容密闭容器中发生反应:
下列说法正确的是
 的恒容密闭容器中发生反应:
的恒容密闭容器中发生反应:
| 容器编号 | 温度(℃) | 起始物质的量 | 平衡物质的量 | |||
 | 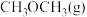 |  | 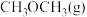 |  | ||
| ① | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| ② | 387 | 0.40 | 0 | 0 | a | A |
| ③ | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
| A.该反应的正反应为吸热反应 |
B.容器②反应达到平衡时, |
| C.若容器①中反应达到平衡时增大压强,则各物质浓度保持不变 |
D.若起始向容器①中充入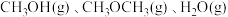 各 各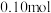 ,则反应将向正反应方向进行 ,则反应将向正反应方向进行 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】现将 2 mol 气体A 与 1 mol 气体B 充入一个体积不变的容器内,发生反应:2A+B ⇌ C+3D+4E,达到平衡后气体A 的浓度减少一半,发现有液体生成,在相同的温度下测得反应 前后压强分别为 6.06×106 Pa 和 8.08×106 Pa,又测得反应共放出热量 Q kJ,下列说法正确的是
| A.该反应在任何温度下都可自发进行 |
| B.在上述平衡体系中再加入 1 mol A 和 0.5 mol B,平衡正向移动,A 的转化率增大 |
| C.该反应的热化学方程式为 2A(g)+B(g) ⇌ C(g)+3D(l)+4E(g) ΔH= -Q kJ/mol |
| D.上述反应达到平衡后,其他的条件不变的情况下,升高温度,压强一定增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①实验室常用排饱和NaCl溶液的方法收集Cl2
②铁在潮湿的空气中易生锈
③对于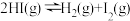 ,达平衡后,缩小容器体积可使体系颜色变深
,达平衡后,缩小容器体积可使体系颜色变深
④合成氨反应,为提高原料的转化率,理论上应采取降低温度的措施
⑤合成氨时将纸液化分离,可提高原料的转化率
①实验室常用排饱和NaCl溶液的方法收集Cl2
②铁在潮湿的空气中易生锈
③对于
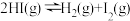 ,达平衡后,缩小容器体积可使体系颜色变深
,达平衡后,缩小容器体积可使体系颜色变深④合成氨反应,为提高原料的转化率,理论上应采取降低温度的措施
⑤合成氨时将纸液化分离,可提高原料的转化率
| A.①④ | B.②③ | C.②⑤ | D.②③⑤ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】将E(s)和F(g)加入密闭容器中,在一定条件下发生反应E(s)+4F(g) G(g),已知该反应的平衡常数如表所示。下列说法正确的是
G(g),已知该反应的平衡常数如表所示。下列说法正确的是
 G(g),已知该反应的平衡常数如表所示。下列说法正确的是
G(g),已知该反应的平衡常数如表所示。下列说法正确的是| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A.上述反应是熵增反应 |
B.25℃时,反应G(g) E(s)+4F(g)的平衡常数是0.5 E(s)+4F(g)的平衡常数是0.5 |
| C.在80℃时,测得某时刻F、G的浓度均为0.5mol·L-1,则此时v正>v逆 |
| D.恒温恒容下,向容器中再充入少量G(g),达到新平衡时,G的体积百分含量将增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】向恒温恒容密闭容器中加入足量的Fe2O3(s)和CO(g),发生反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H>0,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
2Fe(s)+3CO2(g) △H>0,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
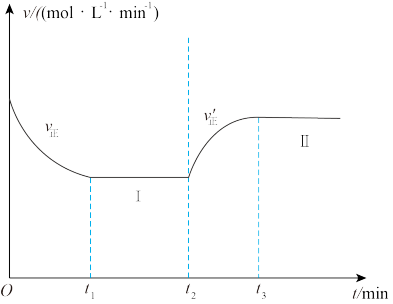
 2Fe(s)+3CO2(g) △H>0,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
2Fe(s)+3CO2(g) △H>0,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
| A.该反应在常温下能自发进行 |
| B.容器中气体变化的质量与固体变化的质量相等时达到平衡状态 |
| C.混合气体的平均相对分子质量不变时达到平衡状态 |
| D.t2时改变的条件是升高温度 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】解释下列事实的离子方程式书写错误的是
A.将二氧化硫通入硝酸钡溶液中,产生白色沉淀: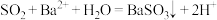 |
B.用氢氧化钠溶液吸收氯气: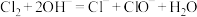 |
C.将氯化铜溶液加热,溶液由蓝色变为绿色: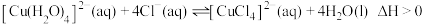 |
D.用碳酸钠溶液处理水垢中的硫酸钙: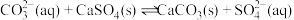 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】密闭容器中进行的可逆反应:

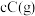 在不同温度(
在不同温度( 和
和 )及压强(
)及压强( 和
和 )下,混合气体中B的质量分数W(B)与反应时间(t)的关系如图所示。下列判断正确的是
)下,混合气体中B的质量分数W(B)与反应时间(t)的关系如图所示。下列判断正确的是



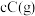 在不同温度(
在不同温度( 和
和 )及压强(
)及压强( 和
和 )下,混合气体中B的质量分数W(B)与反应时间(t)的关系如图所示。下列判断正确的是
)下,混合气体中B的质量分数W(B)与反应时间(t)的关系如图所示。下列判断正确的是
A. , ,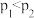 , ,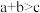 ,正反应为吸热反应 ,正反应为吸热反应 |
B. ,P1< P2, ,P1< P2,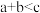 ,正反应为放热反应 ,正反应为放热反应 |
C. , ,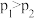 , ,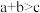 ,正反应为放热反应 ,正反应为放热反应 |
D. , ,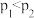 , ,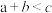 ,正反应为吸热反应 ,正反应为吸热反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】对于可逆反应N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),要增大氨气产率,下列说法中不正确的是( )
2NH3(g)(正反应为放热反应),要增大氨气产率,下列说法中不正确的是( )
 2NH3(g)(正反应为放热反应),要增大氨气产率,下列说法中不正确的是( )
2NH3(g)(正反应为放热反应),要增大氨气产率,下列说法中不正确的是( )| A.恒容时,增加氮气的物质的量 | B.降低温度 |
| C.增大压强 | D.升高温度 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】化学常用图像直观地描述化学反应的进程或结果。下列与NH3有关的图像描述正确的是


A.图①表示 在t1时刻扩大容器体积,v逆随时间变化的曲线 在t1时刻扩大容器体积,v逆随时间变化的曲线 |
B.图②表示 平衡时NH3体积分数随起始 平衡时NH3体积分数随起始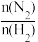 变化的曲线,则转化率:aA(H2)=aB(H2) 变化的曲线,则转化率:aA(H2)=aB(H2) |
| C.图③表示25℃时分别稀释pH=1的NaOH溶液和氨水时溶液pH的变化,曲线Ⅰ表示氨水 |
| D.图④可表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 |
您最近一年使用:0次

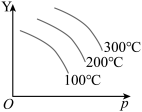
 (正反应吸热)有如下图所示的变化,图中Y轴可能表示
(正反应吸热)有如下图所示的变化,图中Y轴可能表示