氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],随着环境酸度的改变n随之改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
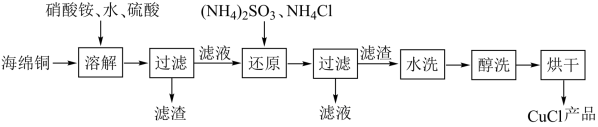
(1)过滤用到的玻璃仪器有烧杯、玻璃棒、________ 。
(2)还原过程中发生的主要反应的离子方程式:__________ ,若将(NH4)2SO3换成铁粉也可得到CuCl,写出离子方程式___________ 。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。真空干燥、密封包装的原因是:______________________________ 。
(4)随着PH值减小[Cu2(OH)4-nCln]中Cu%________ 。(填字母)
A. 增大 B.不变 C. 不能确定 D. 减小
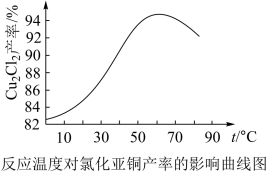
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响。由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃ 时,CuCl产率会下降,从生成物的角度分析,其原因可能是_____ 。
(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:______ 。

(1)过滤用到的玻璃仪器有烧杯、玻璃棒、
(2)还原过程中发生的主要反应的离子方程式:
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。真空干燥、密封包装的原因是:
(4)随着PH值减小[Cu2(OH)4-nCln]中Cu%
A. 增大 B.不变 C. 不能确定 D. 减小
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响。由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃ 时,CuCl产率会下降,从生成物的角度分析,其原因可能是
(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:
更新时间:2019-12-13 16:51:09
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
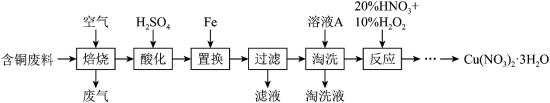
【推荐1】硝酸铜是一种重要的化工原料,可由工业含铜废料制备,含铜废料的主要成分为Cu、CuS、CuSO4等,制备流程如图所示:
(1)“焙烧”时,CuS与空气中的O2反应生成CuO和SO2,该反应的化学方程式为_______ ,提高“焙烧”效率的方法为_______ 。(任写一种)
(2)“过滤”所得滤液中溶质的主要成分为_______ 。
(3)①“淘洗”所用时溶液A可以是_______ 。(填标号)。
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.㳖硫酸
②如何证明“淘洗”已完全_______ 。
(4)“反应”阶段所用的试剂是20%的HNO3溶液和10%的H2O2溶液,反应过程中无红棕色气体生成。
①理论上反应所消耗的H2O2和HNO3的物质的量之比为_______ 。
②若不加10%的H2O2溶液,只用20%的HNO3溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为_______ 。
(5)某工厂用m1kg上述工业含铜废料(含铜元素80%)制备Cu(NO3)2•3H2O,最终得到产品m2kg,产率为_______ 。(分数化为最简)
(1)“焙烧”时,CuS与空气中的O2反应生成CuO和SO2,该反应的化学方程式为
(2)“过滤”所得滤液中溶质的主要成分为
(3)①“淘洗”所用时溶液A可以是
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.㳖硫酸
②如何证明“淘洗”已完全
(4)“反应”阶段所用的试剂是20%的HNO3溶液和10%的H2O2溶液,反应过程中无红棕色气体生成。
①理论上反应所消耗的H2O2和HNO3的物质的量之比为
②若不加10%的H2O2溶液,只用20%的HNO3溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
(5)某工厂用m1kg上述工业含铜废料(含铜元素80%)制备Cu(NO3)2•3H2O,最终得到产品m2kg,产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2) 为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑ 该反应的氧化剂是
6Cu+SO2↑ 该反应的氧化剂是________________ ,验证SO2的方法是________________ 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜。温度控制在50℃~60℃的原因有:①加快反应速率;②___________ 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,可生成CuC1沉淀,写出生成CuCl的离子方程式______________ 。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
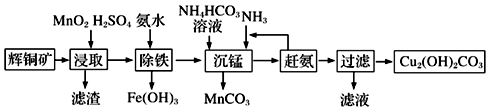
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________ 。
②浸取过程中可得到一种黄色单质,写出浸取时主要反应的化学方程式___________ 。
③“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________ mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
(1)工业上以黄铜矿(CuFeS2) 为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2↑ 该反应的氧化剂是
6Cu+SO2↑ 该反应的氧化剂是(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜。温度控制在50℃~60℃的原因有:①加快反应速率;②
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:

①辉铜矿在浸取前要富集与粉碎,粉碎的好处是
②浸取过程中可得到一种黄色单质,写出浸取时主要反应的化学方程式
③“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】CuCl2是常见的化学试剂,某学习小组利用废铜屑“湿法”制备CuCl2·2H2O。
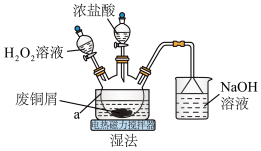
氯化铜在不同温度下结晶形成的结晶水合物,回答下列问题:
(1)仪器a的名称为___________ ,NaOH溶液的作用是___________ 。
(2)“湿法”制备CuCl2的离子方程式为___________ ,实验中,H2O2的实际用量要大于理论用量,原因是___________ 。
(3)为得到纯净的 晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,
晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,___________ ,过滤,洗涤,低温干燥。其中,持续通入HCl的作用是___________ 。

氯化铜在不同温度下结晶形成的结晶水合物,回答下列问题:
| 温度 | 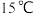 以下 以下 | 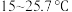 | 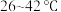 |  以上 以上 |
| 结晶水合物 | 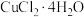 |  |  | 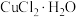 |
(2)“湿法”制备CuCl2的离子方程式为
(3)为得到纯净的
 晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,
晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=_______ kJ/mol。
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。
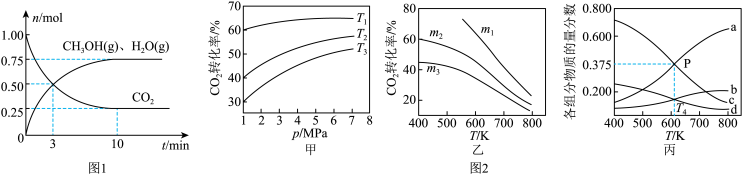
①从反应开始到平衡,氢气的平均反应速率v(H2)=_______ 。
②下列措施不能使CO2的平衡转化率增大的是_______ (填序号)。
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m= 。通过实验得到如图2所示图象。
。通过实验得到如图2所示图象。
①图甲中投料比相同,温度从高到低的顺序为_______ 。
②图乙中m1、m2、m3从大到小的顺序为_______ 。
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
Ⅱ.甲醇的应用
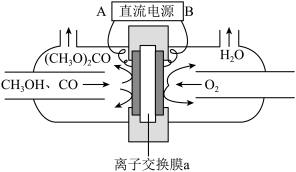
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为_______ (填“阳膜”或“阴膜”),阳极的电极反应式为_______ 。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施不能使CO2的平衡转化率增大的是
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m=
 。通过实验得到如图2所示图象。
。通过实验得到如图2所示图象。①图甲中投料比相同,温度从高到低的顺序为
②图乙中m1、m2、m3从大到小的顺序为
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为
Ⅱ.甲醇的应用
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】MnO2在电池、玻璃、有机合成等工业生产中应用广泛。利用粗MnO2(含有杂质MnO和MnCO3)制取纯MnO2的流程如下:

请回答下列问题:
(1)为加快酸浸速率可采取的措施有______________________________________ (答两点)。酸浸过程中稀硫酸可否用盐酸代替,回答并说明理由_________________________ 。
(2)操作X的名称是____________ 。氧化过程反应的离子方程式是________________ 。
(3)加热条件下Cl2与NaOH溶液反应,其氧化产物和还原产物的物质的量之比为________ 。
(4)酸浸过程中得到的溶液所含主要溶质为____________ ,电解该溶液也可制得MnO2和H2,写出该电解过程中阳极的电极反应式________________________________ 。
(5)MnO2常用作某些化学反应的催化剂。下图为2H2O2=2H2O+O2↑反应过程中的能量变化示意图,下列说法正确的是__________ 。
a.该反应为吸热反应,热效应为△H
b.反应历程b有催化剂参加
c.有催化剂时,该反应的活化能为E1+E2
d.改变催化剂,可改变该反应的活化能

请回答下列问题:
(1)为加快酸浸速率可采取的措施有
(2)操作X的名称是
(3)加热条件下Cl2与NaOH溶液反应,其氧化产物和还原产物的物质的量之比为
(4)酸浸过程中得到的溶液所含主要溶质为
(5)MnO2常用作某些化学反应的催化剂。下图为2H2O2=2H2O+O2↑反应过程中的能量变化示意图,下列说法正确的是

a.该反应为吸热反应,热效应为△H
b.反应历程b有催化剂参加
c.有催化剂时,该反应的活化能为E1+E2
d.改变催化剂,可改变该反应的活化能
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.合成氨工业中,每生产 ,放出
,放出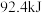 热量。
热量。
(1)写出合成氨反应的热化学方程式___________ 。
(2)已知:
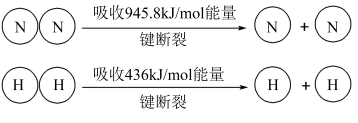
 键断裂吸收的能量等于
键断裂吸收的能量等于_______  (计算结果取整数)。
(计算结果取整数)。
Ⅱ.人工肾脏可用间接电化学方法除去代谢产物中的尿素[化学式为 ],原理如图。
],原理如图。
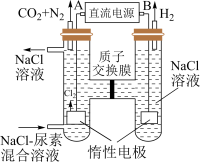
(1)电源的负极为__________ (填“A”或“B”)。
(2)阳极室中发生的反应依次为_________ ,_________ 。
(3)电解结束后,阴极室溶液的 与电解前相比将
与电解前相比将__________ (填“增大”、“减小”或“不变”)。
 ,放出
,放出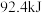 热量。
热量。(1)写出合成氨反应的热化学方程式
(2)已知:

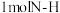 键断裂吸收的能量等于
键断裂吸收的能量等于 (计算结果取整数)。
(计算结果取整数)。Ⅱ.人工肾脏可用间接电化学方法除去代谢产物中的尿素[化学式为
 ],原理如图。
],原理如图。
(1)电源的负极为
(2)阳极室中发生的反应依次为
(3)电解结束后,阴极室溶液的
 与电解前相比将
与电解前相比将
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】I.铁、铝是生活中常见金属,用途广泛。完成下列填空:
(1)在碱性溶液中,Al(OH)3的电离方程式为:___________ 。
(2)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝_____ 。
II.高铁酸钾 是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。
是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。 在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用
在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用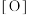 表示):___________
表示):___________ ___________
___________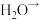 ___________
___________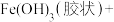 ___________
___________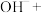 ___________
___________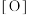
(3)配平上述反应_______ 。此过程中氧化剂是_________ 。(填化学物质)。
(4) 本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?
本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?_______ 。
III.溶液在工业上用于蚀刻铜箔制造电路板。从蚀刻后的废液中可以回收铜并使蚀刻液再生,流程如下(部分物质有省略):
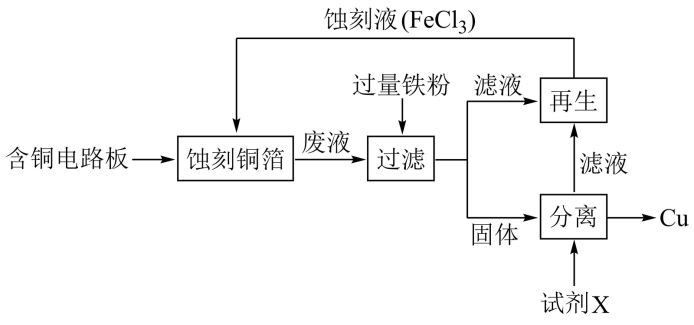
(5) 蚀刻铜箔反应的离子方程式为
蚀刻铜箔反应的离子方程式为___________ 。
(6)从固体中分离出铜,加入的试剂X可以是___________ 。
(7)使滤液再生为蚀刻液可采用的方法是___________ 。
(1)在碱性溶液中,Al(OH)3的电离方程式为:
(2)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝
II.高铁酸钾
 是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。
是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。 在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用
在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用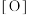 表示):___________
表示):___________ ___________
___________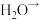 ___________
___________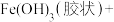 ___________
___________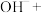 ___________
___________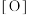
(3)配平上述反应
(4)
 本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?
本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?III.溶液在工业上用于蚀刻铜箔制造电路板。从蚀刻后的废液中可以回收铜并使蚀刻液再生,流程如下(部分物质有省略):

(5)
 蚀刻铜箔反应的离子方程式为
蚀刻铜箔反应的离子方程式为(6)从固体中分离出铜,加入的试剂X可以是
(7)使滤液再生为蚀刻液可采用的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】印刷电路板(PCB)是用腐蚀液( 溶液)将覆铜板上的部分铜腐蚀而制得。一种制作PCB并将腐蚀后废液(金属离子主要含
溶液)将覆铜板上的部分铜腐蚀而制得。一种制作PCB并将腐蚀后废液(金属离子主要含 、
、 、
、 )回收再生的流程如下。
)回收再生的流程如下。

(1)腐蚀池中发生反应的离子方程式是___________ 。
(2)上述各池中,没有发生化学变化的是___________ 池。
(3)置换池中发生反应的离子方程式有___________ 、___________ 。
(4)向再生池中通入 可以使废液再生,离子方程式是
可以使废液再生,离子方程式是___________ ;工业上通常用双氧水代替 ,这样做的优点是
,这样做的优点是___________ 。
(5)以 作为铁源制备
作为铁源制备 ,可用于去除水体中的As(Ⅲ)。已知:
,可用于去除水体中的As(Ⅲ)。已知: 微溶于水,在酸性或中性溶液中迅速氧化
微溶于水,在酸性或中性溶液中迅速氧化 产生
产生 ,在碱性溶液中较稳定,在
,在碱性溶液中较稳定,在 和
和 催化作用下发生分解。
催化作用下发生分解。 氧化性随溶液碱性增强而减弱。某水样中As元素主要以As(Ⅲ)存在,As(Ⅲ)可被
氧化性随溶液碱性增强而减弱。某水样中As元素主要以As(Ⅲ)存在,As(Ⅲ)可被 氧化为As(Ⅴ),更容易通过Fe(Ⅲ)吸附去除。
氧化为As(Ⅴ),更容易通过Fe(Ⅲ)吸附去除。
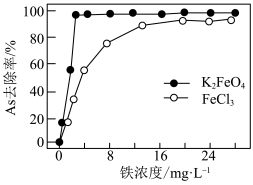
① 对水中As元素的去除率随pH变化如图所示,当pH大于7时,As去除率迅速下降的原因是
对水中As元素的去除率随pH变化如图所示,当pH大于7时,As去除率迅速下降的原因是___________ 。

② 也能去除水中As。pH=6.5时,加入
也能去除水中As。pH=6.5时,加入 或
或 后水中铁浓度对As去除率的影响如图所示,铁浓度相同,使用
后水中铁浓度对As去除率的影响如图所示,铁浓度相同,使用 时As去除率比使用
时As去除率比使用 时高的原因是
时高的原因是___________ 。
 溶液)将覆铜板上的部分铜腐蚀而制得。一种制作PCB并将腐蚀后废液(金属离子主要含
溶液)将覆铜板上的部分铜腐蚀而制得。一种制作PCB并将腐蚀后废液(金属离子主要含 、
、 、
、 )回收再生的流程如下。
)回收再生的流程如下。
(1)腐蚀池中发生反应的离子方程式是
(2)上述各池中,没有发生化学变化的是
(3)置换池中发生反应的离子方程式有
(4)向再生池中通入
 可以使废液再生,离子方程式是
可以使废液再生,离子方程式是 ,这样做的优点是
,这样做的优点是(5)以
 作为铁源制备
作为铁源制备 ,可用于去除水体中的As(Ⅲ)。已知:
,可用于去除水体中的As(Ⅲ)。已知: 微溶于水,在酸性或中性溶液中迅速氧化
微溶于水,在酸性或中性溶液中迅速氧化 产生
产生 ,在碱性溶液中较稳定,在
,在碱性溶液中较稳定,在 和
和 催化作用下发生分解。
催化作用下发生分解。 氧化性随溶液碱性增强而减弱。某水样中As元素主要以As(Ⅲ)存在,As(Ⅲ)可被
氧化性随溶液碱性增强而减弱。某水样中As元素主要以As(Ⅲ)存在,As(Ⅲ)可被 氧化为As(Ⅴ),更容易通过Fe(Ⅲ)吸附去除。
氧化为As(Ⅴ),更容易通过Fe(Ⅲ)吸附去除。①
 对水中As元素的去除率随pH变化如图所示,当pH大于7时,As去除率迅速下降的原因是
对水中As元素的去除率随pH变化如图所示,当pH大于7时,As去除率迅速下降的原因是
②
 也能去除水中As。pH=6.5时,加入
也能去除水中As。pH=6.5时,加入 或
或 后水中铁浓度对As去除率的影响如图所示,铁浓度相同,使用
后水中铁浓度对As去除率的影响如图所示,铁浓度相同,使用 时As去除率比使用
时As去除率比使用 时高的原因是
时高的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】资源的合理利用,有利于社会的可持续发展。MnO2的回收的工艺流程有如下几种方式:
第一种:以锌锰废电池中碳包(含碳粉、Fe、Cu、Ag和MnO2等物质)为原料:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II.将滤渣a在空气中灼烧,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV.向III所得溶液(pH约为6)中缓慢滴加0.50 mol·L-1Na2CO3溶液(pH约为12),过滤,得滤渣b,其主要成分为MnCO3;
V.滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι:Ag与足量稀HNO3反应生成NO的化学方程式为_______ 。
(2)II:灼烧的目的是为了除去_______ 。
(3)III:MnO2溶解的离子方程式为_______ 。溶解一定量的MnO2时,H2O2的实际消耗量比理论值高,用化学方程式解释原因:_______ 。
(4)IV:若实验条件改为“向0.50 mol·L-1Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中可能会混有较多的_______ 杂质(填化学式)。
(5)V:MnCO3在空气中灼烧的化学方程式为_______ 。
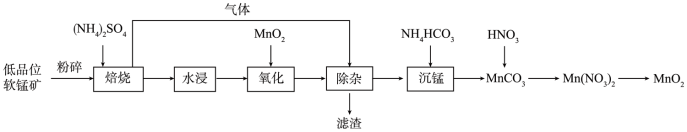
第二种:以低品位软锰矿(MnO2,含少量SiO2、Fe2O3、Al2O3等)为原料制备MnO2,其工艺流程如图:
(6)“焙烧”过程中铁、锰浸出率的影响如图所示:
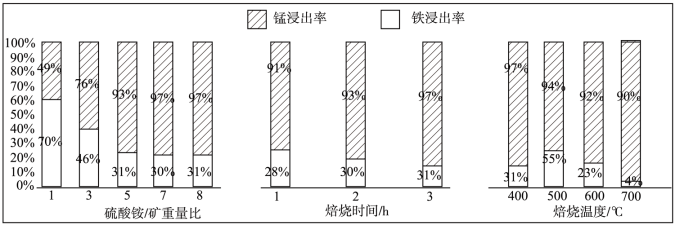
焙烧较适宜的硫酸铵/矿重量比是_______ ,焙烧时间是_______ ,焙烧温度是_______ 。
(7)焙烧产生的气体可调节溶液的pH使某些金属离子沉淀,气体的主要成分是_______ 。
(8)滤渣的成分除了Fe(OH)3,还有_______ (写化学式)。
第一种:以锌锰废电池中碳包(含碳粉、Fe、Cu、Ag和MnO2等物质)为原料:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II.将滤渣a在空气中灼烧,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV.向III所得溶液(pH约为6)中缓慢滴加0.50 mol·L-1Na2CO3溶液(pH约为12),过滤,得滤渣b,其主要成分为MnCO3;
V.滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι:Ag与足量稀HNO3反应生成NO的化学方程式为
(2)II:灼烧的目的是为了除去
(3)III:MnO2溶解的离子方程式为
(4)IV:若实验条件改为“向0.50 mol·L-1Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中可能会混有较多的
(5)V:MnCO3在空气中灼烧的化学方程式为
第二种:以低品位软锰矿(MnO2,含少量SiO2、Fe2O3、Al2O3等)为原料制备MnO2,其工艺流程如图:

(6)“焙烧”过程中铁、锰浸出率的影响如图所示:

焙烧较适宜的硫酸铵/矿重量比是
(7)焙烧产生的气体可调节溶液的pH使某些金属离子沉淀,气体的主要成分是
(8)滤渣的成分除了Fe(OH)3,还有
您最近一年使用:0次



