下列各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
A.CH3COOH CH3COO-+H+ CH3COO-+H+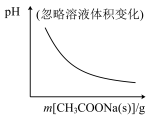 |
B.FeCl3+3KSCN Fe(SCN)3+3KCl Fe(SCN)3+3KCl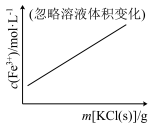 |
C.N2(g)+3H2(g) 2NH3(g) 2NH3(g)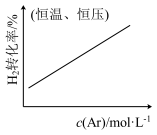 |
D.CH3OCH3(g)+3H2O(g) 6H2(g)+2CO2(g) ΔH>0 6H2(g)+2CO2(g) ΔH>0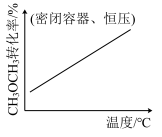 |
更新时间:2020/01/16 19:40:08
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】如图所示为工业合成氨的流程图。下列有关说法错误的是
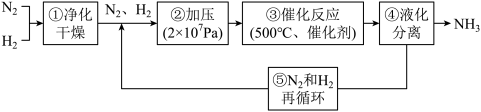

| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 |
| C.步骤③中“500℃”是催化剂催化活性的最佳温度 |
| D.步骤⑤采用“循环”操作,主要为了提高平衡时混合物中氨的含量 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】对于密闭容器中的反应 ,正反应为放热反应,若升高温度,则下列说法错误的是
,正反应为放热反应,若升高温度,则下列说法错误的是
 ,正反应为放热反应,若升高温度,则下列说法错误的是
,正反应为放热反应,若升高温度,则下列说法错误的是| A.气体的平均相对分子质量减小 | B.混合气体颜色加深 |
C. 的转化率减小 的转化率减小 | D. 的体积分数减小 的体积分数减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】将一定量硫化氢气体加入密闭容器中,发生反应:2H2S(g) S2(g)+2H2(g)。该反应的平衡常数的负对数(-lgK)随温度(T)的变化曲线如图所示,下列说法错误的是
S2(g)+2H2(g)。该反应的平衡常数的负对数(-lgK)随温度(T)的变化曲线如图所示,下列说法错误的是
 S2(g)+2H2(g)。该反应的平衡常数的负对数(-lgK)随温度(T)的变化曲线如图所示,下列说法错误的是
S2(g)+2H2(g)。该反应的平衡常数的负对数(-lgK)随温度(T)的变化曲线如图所示,下列说法错误的是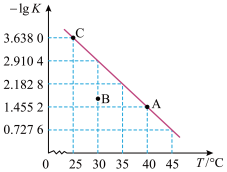
| A.C点对应状态的平衡常数K=10-3.6380 |
| B.该反应的△H>0 |
| C.反应速率:vA>vC |
| D.30℃时,B点对应状态的v正>v逆 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】今有反应X(g)+Y(g)  2Z(g)(正反应放热),右图表示该反应在t1时达到平衡,在t2 时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是
2Z(g)(正反应放热),右图表示该反应在t1时达到平衡,在t2 时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是
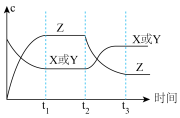
 2Z(g)(正反应放热),右图表示该反应在t1时达到平衡,在t2 时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是
2Z(g)(正反应放热),右图表示该反应在t1时达到平衡,在t2 时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是
| A.升高了反应体系的温度 | B.增大了x或y的浓度 |
| C.增大了反应体系的压强 | D.使用了催化剂 |
您最近一年使用:0次
单选题-单题
|
适中
(0.65)
【推荐2】下列说法正确的是
A.反应H2(g)+I2(g) 2HI(g)达平衡后,增大压强,平衡移动使颜色变深 2HI(g)达平衡后,增大压强,平衡移动使颜色变深 |
B.反应2NO2(g) N2O4(g)达平衡后,恒温恒压条件下充入惰性气体,平衡向左移动,到达新平衡时混合气体的颜色比条件改变前深 N2O4(g)达平衡后,恒温恒压条件下充入惰性气体,平衡向左移动,到达新平衡时混合气体的颜色比条件改变前深 |
C.反应2X(g)+Y(s) Z(s)达平衡后,恒温恒容条件下充入X(g),平衡向右移动,到达新平衡时气体X浓度不变 Z(s)达平衡后,恒温恒容条件下充入X(g),平衡向右移动,到达新平衡时气体X浓度不变 |
D.反应NH4HS(s) NH3(g)+H2S(g)达平衡后,恒温恒容条件下充入HCl(g),平衡不移动 NH3(g)+H2S(g)达平衡后,恒温恒容条件下充入HCl(g),平衡不移动 |
您最近一年使用:0次
单选题-单题
|
适中
(0.65)
名校
【推荐1】下列事实不能用勒夏特列原理解释的是
| A.500℃左右比常温下更有利于合成氨 |
| B.新制氯水在光照条件下颜色变浅 |
| C.可向浓氨水加入氢氧化钠固体快速制取氨 |
| D.用钠与氯化钾共融的方法制备气态钾 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列事实不能用勒夏特列原理解释的是
| A.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B.钢铁在潮湿的空气中容易生锈 |
| C.工业合成氨时常用通过量氮气的方法提高氢气的转化率 |
| D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
您最近一年使用:0次

 后在肺中发生反应
后在肺中发生反应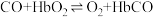 导致人体缺氧。向某血样中通 入
导致人体缺氧。向某血样中通 入 的混合气
的混合气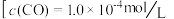 ,
, ,氧合血红蛋白
,氧合血红蛋白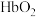 浓度随时间变化曲线如下图所示。下列说法正确的是
浓度随时间变化曲线如下图所示。下列说法正确的是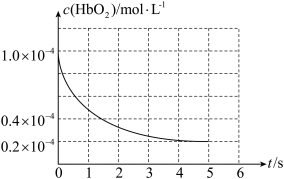

 的反应速率逐渐减小
的反应速率逐渐减小 的反应
的反应 与
与 生成
生成 的反应
的反应

