常温常压下,将a mol  气体通入1L
气体通入1L 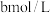 的NaOH溶液中,下列对所得溶液的描述不正确的是
的NaOH溶液中,下列对所得溶液的描述不正确的是
 气体通入1L
气体通入1L 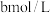 的NaOH溶液中,下列对所得溶液的描述不正确的是
的NaOH溶液中,下列对所得溶液的描述不正确的是

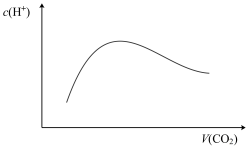
A.当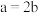 时,随着 时,随着 气体的通入,溶液中由水电离出的 气体的通入,溶液中由水电离出的 有如图变化关系 有如图变化关系 |
B.当 时,所得溶液中存在: 时,所得溶液中存在: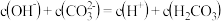 |
C.当 时,所得溶液中存在: 时,所得溶液中存在: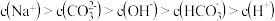 |
D.当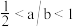 时,所得溶液中一定存在: 时,所得溶液中一定存在: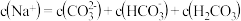 |
更新时间:2020-01-27 16:50:55
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH后,NH 与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
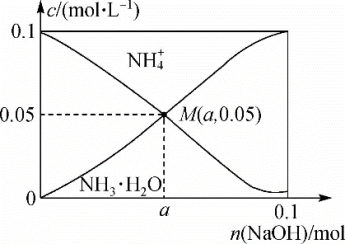
 与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
| A.M点溶液中水的电离程度比原溶液大 |
| B.在M点时,n(OH-)-n(H+)=(a +0.05)mol |
C.当n(NaOH)=0.05mol时,溶液中有:c(Cl-)>c(Na+)>c(NH )>c(OH-)>c(H+ ) )>c(OH-)>c(H+ ) |
| D.随着NaOH的加入,一定存在c(Cl-)+c(OH-)+c(NH3·H2O)>0.1 mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列各溶液中微粒浓度关系正确的是( )
| A.等物质的量浓度的①NH4Cl溶液;②(NH4)2SO4溶液;③NH4HSO4溶液;④(NH4)2CO3溶液中c(NH4+)的大小关系:②>④>①>③ |
| B.0.1mol/LNH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+) >c(OH-) |
| D.0.1mol/LNa2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】常温下,用浓度为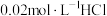 标准溶液滴定浓度均为
标准溶液滴定浓度均为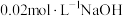 和
和 的混合溶液,滴定过程中
的混合溶液,滴定过程中 随
随
 的变化如图所示(忽视溶液混合引起的体积变化)。下列说法错误的是
的变化如图所示(忽视溶液混合引起的体积变化)。下列说法错误的是

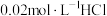 标准溶液滴定浓度均为
标准溶液滴定浓度均为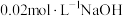 和
和 的混合溶液,滴定过程中
的混合溶液,滴定过程中 随
随
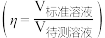 的变化如图所示(忽视溶液混合引起的体积变化)。下列说法错误的是
的变化如图所示(忽视溶液混合引起的体积变化)。下列说法错误的是
A.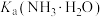 近似为 近似为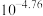 |
B.b点: |
C.c点: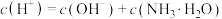 |
D.水的电离程度: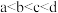 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,向20mL0.1mol/L氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是( )


| A.常温下,NH3·H2O的电离常数约为1×10-5 |
B.a、b之间的点一定满足:c( )>c(Cl-)>c(OH-)>c(H+) )>c(Cl-)>c(OH-)>c(H+) |
C.c点溶液中:c( )= c(Cl-) )= c(Cl-) |
| D.d点代表两溶液恰好完全反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】0.2 mol·L-1的NaOH溶液与0.4 mol·L-1的NH4NO3溶液等体积混合并加热使NH3全部逸出,溶液中各离子的物质的量浓度大小关系正确的是
| A.c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) |
| B.c(Na+)>c(NH4+)>c(NO3-)>c(OH-)>c(H+) |
| C.c(NO3-)>c(NH4+)>c(Na+)>c(H+)>c(OH-) |
| D.c(NO3-)>c(Na+)>c(NH4+)>c(H+)>c(OH-) |
您最近一年使用:0次

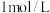
 溶液的烧杯中,加入少量氨水,再加入过量Mg粉,有大量气泡产生。将湿润的红色石蕊试纸放在烧杯口,试纸变蓝。溶液的pH随时间的变化如图。
溶液的烧杯中,加入少量氨水,再加入过量Mg粉,有大量气泡产生。将湿润的红色石蕊试纸放在烧杯口,试纸变蓝。溶液的pH随时间的变化如图。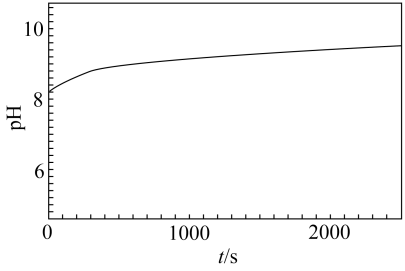
 降低
降低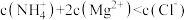
 反应的结果
反应的结果

