氮元素是一种重要的非金属元素,可形成多种化合物。试回答下列有关问题:
(1)①已知4CO(g)+2NO2(g)⇌4CO2(g)+N2(g) △H=-1200kJ⋅mol-1。对于该反应,改变某一反应条件,(已知温度T2>T1)下列图象如图1正确的是___ (填代号)。

②已知CO与H2O在一定条件下可以发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-QkJ⋅mol-1。820℃时,在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为___ ;乙容器吸收的热量为___ 。
(2)氨水常用作沉淀剂,已知25℃时,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Al(OH)3]=1.1×10-33,向浓度均为0.1mol⋅L-1的FeCl3和AlCl3混合溶液中加入氨水,首先生成的沉淀是___ (填化学式)。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气,已知:
①N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ⋅mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ⋅mol-1
写出肼与四氧化二氮反应的热化学方程式___ 。
(4)纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL0.1mol⋅L-1NaOH溶液中加入0.2mol⋅L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图2。

①根据图象写出HN3的电离方程式:___ 。
②下列说法正确的是___ (填序号)。
A.若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂
B.常温下,向0.2mol⋅L-1HN3的溶液中加水稀释,则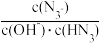 不变
不变
C.分别中和pH均为4的HN3溶液和HCl溶液,消耗0.1mol⋅L-1NaOH溶液的体积相同
D.D点时溶液中离子浓度存在如下关系:2c(H+)+c(HN3)=c(N3-)+2c(OH-)
(1)①已知4CO(g)+2NO2(g)⇌4CO2(g)+N2(g) △H=-1200kJ⋅mol-1。对于该反应,改变某一反应条件,(已知温度T2>T1)下列图象如图1正确的是

②已知CO与H2O在一定条件下可以发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-QkJ⋅mol-1。820℃时,在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为
| 甲 | 乙 |
| 0.10molH2O | 0.20molH2 |
| 0.10molCO | 0.20molCO2 |
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气,已知:
①N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ⋅mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ⋅mol-1
写出肼与四氧化二氮反应的热化学方程式
(4)纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL0.1mol⋅L-1NaOH溶液中加入0.2mol⋅L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图2。

①根据图象写出HN3的电离方程式:
②下列说法正确的是
A.若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂
B.常温下,向0.2mol⋅L-1HN3的溶液中加水稀释,则
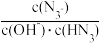 不变
不变C.分别中和pH均为4的HN3溶液和HCl溶液,消耗0.1mol⋅L-1NaOH溶液的体积相同
D.D点时溶液中离子浓度存在如下关系:2c(H+)+c(HN3)=c(N3-)+2c(OH-)
更新时间:2020-02-13 11:44:57
|
相似题推荐
【推荐1】工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
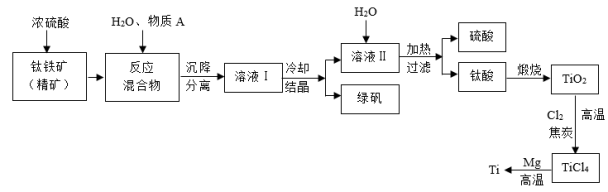
回答下列问题:
(1)钛铁矿和浓硫酸反应属于_______ (选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是_______ ,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是_______ 、_______ 。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_______ 。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g) ΔH1 = -72 kJ•mol-1
TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g) ΔH2 =+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g) ΔH3 =+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是_______ 。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______ 。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。①写出阳极所发生反应的电极反应式:_______ 。

②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)_______ 。

回答下列问题:
(1)钛铁矿和浓硫酸反应属于
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g) ΔH1 = -72 kJ•mol-1
TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g) ΔH2 =+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g) ΔH3 =+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是
②反应C(s)+O2(g)=CO2 (g)的ΔH=
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。①写出阳极所发生反应的电极反应式:

②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)
您最近一年使用:0次
【推荐2】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。请回答:
(1)消除汽车尾气中的NO、CO,有利于减少对环境的污染。已知如下信息:
Ⅰ.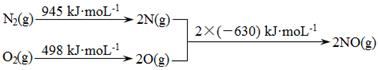
Ⅱ.N2(g)+ O2(g) 2NO(g) ΔH1;2CO(g) + O2(g)
2NO(g) ΔH1;2CO(g) + O2(g) 2CO2 (g) ΔH2=-565 kJ·mol-1
2CO2 (g) ΔH2=-565 kJ·mol-1
在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式___________________ 。
(2)在催化剂作用下,CO2和H2可以制取甲醇,在体积为2L的密闭容器中,充入lmolCO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0
CH3OH(g)+H2O(g) △H<0
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如下图所示:
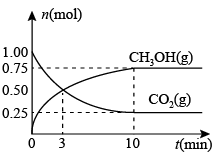
①从反应开始到平衡,H2O的平均反应速率v(H2O)=_________________________ 。此反应的平衡常数为_________________ 。
②下列措施中能使化学平衡向正反应方向移动的是_________________ (填序号)
(3)用间接电化学法除去NO的过程,如图所示:已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:____________ 。用离子方程式表示吸收池中除去NO的原理:________________ 。

(4)①工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3,用文字和化学用语解释原因__________________ 。
②废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于C12的尾气处理,吸收C12后的溶液仍呈强碱性。则吸收C12后的溶液中一定存在的阴离子有OH-_____ 、_____ ;还可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液。此实验不能证明溶液中含有SO32-,理由是:________________ (用离子方程式表示)。
(1)消除汽车尾气中的NO、CO,有利于减少对环境的污染。已知如下信息:
Ⅰ.

Ⅱ.N2(g)+ O2(g)
 2NO(g) ΔH1;2CO(g) + O2(g)
2NO(g) ΔH1;2CO(g) + O2(g) 2CO2 (g) ΔH2=-565 kJ·mol-1
2CO2 (g) ΔH2=-565 kJ·mol-1在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式
(2)在催化剂作用下,CO2和H2可以制取甲醇,在体积为2L的密闭容器中,充入lmolCO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H<0
CH3OH(g)+H2O(g) △H<0测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如下图所示:

①从反应开始到平衡,H2O的平均反应速率v(H2O)=
②下列措施中能使化学平衡向正反应方向移动的是
| A.升高温度 | B.将CH3OH(g)及时液化移出 |
| C.选择高效催化剂 | D.再充入1 molCO2和4molH2 |

(4)①工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3,用文字和化学用语解释原因
②废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于C12的尾气处理,吸收C12后的溶液仍呈强碱性。则吸收C12后的溶液中一定存在的阴离子有OH-
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
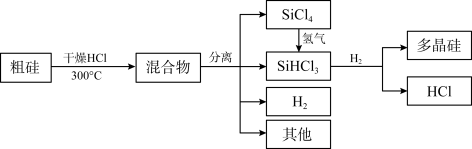
回答下列问题:
Ⅰ.硅粉与HCl在300℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,
(1)该反应的热化学方程式为_______ 。
Ⅱ.将SiCl4氢化为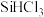 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g) △H1>0
SiHCl3(g)+HCl(g) △H1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)=3SiHCl3(g) △H3
(2)已知体系自由能变△G=△H-T△S,△G<0时反应自发进行。三个氢化反应的△G与温度的关系如图1所示,可知:反应①能自发进行的最低温度是_______ ;相同温度下,反应②比反应①的△G小,主要原因是_______ 。

(3)以上反应在不同温度下反应相同时间的某一时刻,反应②中SiCl4转化率如图2所示。下列叙述正确的是_______ (填序号)。
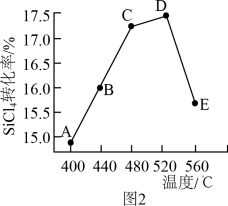
a.B点:v正>v逆 b.v正:A点>E点 c.反应适宜温度:480-520℃
(4)反应③的△H3=_______ (用△H1,△H2表示)。温度升高,反应③的平衡常数K_______ (填“增大”、“减小”或“不变”)。
(5)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3和Si外,还有_______ (填分子式)。

回答下列问题:
Ⅰ.硅粉与HCl在300℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,
(1)该反应的热化学方程式为
Ⅱ.将SiCl4氢化为
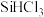 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:①SiCl4(g)+H2(g)
 SiHCl3(g)+HCl(g) △H1>0
SiHCl3(g)+HCl(g) △H1>0②3SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0③2SiCl4(g)+H2(g)+Si(s)+HCl(g)=3SiHCl3(g) △H3
(2)已知体系自由能变△G=△H-T△S,△G<0时反应自发进行。三个氢化反应的△G与温度的关系如图1所示,可知:反应①能自发进行的最低温度是

(3)以上反应在不同温度下反应相同时间的某一时刻,反应②中SiCl4转化率如图2所示。下列叙述正确的是

a.B点:v正>v逆 b.v正:A点>E点 c.反应适宜温度:480-520℃
(4)反应③的△H3=
(5)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3和Si外,还有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】中国科学家用金属钠和CO2在一定条件下制得了金刚石:4 Na + 3CO2 2 Na2CO3 + C(金刚石),以下是一些物质的熔沸点数据(常压):
2 Na2CO3 + C(金刚石),以下是一些物质的熔沸点数据(常压):
(1)若反应在常压、890℃下进行,写出该反应的平衡常数表达式_____________________ ,若3v正(Na)=4v逆(CO2),则_____ (选填序号)。
a.反应肯定达到平衡 b.反应可能达到平衡 c.反应肯定未达平衡
(2)若反应在10L密闭容器、常压下进行,5min内,测得金刚石的质量增加了6 g,该时间段内v(CO2)=______________ ,若反应温度由890℃升高到1860℃,则容器内气体的平均相对分子质量将________ (选填“增大”、“减小”或“不变”) 。
(3)反应中还有石墨生成,已知:C(石墨) C(金刚石),若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是
C(金刚石),若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是_________ 反应(填“吸热”或“放热”)。
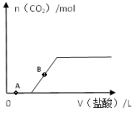
(4)碳酸钠溶液中滴入盐酸的反应过程如右图所示,反应至A点时,未产生二氧化碳,请用离子方程式解释原因:_________________ ,继续滴加盐酸,反应至B点,B点溶液中溶质的化学式是__________ 。
 2 Na2CO3 + C(金刚石),以下是一些物质的熔沸点数据(常压):
2 Na2CO3 + C(金刚石),以下是一些物质的熔沸点数据(常压):| 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
(1)若反应在常压、890℃下进行,写出该反应的平衡常数表达式
a.反应肯定达到平衡 b.反应可能达到平衡 c.反应肯定未达平衡
(2)若反应在10L密闭容器、常压下进行,5min内,测得金刚石的质量增加了6 g,该时间段内v(CO2)=
(3)反应中还有石墨生成,已知:C(石墨)
 C(金刚石),若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是
C(金刚石),若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是(4)碳酸钠溶液中滴入盐酸的反应过程如右图所示,反应至A点时,未产生二氧化碳,请用离子方程式解释原因:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】 是一种重要的无机化合物,可作为食盐中的补碘剂。利用“
是一种重要的无机化合物,可作为食盐中的补碘剂。利用“ 氧化法”制备
氧化法”制备 工艺流程如图所示:
工艺流程如图所示:
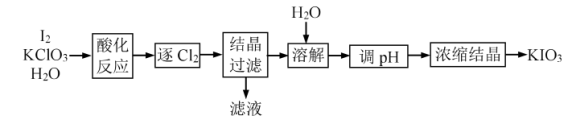
已知:“酸化反应”所得产物有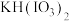 、
、 和
和 。
。
回答下列问题:
(1) 在元素周期表中的位置是
在元素周期表中的位置是_______ ; 的电子式为
的电子式为_______ ; 中两种离子的半径大小关系为
中两种离子的半径大小关系为_______ 。
(2)将“酸化反应”的化学方程式补充完整。
______
(3)“逐 ”采用的方法是
”采用的方法是_______ 。
(4)“滤液”中的溶质主要是_______ 。
(5)“调 ”时,加入的试剂为
”时,加入的试剂为_______ 溶液。
(6)“ 氧化法”的明显不足之处有
氧化法”的明显不足之处有_______ (任写一条)。
 是一种重要的无机化合物,可作为食盐中的补碘剂。利用“
是一种重要的无机化合物,可作为食盐中的补碘剂。利用“ 氧化法”制备
氧化法”制备 工艺流程如图所示:
工艺流程如图所示:
已知:“酸化反应”所得产物有
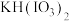 、
、 和
和 。
。回答下列问题:
(1)
 在元素周期表中的位置是
在元素周期表中的位置是 的电子式为
的电子式为 中两种离子的半径大小关系为
中两种离子的半径大小关系为(2)将“酸化反应”的化学方程式补充完整。

(3)“逐
 ”采用的方法是
”采用的方法是(4)“滤液”中的溶质主要是
(5)“调
 ”时,加入的试剂为
”时,加入的试剂为(6)“
 氧化法”的明显不足之处有
氧化法”的明显不足之处有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
真题
解题方法
【推荐3】工业上以硫黄为原料制备硫酸的原理示意图如下,其过程包括Ⅰ、Ⅱ、Ⅲ三个阶段。
(1)硫磺( )的晶体类型是
)的晶体类型是______ 。
(2)硫的燃烧应控制事宜温度。若进料温服超过硫的沸点,部分燃烧的硫以蒸汽的形式随SO2进入到下一阶段,会导致______ (填序号)。
a.硫的消耗量增加 b.SO2产率下降 c.生成较多SO3
(3)SO2(g)氧化生成80g SO3(g)放出热量98.3kJ,写出该反应的热化学方程式______ 。随温度升高,SO2的平衡转化率______ (填“升高”或“降低”)。
(4)从能量角度分析,钒催化剂在反应中的作用为______ 。
Ⅱ.一定条件下,钒催化剂的活性温度范围是450~600℃。为了兼顾转化率和反应速率,可采用四段转化工艺:预热后的SO2和O2通过第一段的钒催化剂层进行催化氧化,气体温度会迅速接近600℃,此时立即将气体通过热交换器,将热量传递给需要预热的SO2和O2,完成第一段转化。降温后的气体依次进行后三段转化,温度逐段降低,总转化率逐段提高,接近平衡转化率。最终反应在450℃左右时,SO2转化率达到97%。
(5)气体经过每段的钒催化剂层,温度都会升高,其原因是______ 。升高温度后的气体都需要降温,其目的是______ 。
(6)采用四段转化工艺可以实现______ (填序号)。
a.控制适宜的温度,尽量加快反应速率,尽可能提高SO2转化率
b.使反应达到平衡状态
c.节约能源
Ⅲ.工业上用浓硫酸吸收SO3。若用水吸收SO3会产生酸雾,导致吸收效率降低。
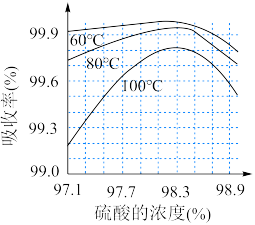
(7)SO3的吸收率与所用硫酸的浓度、温度的关系如图所示。______ ,温度______ 。
(8)用32吨含S 99%的硫磺为原料生成硫酸,假设硫在燃烧过程中损失2%,SO2生成SO3的转化率是97%,SO3吸收的损失忽略不计,最多可以生产98%的硫酸______ 吨。

(1)硫磺(
 )的晶体类型是
)的晶体类型是(2)硫的燃烧应控制事宜温度。若进料温服超过硫的沸点,部分燃烧的硫以蒸汽的形式随SO2进入到下一阶段,会导致
a.硫的消耗量增加 b.SO2产率下降 c.生成较多SO3
(3)SO2(g)氧化生成80g SO3(g)放出热量98.3kJ,写出该反应的热化学方程式
(4)从能量角度分析,钒催化剂在反应中的作用为
Ⅱ.一定条件下,钒催化剂的活性温度范围是450~600℃。为了兼顾转化率和反应速率,可采用四段转化工艺:预热后的SO2和O2通过第一段的钒催化剂层进行催化氧化,气体温度会迅速接近600℃,此时立即将气体通过热交换器,将热量传递给需要预热的SO2和O2,完成第一段转化。降温后的气体依次进行后三段转化,温度逐段降低,总转化率逐段提高,接近平衡转化率。最终反应在450℃左右时,SO2转化率达到97%。
(5)气体经过每段的钒催化剂层,温度都会升高,其原因是
(6)采用四段转化工艺可以实现
a.控制适宜的温度,尽量加快反应速率,尽可能提高SO2转化率
b.使反应达到平衡状态
c.节约能源
Ⅲ.工业上用浓硫酸吸收SO3。若用水吸收SO3会产生酸雾,导致吸收效率降低。
(7)SO3的吸收率与所用硫酸的浓度、温度的关系如图所示。
(8)用32吨含S 99%的硫磺为原料生成硫酸,假设硫在燃烧过程中损失2%,SO2生成SO3的转化率是97%,SO3吸收的损失忽略不计,最多可以生产98%的硫酸
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】铁、钴(Co)、镍(Ni)是同族元素,它们的化合物在工业上有重要的应用。
(1)现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3+(aq)+SCN-(aq) Fe(SCN)2+(aq)(忽略其它过程)。
Fe(SCN)2+(aq)(忽略其它过程)。
平衡浓度c[Fe(SCN)2+]与温度T的关系如图所示:

则该反应△H____ 0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,平c[Fe(SCN)2+]=0.45 mol/L,求达到平衡时的平均反应速率v(SCN-)=____ mol·L-1·S-1,该温度下的Fe3+的平衡转化率为_____ ,该温度下反应的平衡常数为__________ 。
(2)草酸钴(CoC2O4)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:______________________ 。
(3)已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,已知Ksp[Co(OH)2]=6.0×10﹣15,Ksp[Ni(OH)2]=2.0×10﹣15,当Co(OH)2开始沉淀时,溶液中 的值等于
的值等于______ 。(取两位有效数字)
(4)CoxNi(1-x)Fe2O4 (其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。两种不同方法制得的催化剂在10℃时催化、分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。

由图中信息可知:__________ 法制取得到的催化剂活性更高;Co2+、Ni2+ 两种离子中催化效果较好的是_____________________ 。
(1)现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3+(aq)+SCN-(aq)
 Fe(SCN)2+(aq)(忽略其它过程)。
Fe(SCN)2+(aq)(忽略其它过程)。平衡浓度c[Fe(SCN)2+]与温度T的关系如图所示:

则该反应△H
(2)草酸钴(CoC2O4)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:
(3)已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,已知Ksp[Co(OH)2]=6.0×10﹣15,Ksp[Ni(OH)2]=2.0×10﹣15,当Co(OH)2开始沉淀时,溶液中
 的值等于
的值等于(4)CoxNi(1-x)Fe2O4 (其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。两种不同方法制得的催化剂在10℃时催化、分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。

由图中信息可知:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】我国政府承诺要在2030年前实现碳达峰, 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
(1) 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
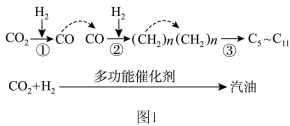
下列对该反应过程的说法正确的是_______ (填标号)。
A.整个反应过程中,有非极性键和极性键的断裂和形成
B. 中C原子的杂化类型为sp
中C原子的杂化类型为sp
C.汽油为纯净物
(2)已知 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
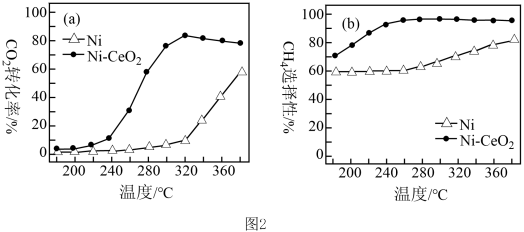
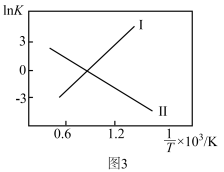
①四羰基镍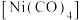 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为_______ 。
②以Ni为催化剂,高于320℃后,单位时间内 转化率上升的原因是
转化率上升的原因是_______ ;工业上应选择的催化剂是_______ 。
(3)以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.

Ⅱ.

①反应

_______ 。(用含 和
和 的代数式表示)
的代数式表示)
②反应Ⅰ、Ⅱ的 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将_______ (填“增大”、“减小”或“不变”,下同),CO的含量将_______ 。
③某温度下往恒容密闭容器中充入1 mol 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
_______ (用平衡分压代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。
 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:(1)
 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
下列对该反应过程的说法正确的是
A.整个反应过程中,有非极性键和极性键的断裂和形成
B.
 中C原子的杂化类型为sp
中C原子的杂化类型为spC.汽油为纯净物
(2)已知
 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍
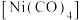 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为②以Ni为催化剂,高于320℃后,单位时间内
 转化率上升的原因是
转化率上升的原因是(3)以
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.


Ⅱ.


①反应


 和
和 的代数式表示)
的代数式表示)②反应Ⅰ、Ⅱ的
 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将
③某温度下往恒容密闭容器中充入1 mol
 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】将氯化氢转化为氯气的技术是当前科学研究的热点。回答下列问题:
(1)1868年Deacon发明的用氯化铜做催化剂直接氧化法(地康法制氯气)为:4HClg)+O2(g) 2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应ΔH_______ 0(填“大于”或“小于”)。设HCl初始浓度度为c0,根据进料浓度比c(HCl):c(O2)=1:1的数据计算K(400℃)=_______ (列出计算式)。按化学技量比进料可以保持反应物高转化率,同时降低产物分离的能料。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是_______ 、_______ 。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=83kJ/mol
Cl2(g) ΔH1=83kJ/mol
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ/mol
Cl2(g) ΔH2=-20kJ/mol
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121kJ/mol
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_______ 。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是_______ 、_______ 。(写出2种)
(1)1868年Deacon发明的用氯化铜做催化剂直接氧化法(地康法制氯气)为:4HClg)+O2(g)
 2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
可知反应ΔH
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=83kJ/mol
Cl2(g) ΔH1=83kJ/molCuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ/mol
Cl2(g) ΔH2=-20kJ/molCuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121kJ/mol
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】过碳酸钠 常作除污剂、清洗剂和杀菌剂。市售过碳酸钠样品一般含有碳酸钠,为了测定某过碳酸钠样品
常作除污剂、清洗剂和杀菌剂。市售过碳酸钠样品一般含有碳酸钠,为了测定某过碳酸钠样品 只含
只含 和
和 的纯度,某小组设计如下两种实验方案:
的纯度,某小组设计如下两种实验方案:
实验原理: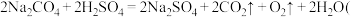 也可以用盐酸与过碳酸钠反应
也可以用盐酸与过碳酸钠反应 。
。
方案1:液吸法。取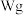 样品于烧瓶中,加入足量的稀硫酸,实验装置如图所示。已知:在分析化学中,常用醋酸亚铬
样品于烧瓶中,加入足量的稀硫酸,实验装置如图所示。已知:在分析化学中,常用醋酸亚铬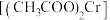 溶液作
溶液作 的吸收剂。
的吸收剂。

⑴安全漏斗中“安全”的含义是____________________________ 。
⑵装置C的作用是__________ ;装置D和F盛放同一种试剂,可能是________ (填名称)。
⑶本实验通过装置________________ (填字母)实验前后质量差可测定 的质量。
的质量。
⑷实验装置气密性良好及装置内试剂足量,但实验发现测定的样品纯度总是偏低,其主要原因可能是________________________ 。
方案2:量气法。实验装置如图所示。

⑸气流方向由左至右,则导管口连接顺序为
________  。
。
⑹实验时向烧瓶内加入足量稀盐酸,实验完毕后,在室温下,测得J中水的体积为 。已知室温下,气体摩尔体积为
。已知室温下,气体摩尔体积为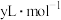 。该样品纯度为
。该样品纯度为__________ %(用含x、y、m的代数式表示)。若其他操作都合理,读数时J中液面高于H中液面,则测得结果________ (填“偏高”“偏低”或“无影响”)。
 常作除污剂、清洗剂和杀菌剂。市售过碳酸钠样品一般含有碳酸钠,为了测定某过碳酸钠样品
常作除污剂、清洗剂和杀菌剂。市售过碳酸钠样品一般含有碳酸钠,为了测定某过碳酸钠样品 只含
只含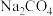 和
和 的纯度,某小组设计如下两种实验方案:
的纯度,某小组设计如下两种实验方案: 实验原理:
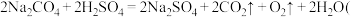 也可以用盐酸与过碳酸钠反应
也可以用盐酸与过碳酸钠反应 。
。方案1:液吸法。取
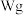 样品于烧瓶中,加入足量的稀硫酸,实验装置如图所示。已知:在分析化学中,常用醋酸亚铬
样品于烧瓶中,加入足量的稀硫酸,实验装置如图所示。已知:在分析化学中,常用醋酸亚铬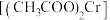 溶液作
溶液作 的吸收剂。
的吸收剂。 
⑴安全漏斗中“安全”的含义是
⑵装置C的作用是
⑶本实验通过装置
 的质量。
的质量。⑷实验装置气密性良好及装置内试剂足量,但实验发现测定的样品纯度总是偏低,其主要原因可能是
方案2:量气法。实验装置如图所示。

⑸气流方向由左至右,则导管口连接顺序为

 。
。⑹实验时向烧瓶内加入足量稀盐酸,实验完毕后,在室温下,测得J中水的体积为
 。已知室温下,气体摩尔体积为
。已知室温下,气体摩尔体积为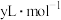 。该样品纯度为
。该样品纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】饮用水中含砷会导致砷中毒,金属冶炼过程产生的含砷有毒废物需处理与检测。冶炼废水中砷元素主要以亚砷酸 形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图: 与过量的
与过量的 存在反应:
存在反应: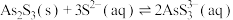 ;
;
②亚砷酸 盐的溶解性大于相应的砷酸
盐的溶解性大于相应的砷酸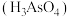 盐。
盐。
(1)①实验操作1和2是___________ 。
②“一级沉砷”先加入硫化钠主要发生的离子反应是:___________ 。
③一级沉砷后再加入硫酸亚铁的主要作用是:___________ 。
(2)“二级沉砷”先加入双氧水发生的反应有:___________ 。沉淀 的成分是
的成分是___________ 。
(3)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿 被氧化为
被氧化为 ,同时生成
,同时生成 ,导致砷脱离矿体进入地下水。
,导致砷脱离矿体进入地下水。 被
被 氧化的离子方程式是
氧化的离子方程式是___________ 。
(4)测定某 溶液(含少量
溶液(含少量 )中
)中 浓度的一种方法如下:
浓度的一种方法如下:
已知:用 标准溶液滴定弱酸溶液,一般要求弱酸的
标准溶液滴定弱酸溶液,一般要求弱酸的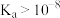 。
。
i.调 :取
:取 待测液,向其中滴入适量
待测液,向其中滴入适量 溶液调节
溶液调节 ,中和
,中和 。
。
ii.氧化:向上述溶液中加入适量碘水,将 氧化为
氧化为 。
。
iii.滴定:用 标准溶液滴定ⅱ中得到的
标准溶液滴定ⅱ中得到的 溶液至终点,消耗
溶液至终点,消耗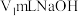 标准溶液。
标准溶液。___________ 。
②若无i,会导致测定的 浓度
浓度___________ (填“偏高”或“偏低”)。
③通过计算可知亚砷酸的浓度为___________ 。
 形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图: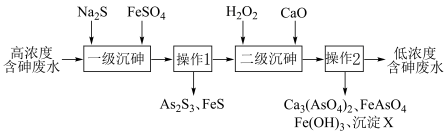
 与过量的
与过量的 存在反应:
存在反应: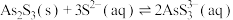 ;
;②亚砷酸
 盐的溶解性大于相应的砷酸
盐的溶解性大于相应的砷酸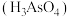 盐。
盐。(1)①实验操作1和2是
②“一级沉砷”先加入硫化钠主要发生的离子反应是:
③一级沉砷后再加入硫酸亚铁的主要作用是:
(2)“二级沉砷”先加入双氧水发生的反应有:
 的成分是
的成分是(3)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿
 被氧化为
被氧化为 ,同时生成
,同时生成 ,导致砷脱离矿体进入地下水。
,导致砷脱离矿体进入地下水。 被
被 氧化的离子方程式是
氧化的离子方程式是(4)测定某
 溶液(含少量
溶液(含少量 )中
)中 浓度的一种方法如下:
浓度的一种方法如下:已知:用
 标准溶液滴定弱酸溶液,一般要求弱酸的
标准溶液滴定弱酸溶液,一般要求弱酸的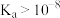 。
。i.调
 :取
:取 待测液,向其中滴入适量
待测液,向其中滴入适量 溶液调节
溶液调节 ,中和
,中和 。
。ii.氧化:向上述溶液中加入适量碘水,将
 氧化为
氧化为 。
。iii.滴定:用
 标准溶液滴定ⅱ中得到的
标准溶液滴定ⅱ中得到的 溶液至终点,消耗
溶液至终点,消耗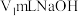 标准溶液。
标准溶液。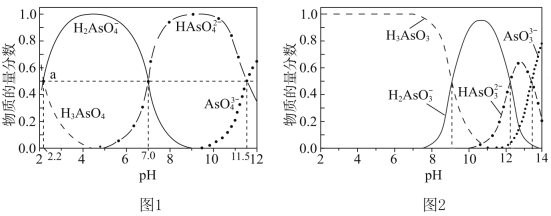
②若无i,会导致测定的
 浓度
浓度③通过计算可知亚砷酸的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】酸碱中和滴定是我们常用的一种定量分析方法。
Ⅰ.为测定某盐酸的浓度,用已知浓度的氢氧化钠溶液滴定。
(1)酸式滴定管排气泡的方法是____ 。
(2)用氢氧化钠标准溶液滴定,直至____ ,即为滴定终点。
(3)下列操作造成滴定结果偏高的是____ 。
a.滴定过程中向锥形瓶中加入少量蒸馏水
b.其他操作均正确,滴定终点读数时俯视滴定管的刻度
c.未用用氢氧化钠标准溶液润洗碱式滴定管
d.滴定终点读数时发现滴定管尖嘴处悬挂一滴液体
e.未用待测盐酸润洗酸式滴定管
(4)KMnO4常用于氧化还原滴定。滴定时应将KMnO4加入____ 滴定管中(填“酸式”或“碱式”)。
(5)高锰酸钾纯度的测定:称取3.16g高锰酸钾样品,溶解后定容于100ml容量瓶中,摇匀。取浓度为0.2000mol/L的H2C2O4标准溶液25.00mL,加入稀硫酸酸化,用高锰酸钾溶液平行滴定三次,平均消耗的体积为20.00mL,该样品的纯度为____ 。(已知2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)
Ⅱ.中和热的测定
(6)某实验小组用0.55mol/L的NaOH溶液和0.25mol/L的H2SO4的溶液进行中和热的测定。取50mLNaOH溶液和50mLH2SO4溶液在____ 中(填仪器名称)进行实验。数据如表:
近似认为50mL0.55mol/LNaOH溶液和50mL0.25mol/LH2SO4溶液的密度都是1g/mL,中和后生成溶液的比热容C=4.18J/(g∙℃),则测得中和热△H=___ kJ/mol(精确到小数点后一位)。
Ⅰ.为测定某盐酸的浓度,用已知浓度的氢氧化钠溶液滴定。
(1)酸式滴定管排气泡的方法是
(2)用氢氧化钠标准溶液滴定,直至
(3)下列操作造成滴定结果偏高的是
a.滴定过程中向锥形瓶中加入少量蒸馏水
b.其他操作均正确,滴定终点读数时俯视滴定管的刻度
c.未用用氢氧化钠标准溶液润洗碱式滴定管
d.滴定终点读数时发现滴定管尖嘴处悬挂一滴液体
e.未用待测盐酸润洗酸式滴定管
(4)KMnO4常用于氧化还原滴定。滴定时应将KMnO4加入
(5)高锰酸钾纯度的测定:称取3.16g高锰酸钾样品,溶解后定容于100ml容量瓶中,摇匀。取浓度为0.2000mol/L的H2C2O4标准溶液25.00mL,加入稀硫酸酸化,用高锰酸钾溶液平行滴定三次,平均消耗的体积为20.00mL,该样品的纯度为
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)Ⅱ.中和热的测定
(6)某实验小组用0.55mol/L的NaOH溶液和0.25mol/L的H2SO4的溶液进行中和热的测定。取50mLNaOH溶液和50mLH2SO4溶液在
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 25.2 | 25.0 | 25.1 | 28.5 |
| 2 | 26.2 | 26.4 | 26.3 | 32.5 |
| 3 | 25.3 | 25.3 | 25.3 | 28.8 |
| 4 | 26.1 | 26.5 | 26.3 | 29.6 |
您最近一年使用:0次



