工业上可利用CO2来制备清洁液体颜料甲醇,有关化学反应如下:
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=﹣49.6kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)⇌H2O(g)+CO(g) △H2=+41kJ•mol-1
(1)反应Ⅰ在___ (填“低温”或“高温”)下可自发反应。
(2)有利于提高上述反应甲醇平衡产率的条件是___ 。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)在Cu﹣ZnO/ZrO2催化下,CO2和H2混合气体,体积比1:3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。
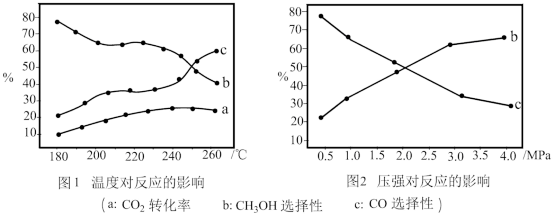
①下列说法正确的是___ 。
A.压强可影响产物的选择性
B.CO2平衡转化率随温度升高先增大后减小
C.由图1可知,反应的最佳温度为220℃左右
D.及时分离出甲醇和水以及使氢气和二氧化碳循环使用,可提高原料利用率
②250℃时,反应Ⅰ和Ⅱ达到平衡,平衡时容器体积为VL,CO2转化率为25%,CH3OH和CO选择性均为50%,则该温度下反应Ⅱ的平衡常数为___ 。
③分析图2中CO选择性下降的原因___ 。
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=﹣49.6kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)⇌H2O(g)+CO(g) △H2=+41kJ•mol-1
(1)反应Ⅰ在
(2)有利于提高上述反应甲醇平衡产率的条件是
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)在Cu﹣ZnO/ZrO2催化下,CO2和H2混合气体,体积比1:3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

①下列说法正确的是
A.压强可影响产物的选择性
B.CO2平衡转化率随温度升高先增大后减小
C.由图1可知,反应的最佳温度为220℃左右
D.及时分离出甲醇和水以及使氢气和二氧化碳循环使用,可提高原料利用率
②250℃时,反应Ⅰ和Ⅱ达到平衡,平衡时容器体积为VL,CO2转化率为25%,CH3OH和CO选择性均为50%,则该温度下反应Ⅱ的平衡常数为
③分析图2中CO选择性下降的原因
更新时间:2020-02-20 14:52:55
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】汽车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等物质,这种尾气越来越成为城市空气污染的主要来源,必须予以治理。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使汽油、柴油等物质充分燃烧及SO2的转化。
(1)汽车尾气中NO的来源是_________ 。
A.汽油、柴油中含氮,是其燃烧产物
B.是空气中的N2与汽油、柴油的反应产物
C.是空气中的N2与O2在汽车气缸内的高温环境下的反应产物
D.是汽车高温尾气导致了空气中N2与O2的化合反应
(2)写出CO与NO反应的化学方程式:_____________________________ 。
(3)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是______________
(4)控制或者减少城市汽车尾气污染的方法可以有___________ 。(多选)
A.开发氢能源 B.使用电动车 C.限制车辆行驶 D.使用乙醇汽油
(1)汽车尾气中NO的来源是
A.汽油、柴油中含氮,是其燃烧产物
B.是空气中的N2与汽油、柴油的反应产物
C.是空气中的N2与O2在汽车气缸内的高温环境下的反应产物
D.是汽车高温尾气导致了空气中N2与O2的化合反应
(2)写出CO与NO反应的化学方程式:
(3)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是
(4)控制或者减少城市汽车尾气污染的方法可以有
A.开发氢能源 B.使用电动车 C.限制车辆行驶 D.使用乙醇汽油
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】化学用语表示下列过程
(1)NaHSO4在熔融状态下的电离:___________ 。
(2)已知:C(s) + O2(g) CO2(g) ∆H1=a kJ/mol
CO2(g) ∆H1=a kJ/mol
2CO(g) + O2(g) 2CO2(g) ∆H2=b kJ/mol
2CO2(g) ∆H2=b kJ/mol
写出C(s) 和O2(g) 转化为CO(g) 的热化学方程式:______ 。
已知25 ℃时,两种弱酸的电离平衡常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,向NaCN溶液中通入少量CO2反应的离子方程式:__________ 。
(1)NaHSO4在熔融状态下的电离:
(2)已知:C(s) + O2(g)
 CO2(g) ∆H1=a kJ/mol
CO2(g) ∆H1=a kJ/mol2CO(g) + O2(g)
 2CO2(g) ∆H2=b kJ/mol
2CO2(g) ∆H2=b kJ/mol写出C(s) 和O2(g) 转化为CO(g) 的热化学方程式:
已知25 ℃时,两种弱酸的电离平衡常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,向NaCN溶液中通入少量CO2反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡,根据要求回答下列问题:
(1)向 ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象_______________________________________________ 。
(2)AlCl3溶液蒸干并灼烧得到的物质是__________ (填化学式)。
(3)0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________________________________________ 。
(4)0.1mol·L-1的NaHA溶液中,粒子浓度由大到小的顺序为:c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中显________ (填“酸性”、“碱性”或“中性”);
②作出上述判断的依据是___________________________________________ (用文字解释)。
(1)向 ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象
(2)AlCl3溶液蒸干并灼烧得到的物质是
(3)0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
(4)0.1mol·L-1的NaHA溶液中,粒子浓度由大到小的顺序为:c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中显
②作出上述判断的依据是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】钴( )的常见化合价有+2、+3等,均容易形成相应配离子,如
)的常见化合价有+2、+3等,均容易形成相应配离子,如 、
、 。
。 脱除烟气中NO的机理如下:
脱除烟气中NO的机理如下:

I.活化氧气: 在氨水中与氧气作用生成具有强氧化性的微粒X(其中Co的化合价为+3),X的结构如上图所示。
在氨水中与氧气作用生成具有强氧化性的微粒X(其中Co的化合价为+3),X的结构如上图所示。
(1)用“□”标识出X中体现强氧化性的基团:_______ 。
II.配位 较钴的其它配位离子易吸收NO生成
较钴的其它配位离子易吸收NO生成 ,将NO由气相转入液相。溶液的pH对NO的配位脱除率的影响如图所示。
,将NO由气相转入液相。溶液的pH对NO的配位脱除率的影响如图所示。

(2)图中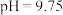 时,NO脱除率较低,其原因可能是
时,NO脱除率较低,其原因可能是_______ 。
III.氧化吸收: 被X氧化为
被X氧化为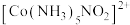 ,
,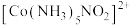 在氨水中生成硝酸铵和亚硝酸铵,达到脱除NO的效果。
在氨水中生成硝酸铵和亚硝酸铵,达到脱除NO的效果。
(3)用活性炭作催化剂、水作还原剂可实现 的再生,维持溶液脱除NO的能力,可能机理如图所示。
的再生,维持溶液脱除NO的能力,可能机理如图所示。

已知:活性炭表面既有大量的酸性基团,又有大量的碱性基团。溶液的pH对活性炭表面所带电荷有影响。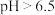 时带负电荷,pH越高,表面所带负电荷越多;
时带负电荷,pH越高,表面所带负电荷越多; 时带正电荷,pH越低,表面所带正电荷越多。
时带正电荷,pH越低,表面所带正电荷越多。
①由步骤(ii)可知活性炭表面有大量的_______ (填“酸性”或“碱性”)基团。
②写出步骤(iii)的离子反应方程式:_______ 。
(4)一定温度下,pH对再生反应的影响如图所示。

①当 时,
时, 的转化率随pH的减小而降低
的转化率随pH的减小而降低_______ 的原因是。当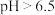 时,
时, 的转化率随pH的增大而降低的原因是
的转化率随pH的增大而降低的原因是_______ 。
(5)一定pH下,反应相同时间, 的转化率随温度的升高而增大,可能的原因是
的转化率随温度的升高而增大,可能的原因是_______ 。(至少答出2点)
 )的常见化合价有+2、+3等,均容易形成相应配离子,如
)的常见化合价有+2、+3等,均容易形成相应配离子,如 、
、 。
。 脱除烟气中NO的机理如下:
脱除烟气中NO的机理如下:
I.活化氧气:
 在氨水中与氧气作用生成具有强氧化性的微粒X(其中Co的化合价为+3),X的结构如上图所示。
在氨水中与氧气作用生成具有强氧化性的微粒X(其中Co的化合价为+3),X的结构如上图所示。(1)用“□”标识出X中体现强氧化性的基团:
II.配位
 较钴的其它配位离子易吸收NO生成
较钴的其它配位离子易吸收NO生成 ,将NO由气相转入液相。溶液的pH对NO的配位脱除率的影响如图所示。
,将NO由气相转入液相。溶液的pH对NO的配位脱除率的影响如图所示。
(2)图中
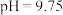 时,NO脱除率较低,其原因可能是
时,NO脱除率较低,其原因可能是III.氧化吸收:
 被X氧化为
被X氧化为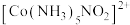 ,
,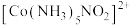 在氨水中生成硝酸铵和亚硝酸铵,达到脱除NO的效果。
在氨水中生成硝酸铵和亚硝酸铵,达到脱除NO的效果。(3)用活性炭作催化剂、水作还原剂可实现
 的再生,维持溶液脱除NO的能力,可能机理如图所示。
的再生,维持溶液脱除NO的能力,可能机理如图所示。
已知:活性炭表面既有大量的酸性基团,又有大量的碱性基团。溶液的pH对活性炭表面所带电荷有影响。
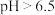 时带负电荷,pH越高,表面所带负电荷越多;
时带负电荷,pH越高,表面所带负电荷越多; 时带正电荷,pH越低,表面所带正电荷越多。
时带正电荷,pH越低,表面所带正电荷越多。①由步骤(ii)可知活性炭表面有大量的
②写出步骤(iii)的离子反应方程式:
(4)一定温度下,pH对再生反应的影响如图所示。

①当
 时,
时, 的转化率随pH的减小而降低
的转化率随pH的减小而降低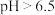 时,
时, 的转化率随pH的增大而降低的原因是
的转化率随pH的增大而降低的原因是(5)一定pH下,反应相同时间,
 的转化率随温度的升高而增大,可能的原因是
的转化率随温度的升高而增大,可能的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。

(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线__________ 。
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol。则反应向_________ 反应方向进行(填“正”或“逆”)。判断依据是_______ 。反应达到平衡后,各物质的体积分数与原平衡相比_______ (填序号)。
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
 2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol。则反应向
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】按要求填空
Ⅰ.可逆反应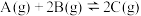
 ,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
(1)升高温度,v(正)___________ 。
(2)使用催化剂,A的物质的量___________ 。
(3)压缩容器体积,v(逆)___________ ,C占混合气体的体积分数___________ 。
(4)增大A的浓度,则B的转化率___________ 。
Ⅱ. 已知可逆反应: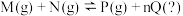 请回答下列问题:
请回答下列问题:
(5)在某温度下,反应物的起始浓度分别为: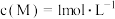 ,
,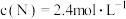 ;
; 后达到平衡,
后达到平衡, 的转化率为
的转化率为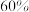 ,此时
,此时 的转化率为
的转化率为___________ ;用物质P表示的反应速率为___________ 。
(6)若其他条件不变,加热后P的质量分数减少,则正反应是___________ 热反应。
(7)若其他条件不变,增大压强时,如果平衡不发生移动,则Q是___________ 态(填“气”、“液”、“固”),n=___________ 。
Ⅰ.可逆反应
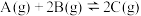
 ,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:(1)升高温度,v(正)
(2)使用催化剂,A的物质的量
(3)压缩容器体积,v(逆)
(4)增大A的浓度,则B的转化率
Ⅱ. 已知可逆反应:
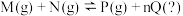 请回答下列问题:
请回答下列问题:(5)在某温度下,反应物的起始浓度分别为:
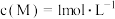 ,
,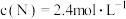 ;
; 后达到平衡,
后达到平衡, 的转化率为
的转化率为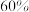 ,此时
,此时 的转化率为
的转化率为(6)若其他条件不变,加热后P的质量分数减少,则正反应是
(7)若其他条件不变,增大压强时,如果平衡不发生移动,则Q是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)某温度下,在2L密闭容器中,充入2.4mol CO2和4.4molH2,发生合成甲醇的反应,CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得甲醇的物质的量浓度随时间的变化图象如图(1)中的曲线I,则前4分钟ν(CO2)=
CH3OH(g)+H2O(g),测得甲醇的物质的量浓度随时间的变化图象如图(1)中的曲线I,则前4分钟ν(CO2)=___ ;若在1 min时,改变某一反应条件,曲线I变为曲线II,则改变的条件为___ ;该温度下反应的化学平衡常数为___ 。
(2)在另一温度下发生合成甲醇的反应,如图(2)关闭K,向A容器中充入1molCO2和4molH2,向B容器中充入1.2molCO2和4.8molH2,两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为0.9aL,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为___ L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。

 CH3OH(g)+H2O(g),测得甲醇的物质的量浓度随时间的变化图象如图(1)中的曲线I,则前4分钟ν(CO2)=
CH3OH(g)+H2O(g),测得甲醇的物质的量浓度随时间的变化图象如图(1)中的曲线I,则前4分钟ν(CO2)=(2)在另一温度下发生合成甲醇的反应,如图(2)关闭K,向A容器中充入1molCO2和4molH2,向B容器中充入1.2molCO2和4.8molH2,两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为0.9aL,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g) CH3OH(g)+ H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g)+ H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=___________ 。
(2)500℃该反应的平衡常数为___________ (结果保留一位小数),图2是改变温度时化学反应速率随时间变化的示意图,若降低温度到400℃进行,达平衡时,K值___________ (填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是___________ 。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.将水蒸气从体系中分离出 E.使用更有效的催化剂
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.4mol/L,则此时v(正)___________ v(逆)(填“>”“<”或“=”)。
 CH3OH(g)+ H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g)+ H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
(2)500℃该反应的平衡常数为
(3)下列措施中不能使CO2的转化率增大的是
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.将水蒸气从体系中分离出 E.使用更有效的催化剂
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.4mol/L,则此时v(正)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】硫酸是一种重要的基本化工产品。接触法制硫酸生产中的氧化工序为:
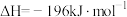 ,问答下列问题:
,问答下列问题:
(1)在甲、乙两个容器中(初始时体积相同)分别充入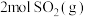 和
和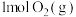 ,在相同温度下进行反应。其中甲容器保持容积不变,乙容器保持压强不变,当容器中的反应达到平衡时,甲中
,在相同温度下进行反应。其中甲容器保持容积不变,乙容器保持压强不变,当容器中的反应达到平衡时,甲中 的百分含量为a,乙中
的百分含量为a,乙中 的百分含量为b,则a
的百分含量为b,则a___________ b(填“大于”、“小于”、“等于”)。
(2)若 、
、 、
、 (不参与反应)起始的物质的量分数分别为10%、15%和75%时,在
(不参与反应)起始的物质的量分数分别为10%、15%和75%时,在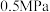 、
、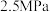 和
和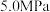 压强下,
压强下, 平衡转化率
平衡转化率 随温度的变化如图所示。反应在
随温度的变化如图所示。反应在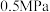 、550℃时,
、550℃时, 平衡转化率
平衡转化率
___________ ,判断的依据是___________ 。下列因素中能影响 的因素有
的因素有___________ (填字母)。


A.压强 B.反应物的初始量 C.催化剂 D.温度
(3)若将物质的量为 的
的 和
和 通入反应器,在恒温t、恒压p条件下发生反应
通入反应器,在恒温t、恒压p条件下发生反应
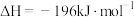 。平衡时,若
。平衡时,若 转化率为a,平衡常数
转化率为a,平衡常数
___________ (以分压表示,分出=总压×物质的量分数,用p、a来表示)

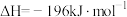 ,问答下列问题:
,问答下列问题:(1)在甲、乙两个容器中(初始时体积相同)分别充入
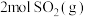 和
和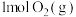 ,在相同温度下进行反应。其中甲容器保持容积不变,乙容器保持压强不变,当容器中的反应达到平衡时,甲中
,在相同温度下进行反应。其中甲容器保持容积不变,乙容器保持压强不变,当容器中的反应达到平衡时,甲中 的百分含量为a,乙中
的百分含量为a,乙中 的百分含量为b,则a
的百分含量为b,则a(2)若
 、
、 、
、 (不参与反应)起始的物质的量分数分别为10%、15%和75%时,在
(不参与反应)起始的物质的量分数分别为10%、15%和75%时,在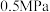 、
、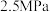 和
和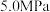 压强下,
压强下, 平衡转化率
平衡转化率 随温度的变化如图所示。反应在
随温度的变化如图所示。反应在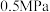 、550℃时,
、550℃时, 平衡转化率
平衡转化率
 的因素有
的因素有

A.压强 B.反应物的初始量 C.催化剂 D.温度
(3)若将物质的量为
 的
的 和
和 通入反应器,在恒温t、恒压p条件下发生反应
通入反应器,在恒温t、恒压p条件下发生反应
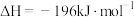 。平衡时,若
。平衡时,若 转化率为a,平衡常数
转化率为a,平衡常数
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】已知2CO(g) CO2(g)+C(s),T=980K时,ΔH-TΔS=0
CO2(g)+C(s),T=980K时,ΔH-TΔS=0
(1)当体系温度低于980K时,估计ΔH-TΔS______ (填“大于”“小于”或“等于”)0,当体系温度高于980K时,估计ΔH-TΔS______ (填“大于”“小于”或“等于”)0。
(2)在冶金工业中,以C为还原剂,温度高于980K时的氧化产物是以______ 为主,温度低于980K时的氧化产物是以_____ 为主。
 CO2(g)+C(s),T=980K时,ΔH-TΔS=0
CO2(g)+C(s),T=980K时,ΔH-TΔS=0(1)当体系温度低于980K时,估计ΔH-TΔS
(2)在冶金工业中,以C为还原剂,温度高于980K时的氧化产物是以
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】正确判断反应自发进行的方向对于生产实践具有重要的意义。回答下列问题:
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解 ,发生反应:
,发生反应: 。该反应的
。该反应的
___________ (填“>”、“<”或“=”,下同)0,
___________ 0,在低温下,该反应___________ (填“能”或“不能”)自发进行。
(2)超音速飞机在平流层飞行时,尾气中的 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的 和
和 转变成
转变成 和
和 ,反应的方程式为
,反应的方程式为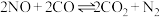 。反应在常温下能够自发进行,则反应的
。反应在常温下能够自发进行,则反应的
___________ (填“>”、“<”或“=”)0。
(3)某吸热反应能自发进行,则该反应的
___________ (填“>”或“<”)0。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解
 ,发生反应:
,发生反应: 。该反应的
。该反应的

(2)超音速飞机在平流层飞行时,尾气中的
 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的 和
和 转变成
转变成 和
和 ,反应的方程式为
,反应的方程式为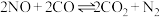 。反应在常温下能够自发进行,则反应的
。反应在常温下能够自发进行,则反应的
(3)某吸热反应能自发进行,则该反应的

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.已知在氨水中存在下平衡:NH3+H2O NH3·H2O
NH3·H2O NH
NH +OH-。
+OH-。
(1)向氨水中加入 固体时,平衡向
固体时,平衡向_______ (填“左”或“右”)移动,OH-的浓度_______ (填“增大”或“减小”,下同), 的浓度
的浓度_______ 。
(2)向氨水中加入浓盐酸,平衡向_______ (填“左”或“右”)移动,此时溶液中浓度减小的微粒有_______ 。
(3)向氨水中加入少量的NaOH固体,平衡向_______ (填“左”或“右”)移动。
Ⅱ.地下水中的氮污染主要是由 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:2NO
将硝酸盐还原成氮气:2NO +5H2
+5H2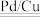 N2↑+2OH-+4H2O。
N2↑+2OH-+4H2O。
(4)下列说法错误的是_______ (填序号)。
A.氮肥 溶于水的过程中熵值增大
溶于水的过程中熵值增大
B.在酸性条件下,活泼金属与 反应属于自发反应
反应属于自发反应
C.Pd/Cu双金属催化剂是该反应是否能自发发生的决定因素
(5)已知:2NO +5H2
+5H2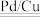 N2↑+2OH-+4H2O的
N2↑+2OH-+4H2O的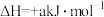 ,
,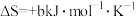 (a、b均为正值),该反应
(a、b均为正值),该反应_______ (填“能”“不能”或“无法判断是否能”)自发进行。
 NH3·H2O
NH3·H2O NH
NH +OH-。
+OH-。(1)向氨水中加入
 固体时,平衡向
固体时,平衡向 的浓度
的浓度(2)向氨水中加入浓盐酸,平衡向
(3)向氨水中加入少量的NaOH固体,平衡向
Ⅱ.地下水中的氮污染主要是由
 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:2NO
将硝酸盐还原成氮气:2NO +5H2
+5H2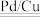 N2↑+2OH-+4H2O。
N2↑+2OH-+4H2O。(4)下列说法错误的是
A.氮肥
 溶于水的过程中熵值增大
溶于水的过程中熵值增大B.在酸性条件下,活泼金属与
 反应属于自发反应
反应属于自发反应C.Pd/Cu双金属催化剂是该反应是否能自发发生的决定因素
(5)已知:2NO
 +5H2
+5H2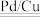 N2↑+2OH-+4H2O的
N2↑+2OH-+4H2O的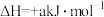 ,
,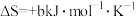 (a、b均为正值),该反应
(a、b均为正值),该反应
您最近一年使用:0次



