按要求填空
(1)NH4Cl溶液呈酸性,用离子方程式表示其原因___________________________________ ;
(2)25℃时1g甲烷完全燃烧生成二氧化碳气体和液态水,放出56千焦的热量,写出该反应的热化学方程式:_____________________________ ;
(3)铁在空气中发生吸氧腐蚀时的正极反应方程式:_________________________________
(4)硫酸铜溶液通电时发生的化学反应方程式:_______________________________
(1)NH4Cl溶液呈酸性,用离子方程式表示其原因
(2)25℃时1g甲烷完全燃烧生成二氧化碳气体和液态水,放出56千焦的热量,写出该反应的热化学方程式:
(3)铁在空气中发生吸氧腐蚀时的正极反应方程式:
(4)硫酸铜溶液通电时发生的化学反应方程式:
更新时间:2020-02-21 11:49:29
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1___ ΔH2(填“>”“<”或“=”,下同)。
(2)相同条件下,1 molP4所具有的能量___ 4 molP原子所具有的能量。
(3)已知P4(白磷,s)⇌4P(红磷,s) ΔH=-17kJ·mol-1,比较下列反应中ΔH的大小:ΔH1___ ΔH2。
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
(4)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,则浓硫酸和稀氢氧化钠溶液反应生成2mol水,放出的热量___ 114.6kJ。
(5)已知:28gFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了akJ热量,该反应的热化学方程式是___ 。
(2)相同条件下,1 molP4所具有的能量
(3)已知P4(白磷,s)⇌4P(红磷,s) ΔH=-17kJ·mol-1,比较下列反应中ΔH的大小:ΔH1
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
(4)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,则浓硫酸和稀氢氧化钠溶液反应生成2mol水,放出的热量
(5)已知:28gFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了akJ热量,该反应的热化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】I.写出对应的反应热和热化学方程式
(1)足量H2在1molO2中完全燃烧生成2mol液态水,放出571.6k的热量,则H2的燃烧热ΔH=___________ 。
(2)已知:8g的CH4与足量的O2反应,生成CO2和液态水,放出445.15kJ的热量写出表示甲烷燃烧的热化学方程式:___________ 。
Ⅱ.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为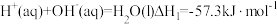
(3)下列各组试剂混合发生反应的离子方程式为 的是
的是___________ (填序号)。
A.盐酸与氢氧化钠溶液B.稀硫酸与氢氧化钡溶液
C.醋酸与氢氧化钠固体D.硫酸氢钠溶液与氢氧化钠溶液
E.氢氧化镁溶于稀盐酸
(4)若稀硫酸与氢氧化钠固体反应生成1mo1H2O(1),则反应放出的热量___________ (填“>”“<”或“=”)57.3kJ,原因是___________ 。
Ⅲ.如图所示,某反应在不同条件下的反应历程分别为a、b。
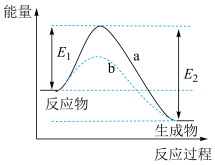
(5)据图可判断出反应物的总键能___________ (填“>”“<”或“=”)生成物的总键能,则该反应的反应热ΔH___________ 0。
(1)足量H2在1molO2中完全燃烧生成2mol液态水,放出571.6k的热量,则H2的燃烧热ΔH=
(2)已知:8g的CH4与足量的O2反应,生成CO2和液态水,放出445.15kJ的热量写出表示甲烷燃烧的热化学方程式:
Ⅱ.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为
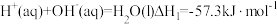
(3)下列各组试剂混合发生反应的离子方程式为
 的是
的是A.盐酸与氢氧化钠溶液B.稀硫酸与氢氧化钡溶液
C.醋酸与氢氧化钠固体D.硫酸氢钠溶液与氢氧化钠溶液
E.氢氧化镁溶于稀盐酸
(4)若稀硫酸与氢氧化钠固体反应生成1mo1H2O(1),则反应放出的热量
Ⅲ.如图所示,某反应在不同条件下的反应历程分别为a、b。

(5)据图可判断出反应物的总键能
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)①CaCO3(s)=CaO(s) + CO2(g) ΔH = + 177.7 kJ·mol-1
②C(s) + H2O(g)=CO(g) + H2(g) ΔH = -131.3 kJ·mol-1
③1/2H2SO4(l) + NaOH(l)=1/2Na2SO4(l) + H2O(l) ΔH = -57.3 kJ·mol-1
④C(s) + O2(g)=CO2(g) ΔH = -393.5 kJ·mol-1
⑤CO(g) + 1/2O2(g)=CO2(g) ΔH = -283 kJ·mol-1
(a)上述热化学方程式中表示不正确 的有__ (填序号)。
(b)根据上述信息,写出C转化为CO的热化学方程式__________ 。
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g)ΔH = -241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为__ kJ·mol-1。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) ΔH =﹣574 kJ·mol-1
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) ΔH =﹣1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为__ (用阿伏加 德罗常数NA表示),放出的热量为__ kJ。
(4)下列有关中和热的说法正确的是( )
A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH= -57.3 kJ·mol-1
B.准确测量中和热的实验过程中,至少需记录温度4次
C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,测量出的中和热数值偏小
D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1,则该反应的中和热为57.3 kJ·mol-1
②C(s) + H2O(g)=CO(g) + H2(g) ΔH = -131.3 kJ·mol-1
③1/2H2SO4(l) + NaOH(l)=1/2Na2SO4(l) + H2O(l) ΔH = -57.3 kJ·mol-1
④C(s) + O2(g)=CO2(g) ΔH = -393.5 kJ·mol-1
⑤CO(g) + 1/2O2(g)=CO2(g) ΔH = -283 kJ·mol-1
(a)上述热化学方程式中表示
(b)根据上述信息,写出C转化为CO的热化学方程式
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g)ΔH = -241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) ΔH =﹣574 kJ·mol-1
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) ΔH =﹣1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为
(4)下列有关中和热的说法正确的是
A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH= -57.3 kJ·mol-1
B.准确测量中和热的实验过程中,至少需记录温度4次
C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,测量出的中和热数值偏小
D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1,则该反应的中和热为57.3 kJ·mol-1
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】根据下表提供的数据(常温下), 回答下列问题。
(1)浓度均为0.1 mol·L-1的①Na2CO3;②NaHCO3;③NaClO的pH由大到小排列的顺序为(用编号填写)___________________________ 。
(2)写出NaClO溶液中通入少量CO2气体的离子方程式:________________________
(3)在CaCO3粉末中加入少量的新制氯水充分反应,写出该反应的化学方程式_________________________________
(4)在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度的大小关系是___________
(5)在pH=8的NaClO和HClO混合液中,c(ClO-)/c(HClO)=_______________________
化学式 | HClO | H2CO3 | |
| 电离常数 | Ki=3×10-8 | Ki1=4.3×10-7 | Ki2=5.6×10-11 |
(1)浓度均为0.1 mol·L-1的①Na2CO3;②NaHCO3;③NaClO的pH由大到小排列的顺序为(用编号填写)
(2)写出NaClO溶液中通入少量CO2气体的离子方程式:
(3)在CaCO3粉末中加入少量的新制氯水充分反应,写出该反应的化学方程式
(4)在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度的大小关系是
(5)在pH=8的NaClO和HClO混合液中,c(ClO-)/c(HClO)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】常温下,常见的弱酸的电离平衡常数如下表所示:
(1)将少量CO2气体通入NaClO溶液中的离子方程式为_______ 。
(2)常温下,某氨水的浓度为2.0 mol·L-1
①该溶液中的c(OH-)=_______ 。
②把SO2通入氨水中,当溶液呈中性时,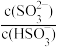 =
=_______ 。
(3)已知常温下0.1 mol·L-1的CH3COONa和NaHCO3的pH分别为8.9和8.3,而水解常数Kh(CH3COO-)<Kh( ),则NaHCO3溶液pH更小的原因是
),则NaHCO3溶液pH更小的原因是_______ 。
| 酸 | CH3COOH | HClO | NH3·H2O | H2SO3 | H2CO3 |
| 电离平衡常数 | 1.75×10-5 | 4.0×10-8 | 1.8×10-5 | Ka1=1.4×10-2 Ka2=6.0×10-8 | Ka1=4.5×10-7 Ka2=4.7×10-11 |
(2)常温下,某氨水的浓度为2.0 mol·L-1
①该溶液中的c(OH-)=
②把SO2通入氨水中,当溶液呈中性时,
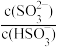 =
=(3)已知常温下0.1 mol·L-1的CH3COONa和NaHCO3的pH分别为8.9和8.3,而水解常数Kh(CH3COO-)<Kh(
 ),则NaHCO3溶液pH更小的原因是
),则NaHCO3溶液pH更小的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】请回答下列问题:
(1)AlCl3水溶液呈___________ 性,原因是___________ (用离子方程式表示,下同),___________ (填“促进”或“抑制”)水的电离。
(2)常温下,有两种溶液:0.1mol·L-1CH3COOH溶液;0.1mol·L-1CH3COONa溶液。
①0.1mol·L-1CH3COONa溶液呈___________ (填“酸”“碱”或“中”)性。其原因是___________ (用离子方程式和适当的叙述说明)。
②下列说法正确的是___________ (填序号)。
A.两种溶液中c(CH3COO﹣)都等于0.1mol·L-1
B.两种溶液中c(CH3COO﹣)都小于0.1mol·L-1
C.CH3COOH溶液中c(CH3COO﹣)小于CH3COONa溶液中c(CH3COO﹣)
(1)AlCl3水溶液呈
(2)常温下,有两种溶液:0.1mol·L-1CH3COOH溶液;0.1mol·L-1CH3COONa溶液。
①0.1mol·L-1CH3COONa溶液呈
②下列说法正确的是
A.两种溶液中c(CH3COO﹣)都等于0.1mol·L-1
B.两种溶液中c(CH3COO﹣)都小于0.1mol·L-1
C.CH3COOH溶液中c(CH3COO﹣)小于CH3COONa溶液中c(CH3COO﹣)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)
图1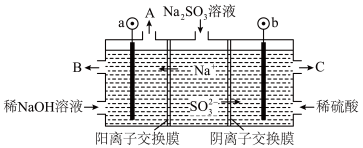 图2
图2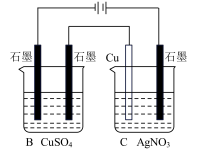
(1)图1中a极要连接电源的__________ (填“正”或“负”)极,SO32-放电的电极反应__________
(2)在图2所示的装置中,若通入直流电5 min时,铜电极质量增加2.16g,试回答:
①溶液pH变化:B__________ ,C__________ (填“增大”“减小”或“不变”)。
②通电5 min时,B中共收集224mL气体(标准状况),溶液体积为200mL,则通电前CuSO4溶液的物质的量浓度为__________ (设电解前后溶液体积无变化)。
图1
 图2
图2
(1)图1中a极要连接电源的
(2)在图2所示的装置中,若通入直流电5 min时,铜电极质量增加2.16g,试回答:
①溶液pH变化:B
②通电5 min时,B中共收集224mL气体(标准状况),溶液体积为200mL,则通电前CuSO4溶液的物质的量浓度为
您最近一年使用:0次
【推荐2】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
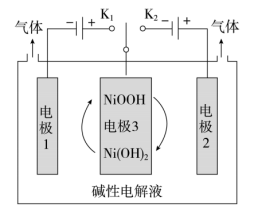
①制H2时,连接_______ 。产生H2的电极反应式是_______ 。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:_______ 。
(2)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
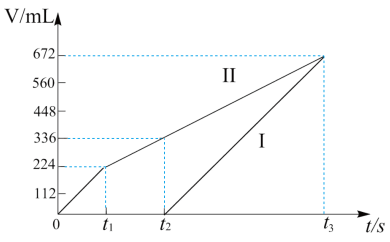
①原混合溶液中NaCl和CuSO4的物质的量浓度_______ 。
②电解至t3时,消耗水的质量_______ 。
(1)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:
(2)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)

①原混合溶液中NaCl和CuSO4的物质的量浓度
②电解至t3时,消耗水的质量
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)防治环境污染,改善生态环境已成为全球的共识。
①空气质量报告的各项指标能体现空气的质量。下列各项指标不需要监测的是___________ 。
A.可吸入颗粒物(PM2.5) B.NO2浓度 C.SO2浓度 D.CO2浓度
②下列措施有利于改善环境质量的是___________ 。
A.将废电池深埋,以减少重金属的污染
B.将地沟油回收再加工为食用油,以减缓水体富营养化
C.利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯
(2)采取适当的措施能减少对环境的污染。
①酸雨是指pH___________ 的降水,大量燃烧含硫煤产生气体随雨水降落到地面,pH随时间变长会有所减小,试用化学方程式解释其原因___________ 。
②一氧化碳也是常见的大气污染物。汽油在汽车发动机中的不完全燃烧可表示为2C8H18+23O2 12CO2+4CO+18H2O
12CO2+4CO+18H2O
某环境监测兴趣小组的同学描绘的市中心地区空气中CO含量变化曲线(横坐标表示北京时间0到24小时,纵坐标表示CO含量),你认为比较符合实际的是____________ 。
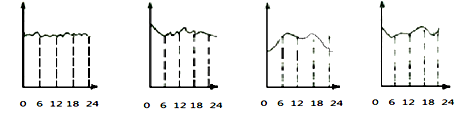
A B C D
③天然水中含有的细小悬浮颗粒可以用___________ 做混凝剂(写名称)进行净化处理。工业废水中含有的Cr3+离子,可用熟石灰作沉淀剂,在pH为8至9时生成沉淀而除去,该反应的离子方程式是_____________ 。
(3)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是___________ (填字母)。
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。从化学成分看,纤维素是一种___________ (填字母)。
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗____________ (填字母)。
A.麻黄碱 B.阿司匹林 C.抗酸药
(4)化学与材料密切相关。
①人工合成的塑料有多种,其中聚乙烯是常见的塑料制品,结构简式是___________ 。
②钢铁的腐蚀主要发生吸氧腐蚀,其正极的电极反应为___________ 。为防止轮船的船体在海水中被腐蚀,一般在船身连接_____________ (填“锌块”或“铜块”)。
①空气质量报告的各项指标能体现空气的质量。下列各项指标不需要监测的是
A.可吸入颗粒物(PM2.5) B.NO2浓度 C.SO2浓度 D.CO2浓度
②下列措施有利于改善环境质量的是
A.将废电池深埋,以减少重金属的污染
B.将地沟油回收再加工为食用油,以减缓水体富营养化
C.利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯
(2)采取适当的措施能减少对环境的污染。
①酸雨是指pH
②一氧化碳也是常见的大气污染物。汽油在汽车发动机中的不完全燃烧可表示为2C8H18+23O2
 12CO2+4CO+18H2O
12CO2+4CO+18H2O某环境监测兴趣小组的同学描绘的市中心地区空气中CO含量变化曲线(横坐标表示北京时间0到24小时,纵坐标表示CO含量),你认为比较符合实际的是

A B C D
③天然水中含有的细小悬浮颗粒可以用
(3)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。从化学成分看,纤维素是一种
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗
A.麻黄碱 B.阿司匹林 C.抗酸药
(4)化学与材料密切相关。
①人工合成的塑料有多种,其中聚乙烯是常见的塑料制品,结构简式是
②钢铁的腐蚀主要发生吸氧腐蚀,其正极的电极反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】电化学腐蚀分类
由于条件不同,钢铁的腐蚀可以分为析氢腐蚀和吸氧腐蚀两种类型。
(1)析氢腐蚀:在酸性环境中,由于腐蚀过程中不断有H2放出,所以叫做析氢腐蚀。
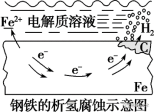
有关反应如下:
负极:___________ 。
正极:___________ 。
总反应:___________ 。
(2)吸氧腐蚀:如果钢铁表面吸附的水膜酸性很弱或呈中性,但溶有一定量的氧气,此时就发生吸氧腐蚀。
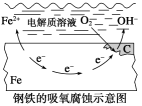
有关反应如下:
负极:___________ 。
正极:___________ 。
总反应:___________ 。
在空气中Fe(OH)2被进一步氧化成Fe(OH)3,Fe(OH)3失去部分水后生成Fe2O3·xH2O,它是铁锈的主要成分。
由于条件不同,钢铁的腐蚀可以分为析氢腐蚀和吸氧腐蚀两种类型。
(1)析氢腐蚀:在酸性环境中,由于腐蚀过程中不断有H2放出,所以叫做析氢腐蚀。

有关反应如下:
负极:
正极:
总反应:
(2)吸氧腐蚀:如果钢铁表面吸附的水膜酸性很弱或呈中性,但溶有一定量的氧气,此时就发生吸氧腐蚀。

有关反应如下:
负极:
正极:
总反应:
在空气中Fe(OH)2被进一步氧化成Fe(OH)3,Fe(OH)3失去部分水后生成Fe2O3·xH2O,它是铁锈的主要成分。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。

(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:
正极__________ ,负极________ 。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用甲图所示的方案,其中焊接在闸门上的固体材料R可以采用________ 。
A 铜 B 钠 C 锌 D 石墨
(3)乙图所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________ 极。

(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:
正极
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用甲图所示的方案,其中焊接在闸门上的固体材料R可以采用
A 铜 B 钠 C 锌 D 石墨
(3)乙图所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的
您最近一年使用:0次



