I.一密封体系中发生下列反应:N2+3H2 2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
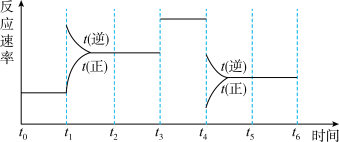
回答下列问题:
(1)处于平衡状态的时间段是___________ 、___________ 、___________ 。
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化:____________ 、___________ 、___________ 。
(3)下列各时间段时,氨的百分含量最高的是___________ (填序号)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
II.830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)△H<0。试回答下列问题:
CO2(g)+H2(g)△H<0。试回答下列问题:
(4)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____________ 。
(5)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态______ (填“是”与“否”),此时v(正)____ v(逆)(填“大于”“小于”或“等于”)。
 2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
回答下列问题:
(1)处于平衡状态的时间段是
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化:
(3)下列各时间段时,氨的百分含量最高的是
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
II.830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)
 CO2(g)+H2(g)△H<0。试回答下列问题:
CO2(g)+H2(g)△H<0。试回答下列问题:(4)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=
(5)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态
更新时间:2020-02-18 10:16:59
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】铁元素是人体必需微量元素中含量最多的一种。高铁酸钾(K2FeO4)具有很强的氧化性,是一种高效水处理剂。
(1)用K2FeO4处理废水时,可以杀菌消毒是利用其________ 性;又利用Fe(OH)3胶体的__________ 作用。
(2)K2FeO4在水中不稳定,发生反应:4FeO42-+10H2O 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。
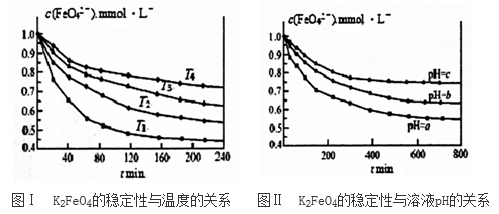
①由图Ⅰ可得出的结论是____________________________________ 。
②图Ⅱ中a__________ c (填“>”、“<”或“=”),其原因是____________________________ 。
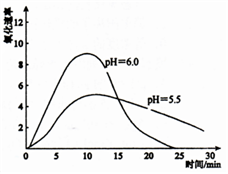
(3)资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O 4Fe(OH)3+8H+进一步研究在水溶 液中Fe2+的氧化机理,测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。从图中可以得出Fe2+的氧化速率与溶液中
4Fe(OH)3+8H+进一步研究在水溶 液中Fe2+的氧化机理,测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。从图中可以得出Fe2+的氧化速率与溶液中_________ 有关,___________ 越大,Fe2+容易被氧化。
(4)综合以上实验,增强Fe2+稳定性的措施除了可以向溶液中加铁粉外,还有_________ ;__________ 。
(1)用K2FeO4处理废水时,可以杀菌消毒是利用其
(2)K2FeO4在水中不稳定,发生反应:4FeO42-+10H2O
 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。
①由图Ⅰ可得出的结论是
②图Ⅱ中a
(3)资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O
 4Fe(OH)3+8H+进一步研究在水溶 液中Fe2+的氧化机理,测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。从图中可以得出Fe2+的氧化速率与溶液中
4Fe(OH)3+8H+进一步研究在水溶 液中Fe2+的氧化机理,测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。从图中可以得出Fe2+的氧化速率与溶液中
(4)综合以上实验,增强Fe2+稳定性的措施除了可以向溶液中加铁粉外,还有
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】“先拐先平”原则
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g) cC(g)为例]。
cC(g)为例]。
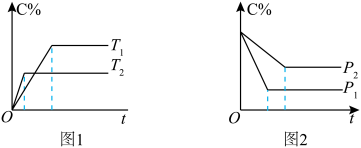
根据图像回答下列问题:
(1)图1中,温度T1、T2的大小关系是___________ ,温度升高,C%(C的含量)的变化是___________ ,化学平衡___________ 移动,正反应是___________ 反应。
(2)图2中,压强p1、p2的大小关系是___________ ,压强增大,C%(C的含量)的变化是___________ ,化学平衡___________ 移动,a+b___________ c。
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g)
 cC(g)为例]。
cC(g)为例]。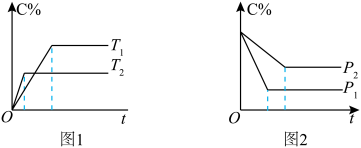
根据图像回答下列问题:
(1)图1中,温度T1、T2的大小关系是
(2)图2中,压强p1、p2的大小关系是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】化学反应速率是化学反应原理的重要组成部分。请回答下列问题:
(1)已知一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g)ΔH<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)。
2SO3(g)ΔH<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)。
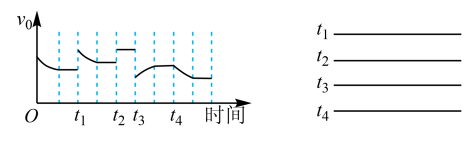
_______ 、________ 、_______ 、______
(2)探究反应条件对0.l0 mol·L-1Na2S2O3溶液与稀H2SO4反应速率的影响。其设计与测定结果如表:
上述实验①③是探究____ 对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为____ ,a为____ ;乙是实验需要测量的物理量,则表格中“乙”为____ 。
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是___ 的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入____ (填字母)。
A.硫酸钾 B.氯化锰 C.硫酸锰 D.水
(1)已知一定条件下发生反应:2SO2(g)+O2(g)
 2SO3(g)ΔH<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)。
2SO3(g)ΔH<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)。
(2)探究反应条件对0.l0 mol·L-1Na2S2O3溶液与稀H2SO4反应速率的影响。其设计与测定结果如表:
| 编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲 | 0.1mol·L-1H2SO4溶液/mL | 乙 |
| ① | 25℃ | 10.0 | 0 | 10.0 | |
| ② | 25℃ | 5.0 | a | 10.0 | |
| ③ | 45℃ | 10.0 | 0 | 10.0 |
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入
A.硫酸钾 B.氯化锰 C.硫酸锰 D.水
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】在200 ℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)  2HI(g)。
2HI(g)。
(1)反应刚开始时,化学反应速率________ 最大而________ 最小(为零)(填“v正” 或“v逆”)。
(2)当反应进行到v正与v逆_______ 时,此可逆反应就达到了最大限度,即化学平衡状态。若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将_________ 。
(3)下列条件的改变引起该反应的反应速率的变化是什么(填“加快”“不变”或“减慢”)。
a.缩小体积使压强增大:________ 。
b.体积不变充入氢气使压强增大:________ 。
c.加入催化剂:________ 。
d.降低温度:________ 。
(4)下列叙述能证明该反应已经达到化学平衡状态的是________ 。
a.容器内压强不再发生变化
b.HI的体积分数不再发生变化
c.容器内气体的总物质的量不再发生变化
d.容器内气体密度不再发生变化
(5) 对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知( )
a.化学反应速率变化时,化学平衡一定发生移动
b.化学平衡发生移动时,化学反应速率一定变化
c.正反应进行的程度增大,正反应速率一定大
d.只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
 2HI(g)。
2HI(g)。(1)反应刚开始时,化学反应速率
(2)当反应进行到v正与v逆
(3)下列条件的改变引起该反应的反应速率的变化是什么(填“加快”“不变”或“减慢”)。
a.缩小体积使压强增大:
b.体积不变充入氢气使压强增大:
c.加入催化剂:
d.降低温度:
(4)下列叙述能证明该反应已经达到化学平衡状态的是
a.容器内压强不再发生变化
b.HI的体积分数不再发生变化
c.容器内气体的总物质的量不再发生变化
d.容器内气体密度不再发生变化
(5) 对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知
a.化学反应速率变化时,化学平衡一定发生移动
b.化学平衡发生移动时,化学反应速率一定变化
c.正反应进行的程度增大,正反应速率一定大
d.只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】在如图所示的恒温、恒压密闭容器中加入 2mol X 和 2mol Y,发生如下反应并达到平衡(X、Y 状态未知):2X(?)+Y(?)  a Z(g)。起始时容器的体积为 V L,达到平衡时 X、Y、Z 的物质的量之比为 1:3:2,且容器的体积仍然为 V L。
a Z(g)。起始时容器的体积为 V L,达到平衡时 X、Y、Z 的物质的量之比为 1:3:2,且容器的体积仍然为 V L。

(1)a =___________ ;
(2)平衡时 Y 的转化率=___________ ;
(3)X 的状态为___________ ,Y 的状态为___________ (填“气态”或“非气态”);
(4)下列叙述中,不能说明上述反应达到限度的是___________ (填编号)。
a.气体密度不变 b.单位时间内消耗 2mol X,同时生成 amol Z
c.Y 的转化率不再变化 d.Z 的浓度不再变化
e.气体的质量不随时间的变化而变化
(5)若上述反应在恒温恒容下达到平衡后,在相同条件下,充入0.5mol Y,再次平衡时,Y的转化率___________ (填减小,不变,或增大)
 a Z(g)。起始时容器的体积为 V L,达到平衡时 X、Y、Z 的物质的量之比为 1:3:2,且容器的体积仍然为 V L。
a Z(g)。起始时容器的体积为 V L,达到平衡时 X、Y、Z 的物质的量之比为 1:3:2,且容器的体积仍然为 V L。 
(1)a =
(2)平衡时 Y 的转化率=
(3)X 的状态为
(4)下列叙述中,不能说明上述反应达到限度的是
a.气体密度不变 b.单位时间内消耗 2mol X,同时生成 amol Z
c.Y 的转化率不再变化 d.Z 的浓度不再变化
e.气体的质量不随时间的变化而变化
(5)若上述反应在恒温恒容下达到平衡后,在相同条件下,充入0.5mol Y,再次平衡时,Y的转化率
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】运用化学反应原理研究化学反应有重要的意义。请回答下列问题:
(1)已知在25 ℃,101 kPa下,断开1 mol H—H键要吸收436 kJ的能量,断开1 mol I—I键要吸收151 kJ的能量,断开1 mol I—H键要吸收298 kJ的能量。
①通过以上数据计算当I2和 H2反应生成2 mol H—I时会放出9kJ的能量;若将1 mol I2和1 mol H2置于密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25 ℃,101 kPa)远小于上述计算值,你认为最可能 的原因是_______________________ 。
(2)一定条件下,甲烷与水蒸气发生反应:CH4(g) + H2O(g) CO(g) + 3H2(g),工业上可利用此反应生产合成氨原料气H2。
CO(g) + 3H2(g),工业上可利用此反应生产合成氨原料气H2。
①一定温度下,向2L恒容密闭容器中充入1.6 mol CH4和2.4 mol H2O(g)发生上述反应,CO(g)的物质的量随时间的变化如图所示。0~2 min内的平均反应速率υ(H2)=__________ mol·L-1·min-1, 平衡时CH4的转化率为_____________ 。[转化率= ×100%]
×100%]

②若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外, 还可以采取的措施有_______________________ (任写一条)。
③下列能说明上述反应达到平衡状态的是________ (填代号)。
a υ逆(CH4)=3υ正(H2)
b 恒温恒容时,容器内混合气体的密度保持不变
c CH4(g)、H2O(g)的浓度保持不变
d CH4(g)、H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1:3
e 断开3 mol H-H键的同时断开2 mol O-H键
(1)已知在25 ℃,101 kPa下,断开1 mol H—H键要吸收436 kJ的能量,断开1 mol I—I键要吸收151 kJ的能量,断开1 mol I—H键要吸收298 kJ的能量。
①通过以上数据计算当I2和 H2反应生成2 mol H—I时会放出9kJ的能量;若将1 mol I2和1 mol H2置于密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25 ℃,101 kPa)远小于上述计算值,你认为
(2)一定条件下,甲烷与水蒸气发生反应:CH4(g) + H2O(g)
 CO(g) + 3H2(g),工业上可利用此反应生产合成氨原料气H2。
CO(g) + 3H2(g),工业上可利用此反应生产合成氨原料气H2。①一定温度下,向2L恒容密闭容器中充入1.6 mol CH4和2.4 mol H2O(g)发生上述反应,CO(g)的物质的量随时间的变化如图所示。0~2 min内的平均反应速率υ(H2)=
 ×100%]
×100%]
②若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外, 还可以采取的措施有
③下列能说明上述反应达到平衡状态的是
a υ逆(CH4)=3υ正(H2)
b 恒温恒容时,容器内混合气体的密度保持不变
c CH4(g)、H2O(g)的浓度保持不变
d CH4(g)、H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1:3
e 断开3 mol H-H键的同时断开2 mol O-H键
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】氨是化肥工业和化工生产的主要原料,工业合成氨使用的氢气主要来自合成气( ,
, 混合气体)。回答下列问题:
混合气体)。回答下列问题:
(1)合成氨的热化学方程式为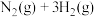


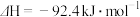 ,升高温度,合成氨反应的平衡常数
,升高温度,合成氨反应的平衡常数_______ (填“增大”“不变”或“减小”)。理论上,为了增大平衡时 的转化率,可采取的措施是
的转化率,可采取的措施是_____ (填字母)。
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物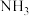
(2)合成氨的原料 可通过反应
可通过反应

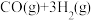
 来获取,已知该反应中,当初始混合气中的
来获取,已知该反应中,当初始混合气中的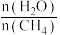 恒定时,温度、压强对平衡混合气中
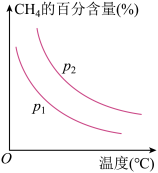
恒定时,温度、压强对平衡混合气中 的百分含量的影响如图所示:
的百分含量的影响如图所示:
图中两条曲线表示压强的关系是:
________  (填“>”“<”或“=”下同),
(填“>”“<”或“=”下同),
________ 0。
(3) 的另外一个反应为
的另外一个反应为

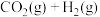
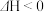 ,一定条件下,反应达到平衡后,采取
,一定条件下,反应达到平衡后,采取______________ 措施可提高 的转化率。
的转化率。
 ,
, 混合气体)。回答下列问题:
混合气体)。回答下列问题:(1)合成氨的热化学方程式为
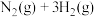


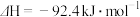 ,升高温度,合成氨反应的平衡常数
,升高温度,合成氨反应的平衡常数 的转化率,可采取的措施是
的转化率,可采取的措施是a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物
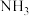
(2)合成氨的原料
 可通过反应
可通过反应

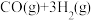
 来获取,已知该反应中,当初始混合气中的
来获取,已知该反应中,当初始混合气中的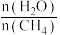 恒定时,温度、压强对平衡混合气中
恒定时,温度、压强对平衡混合气中 的百分含量的影响如图所示:
的百分含量的影响如图所示:图中两条曲线表示压强的关系是:

 (填“>”“<”或“=”下同),
(填“>”“<”或“=”下同),

(3)
 的另外一个反应为
的另外一个反应为

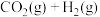
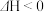 ,一定条件下,反应达到平衡后,采取
,一定条件下,反应达到平衡后,采取 的转化率。
的转化率。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气 (CO与H2的混合气体) 转化成甲醇,反应为CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
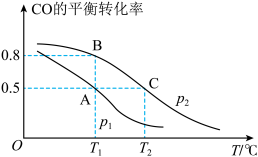
(1)CO 的平衡转化率与温度、压强的关系如图所示。
①P1、P2的大小关系是P1_______ P2 (填“>”“<”或“=”) 。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是_______ 。
③列叙述能说明上述反应能达到化学平衡状态的是_______ (填字母)。
a.V正(H2)=V逆(CH3OH) b.CH3OH的体积分数不再改变
c.混合气体的平均摩尔质量不再改变 d.同一时间内,消耗0.04molH2, 生成0.02molCO
(2)在T2℃、P2压强时,往一容积为2L的密团容器内,充入0.3molCO与 0.4molH2发生反应。
① 平衡时H2的体积分数是___________ ;平衡后再加入1.0molCO后重新到达平衡,则CO的转化率___________ (填“增大””不变“成“减小”),CO与CH3OH的浓度比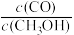
___________ (填"增大”“不变”或“减小”)。
②若P2压强恒定为P,则平衡常数KP=_______ (KP用气体平行分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含P的最简表达式)。
 CH3OH(g)。
CH3OH(g)。
(1)CO 的平衡转化率与温度、压强的关系如图所示。
①P1、P2的大小关系是P1
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
③列叙述能说明上述反应能达到化学平衡状态的是
a.V正(H2)=V逆(CH3OH) b.CH3OH的体积分数不再改变
c.混合气体的平均摩尔质量不再改变 d.同一时间内,消耗0.04molH2, 生成0.02molCO
(2)在T2℃、P2压强时,往一容积为2L的密团容器内,充入0.3molCO与 0.4molH2发生反应。
① 平衡时H2的体积分数是
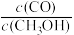
②若P2压强恒定为P,则平衡常数KP=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
(1)上述生成Ni(CO)4(g)的反应为_______ 反应(填“放热”或“吸热”)
(2)在25 ℃时,反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为_______ 。
(3)在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正_______ v逆。
(4)在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为_______ 。
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
(2)在25 ℃时,反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为
(3)在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正
(4)在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)在T1℃时,向容积为2L的密闭容器甲中加入1molN2、3 molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g) DH<0,10min时各物质的浓度不再变化,测得NH3物质的量为0.4mol。
2NH3(g) DH<0,10min时各物质的浓度不再变化,测得NH3物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为__________ mol·L-1·min-1,N2的转化率为_______ 。
②在T1℃时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1molNH3,则达到平衡时NH3的物质的量为_______ (填选项字母)
A.大于0.4mol B.等于0.4mol C.小于0.4mol
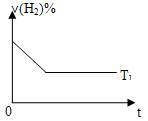
③下图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时的H2体积分数随时间t的变化曲线,___________ 。
(2)明矾可做净水剂是因为(用离子方程式表示)_________ ;
向明矾的水溶液中加入饱和的小苏打溶液发生反应的离子方程式为________________________ 。
 2NH3(g) DH<0,10min时各物质的浓度不再变化,测得NH3物质的量为0.4mol。
2NH3(g) DH<0,10min时各物质的浓度不再变化,测得NH3物质的量为0.4mol。①该反应在0~10min时间内H2的平均反应速率为
②在T1℃时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1molNH3,则达到平衡时NH3的物质的量为
A.大于0.4mol B.等于0.4mol C.小于0.4mol
③下图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时的H2体积分数随时间t的变化曲线,

(2)明矾可做净水剂是因为(用离子方程式表示)
向明矾的水溶液中加入饱和的小苏打溶液发生反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】自氢气生物学效应发现以来,氢气对以脑血管疾病为代表和以老年性痴呆为代表的中枢神经系统功能紊乱都具有明显的保护作用。工业上一般利用天然气、水煤气、甲醇等制取H2,已知用甲醇获得氢气的一种工艺流程如图所示:

已知:PSA装置是利用变压吸附技术分离提取纯氢。
回答下列问题:
若 最终分解率与CO最终转化率均为99%,试计算当氢气产量为
最终分解率与CO最终转化率均为99%,试计算当氢气产量为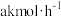 时,甲醇的投料量=
时,甲醇的投料量=___________ 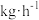 (列出计算式即可,不考虑副反应)。
(列出计算式即可,不考虑副反应)。

已知:PSA装置是利用变压吸附技术分离提取纯氢。
回答下列问题:
若
 最终分解率与CO最终转化率均为99%,试计算当氢气产量为
最终分解率与CO最终转化率均为99%,试计算当氢气产量为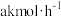 时,甲醇的投料量=
时,甲醇的投料量=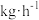 (列出计算式即可,不考虑副反应)。
(列出计算式即可,不考虑副反应)。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。烟道气和汽车尾气 、
、 等)是造成雾霾天气的原因之一,对这些排放气的处理以及再利用是化学工作者研究的重要课题。请思考回答下列问题:
等)是造成雾霾天气的原因之一,对这些排放气的处理以及再利用是化学工作者研究的重要课题。请思考回答下列问题:
(1)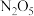 在一定条件下可发生分解:
在一定条件下可发生分解: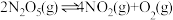 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
(2)在有氧参与和新型催化剂作用下, 和
和 可以反应生成
可以反应生成 。将一定比例的
。将一定比例的 、
、 和
和 通入装有新型催化剂的反应器。测得相同时间内
通入装有新型催化剂的反应器。测得相同时间内 去除率随温度变化如图所示:
去除率随温度变化如图所示:
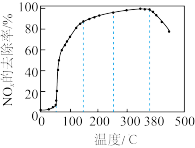
在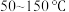 范围内,
范围内, 的去除率快速上升的原因为
的去除率快速上升的原因为_______ ;在 后,
后, 的去除率下降的原因,一可能为催化剂活性降低,二可能为
的去除率下降的原因,一可能为催化剂活性降低,二可能为_______ 。
(3)工业上可用“氨催化氧化法”生产 ,以氨气、氧气为原料,在催化剂存在下生成
,以氨气、氧气为原料,在催化剂存在下生成 和副产物
和副产物 的化学方程式如下:
的化学方程式如下:
I.
Ⅱ.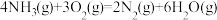
已知: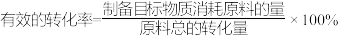
1L恒容密闭容器中充入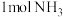 、
、 ,在催化剂作用下发生两个竞争反应I、Ⅱ,测得不同温度下反应相同时间有关物质的量关系如图所示:
,在催化剂作用下发生两个竞争反应I、Ⅱ,测得不同温度下反应相同时间有关物质的量关系如图所示:
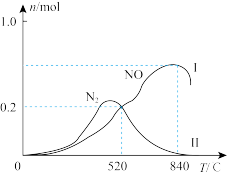
① 时,
时, 的有效转化率为
的有效转化率为_______ 。
②工业用氨催化氧化制备 ,选择的最佳温度是
,选择的最佳温度是_______ 。
③ 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
_______ (保留3位有效数字)。
 、
、 等)是造成雾霾天气的原因之一,对这些排放气的处理以及再利用是化学工作者研究的重要课题。请思考回答下列问题:
等)是造成雾霾天气的原因之一,对这些排放气的处理以及再利用是化学工作者研究的重要课题。请思考回答下列问题:(1)
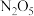 在一定条件下可发生分解:
在一定条件下可发生分解: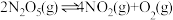 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量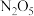 进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。A. 和 和 的浓度比保持不变 的浓度比保持不变 | B.容器中压强不再变化 |
C.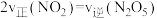 | D.气体的密度保持不变 |
(2)在有氧参与和新型催化剂作用下,
 和
和 可以反应生成
可以反应生成 。将一定比例的
。将一定比例的 、
、 和
和 通入装有新型催化剂的反应器。测得相同时间内
通入装有新型催化剂的反应器。测得相同时间内 去除率随温度变化如图所示:
去除率随温度变化如图所示:
在
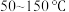 范围内,
范围内, 的去除率快速上升的原因为
的去除率快速上升的原因为 后,
后, 的去除率下降的原因,一可能为催化剂活性降低,二可能为
的去除率下降的原因,一可能为催化剂活性降低,二可能为(3)工业上可用“氨催化氧化法”生产
 ,以氨气、氧气为原料,在催化剂存在下生成
,以氨气、氧气为原料,在催化剂存在下生成 和副产物
和副产物 的化学方程式如下:
的化学方程式如下:I.

Ⅱ.
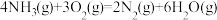
已知:
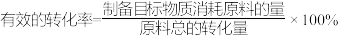
1L恒容密闭容器中充入
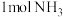 、
、 ,在催化剂作用下发生两个竞争反应I、Ⅱ,测得不同温度下反应相同时间有关物质的量关系如图所示:
,在催化剂作用下发生两个竞争反应I、Ⅱ,测得不同温度下反应相同时间有关物质的量关系如图所示:
①
 时,
时, 的有效转化率为
的有效转化率为②工业用氨催化氧化制备
 ,选择的最佳温度是
,选择的最佳温度是③
 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
您最近一年使用:0次



