氮氧化物( )和硫氧化物(主要是
)和硫氧化物(主要是 )是重要的大气污染物,怎样处理?一能解决环境污染问题,二能变废为宝,提高资源利率用,正是化学学科的研究领域与研究意义所在。请思考并回答下列问题:
)是重要的大气污染物,怎样处理?一能解决环境污染问题,二能变废为宝,提高资源利率用,正是化学学科的研究领域与研究意义所在。请思考并回答下列问题:
(1) 的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的
的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的 。用氨水吸收
。用氨水吸收 ,然后经氧化最终生成硫酸铵,共总反应可表示为:
,然后经氧化最终生成硫酸铵,共总反应可表示为: ,上述反应又经历了下面几个过程,请回答问题:
,上述反应又经历了下面几个过程,请回答问题:
①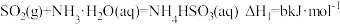 ;
;
②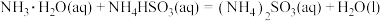

________ ;
③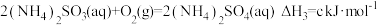 。
。
(2) 的排放主要来自于汽车尾气,有人利用反应
的排放主要来自于汽车尾气,有人利用反应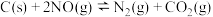 ;
;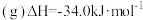 ,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率
,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率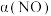 随温度的变化如图所示:
随温度的变化如图所示:
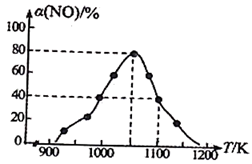
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是___________ 。
②已知:气体分压=气体总压×体积分数。用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 )。在1100K,
)。在1100K, 时,该反应的化学平衡常数
时,该反应的化学平衡常数
___________ 。
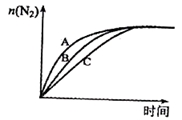
(3)在高效催化剂的作用下用 还原
还原 ,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成
,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 的物质的量与时间变化关系如图所示,其中活化能最小的是
的物质的量与时间变化关系如图所示,其中活化能最小的是_______ (填字母标号)。
(4)在汽车尾气的净化装置中CO和NO发生反应: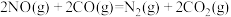
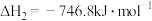 。实验测得,v正=k正
。实验测得,v正=k正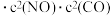 ,v逆=k逆
,v逆=k逆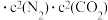 (k正、k逆为速率常数,只与温度有关)。
(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________ (填“>”、“<”或“=”) k逆增大的倍数。
②若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
_________ (保留2位有效数字)。
 )和硫氧化物(主要是
)和硫氧化物(主要是 )是重要的大气污染物,怎样处理?一能解决环境污染问题,二能变废为宝,提高资源利率用,正是化学学科的研究领域与研究意义所在。请思考并回答下列问题:
)是重要的大气污染物,怎样处理?一能解决环境污染问题,二能变废为宝,提高资源利率用,正是化学学科的研究领域与研究意义所在。请思考并回答下列问题:(1)
 的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的
的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的 。用氨水吸收
。用氨水吸收 ,然后经氧化最终生成硫酸铵,共总反应可表示为:
,然后经氧化最终生成硫酸铵,共总反应可表示为: ,上述反应又经历了下面几个过程,请回答问题:
,上述反应又经历了下面几个过程,请回答问题:①
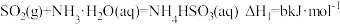 ;
;②
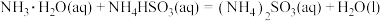

③
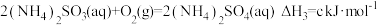 。
。(2)
 的排放主要来自于汽车尾气,有人利用反应
的排放主要来自于汽车尾气,有人利用反应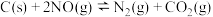 ;
;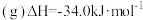 ,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率
,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率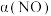 随温度的变化如图所示:
随温度的变化如图所示:
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是
②已知:气体分压=气体总压×体积分数。用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作
 )。在1100K,
)。在1100K, 时,该反应的化学平衡常数
时,该反应的化学平衡常数
(3)在高效催化剂的作用下用
 还原
还原 ,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成
,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 的物质的量与时间变化关系如图所示,其中活化能最小的是
的物质的量与时间变化关系如图所示,其中活化能最小的是
(4)在汽车尾气的净化装置中CO和NO发生反应:
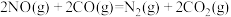
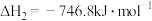 。实验测得,v正=k正
。实验测得,v正=k正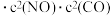 ,v逆=k逆
,v逆=k逆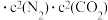 (k正、k逆为速率常数,只与温度有关)。
(k正、k逆为速率常数,只与温度有关)。①达到平衡后,仅升高温度,k正增大的倍数
②若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则

19-20高二·浙江·期末 查看更多[2]
更新时间:2020-02-28 10:27:15
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】分甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16 g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8 kJ热量。
①该混合气体中NO和NO2的物质的量之比为____________ 。
②已知上述热化学方程式中ΔH1=-1160 kJ/mol,则ΔH2=____________ 。
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:______________ 。
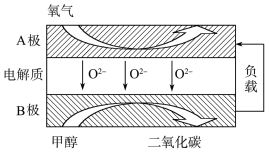
(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛地研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
④B极为电池____________ 极,电极反应式为________________ 。
⑤若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为______________ (标准状况下),实际上消耗的甲烷体积(折算到标准状况)比理论上大,可能原因为________________ 。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16 g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8 kJ热量。
①该混合气体中NO和NO2的物质的量之比为
②已知上述热化学方程式中ΔH1=-1160 kJ/mol,则ΔH2=
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:

(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛地研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
④B极为电池
⑤若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】已知NO2(g)+CO(g) NO(g)+CO2(g) ΔH=-230kJ/mol,下图是恒容密闭容器中,该反应CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
NO(g)+CO2(g) ΔH=-230kJ/mol,下图是恒容密闭容器中,该反应CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
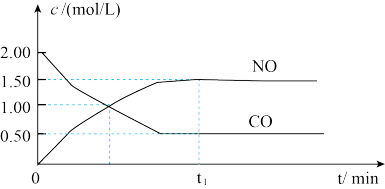
(1)该反应是___________ 反应(填“放热”或“吸热”)。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=___________ 。
(3)此温度下,该反应的平衡常数表达式K=___________ ;温度降低,K___________ (填“变大”、“变小”或“不变”)。
(4)下列条件或者现象能判断该反应一定达到平衡状态的是___________(填下列字母)。
(5)已知:
①CO(g)+ O2(g)=CO2(g) ΔH=−283.0kJ·mol−1
O2(g)=CO2(g) ΔH=−283.0kJ·mol−1
②S(s)+O2(g)=SO2(g) ΔH=−296.0kJ·mol−1
处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质S。此反应的热化学方程式是___________ 。
 NO(g)+CO2(g) ΔH=-230kJ/mol,下图是恒容密闭容器中,该反应CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
NO(g)+CO2(g) ΔH=-230kJ/mol,下图是恒容密闭容器中,该反应CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
(1)该反应是
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=
(3)此温度下,该反应的平衡常数表达式K=
(4)下列条件或者现象能判断该反应一定达到平衡状态的是___________(填下列字母)。
| A.容器内颜色不再改变 | B.当c(NO)=c(CO2)时 |
| C.混合气体平均摩尔质量不再改变 | D.容器内压强不再改变 |
(5)已知:
①CO(g)+
 O2(g)=CO2(g) ΔH=−283.0kJ·mol−1
O2(g)=CO2(g) ΔH=−283.0kJ·mol−1②S(s)+O2(g)=SO2(g) ΔH=−296.0kJ·mol−1
处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质S。此反应的热化学方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①
 kJ·mol
kJ·mol

②
 kJ⋅mol
kJ⋅mol

③
 kJ⋅mo
kJ⋅mo

回答下列问题:
(1)反应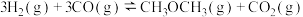 的
的
______ kJ⋅mol ;该反应的平衡常数
;该反应的平衡常数
______ (用 、
、 、
、 表示)。
表示)。
(2)下列措施中,能提高(1)中 产率的有______(填字母)。
产率的有______(填字母)。
(3)一定温度下,将0.2 mol CO和0.1 mol 通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得
通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5 min内
的体积分数为0.1。则0~5 min内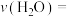
______ ,,CO的转化率为______ 。
(4)将合成气以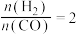 通入1 L的反应器中,一定条件下发生反应:
通入1 L的反应器中,一定条件下发生反应: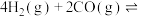

 ,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是______ (填字母)。
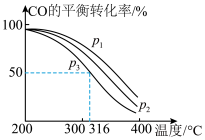
A.
B.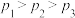
C.若在 和316℃时,起始时
和316℃时,起始时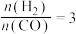 ,则平衡时,
,则平衡时,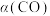 小于50%
小于50%
①

 kJ·mol
kJ·mol

②

 kJ⋅mol
kJ⋅mol

③

 kJ⋅mo
kJ⋅mo

回答下列问题:
(1)反应
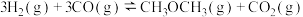 的
的
 ;该反应的平衡常数
;该反应的平衡常数
 、
、 、
、 表示)。
表示)。(2)下列措施中,能提高(1)中
 产率的有______(填字母)。
产率的有______(填字母)。| A.使用过量的CO | B.升高温度 | C.增大压强 | D.加入合适的催化剂 |
(3)一定温度下,将0.2 mol CO和0.1 mol
 通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得
通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5 min内
的体积分数为0.1。则0~5 min内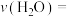
(4)将合成气以
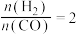 通入1 L的反应器中,一定条件下发生反应:
通入1 L的反应器中,一定条件下发生反应: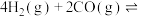

 ,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
A.

B.
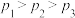
C.若在
 和316℃时,起始时
和316℃时,起始时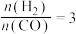 ,则平衡时,
,则平衡时,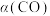 小于50%
小于50%
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为: 。
。
回答下列问题:
(1)合成氨反应在常温下___________ (填“能”或“不能”)自发。
(2)___________ 温(填“高”或“低”,下同)有利于提高反应速率,___________ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用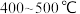 。
。
(3)传统催化剂用的是铁触媒,合成氨反应在 催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,
催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,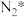 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 )判断上述反应机理中,速率控制步骤(即速率最慢步骤)为
)判断上述反应机理中,速率控制步骤(即速率最慢步骤)为___________ (填步骤前的标号),理由是___________ 。
(i)
(ii)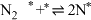
(iii)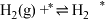
(iv)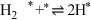
(v)
……
(…)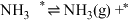
(4)针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用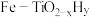 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为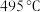 时,
时, 的温度为
的温度为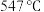 ,而
,而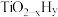 的温度为
的温度为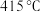 )。
)。

下列说法正确的是___________ 。
a.氨气在“冷 ”表面生成,有利于提高氨的平衡产率
”表面生成,有利于提高氨的平衡产率
b. 在“热
在“热 ”表面断裂,有利于提高合成氨反应速率
”表面断裂,有利于提高合成氨反应速率
c.“热 ”高于体系温度,有利于提高氨的平衡产率
”高于体系温度,有利于提高氨的平衡产率
d.“冷 ”低于体系温度,有利于提高合成氨反应速率
”低于体系温度,有利于提高合成氨反应速率
(5)方案二: 复合催化剂。
复合催化剂。
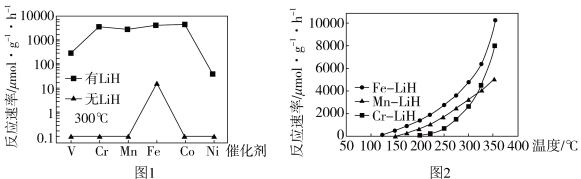
下列说法正确的是___________ 。
a. 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(6)某合成氨速率方程为: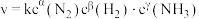 ,根据表中数据,
,根据表中数据,
___________ ;
在合成氨过程中,需要不断分离出氨的原因为___________ 。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
 。
。回答下列问题:
(1)合成氨反应在常温下
(2)
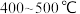 。
。(3)传统催化剂用的是铁触媒,合成氨反应在
 催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,
催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,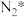 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 )判断上述反应机理中,速率控制步骤(即速率最慢步骤)为
)判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(i)

(ii)
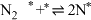
(iii)
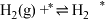
(iv)
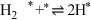
(v)

……
(…)
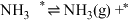
(4)针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用
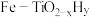 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为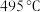 时,
时, 的温度为
的温度为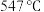 ,而
,而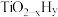 的温度为
的温度为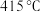 )。
)。
下列说法正确的是
a.氨气在“冷
 ”表面生成,有利于提高氨的平衡产率
”表面生成,有利于提高氨的平衡产率b.
 在“热
在“热 ”表面断裂,有利于提高合成氨反应速率
”表面断裂,有利于提高合成氨反应速率c.“热
 ”高于体系温度,有利于提高氨的平衡产率
”高于体系温度,有利于提高氨的平衡产率d.“冷
 ”低于体系温度,有利于提高合成氨反应速率
”低于体系温度,有利于提高合成氨反应速率(5)方案二:
 复合催化剂。
复合催化剂。
下列说法正确的是
a.
 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(6)某合成氨速率方程为:
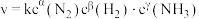 ,根据表中数据,
,根据表中数据,
| 实验 | 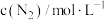 | 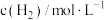 | 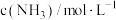 |  |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 2.828q |
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下操作与装置(部分固定装置略)制备过氯化钙。
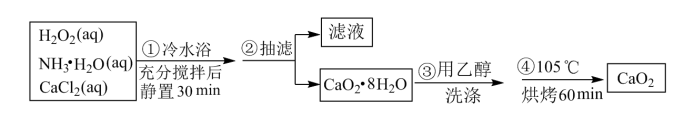

(1)三颈烧瓶中发生的主要反应的化学方程式为_______ 。
(2)用恒压分液漏斗盛装H2O2和浓氨水相比用普通分液漏斗盛装的好处是_______ 。
(3)该反应常用冰水浴控制温度在0°C左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高CaO2·8H2O的产率;其二,_______ ;
(4)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验CaO2·8H2O是否洗涤干净的试剂为_______ 。
(5)过氧化钙产品纯度测定实验步骤如下:
第一步:准确称取ag产品于烧杯中,加入适量的盐酸使其完全溶解;
第二步:向上述溶液中加入稍过量的(NH4)2C2O4,沉淀完全,过滤并洗涤沉淀;
第三步:将洗涤好的沉淀用稍过量的稀硫酸溶解,溶解液和洗涤液全部转移至锥形瓶中;
第四步:向锥形瓶中滴入几滴MnSO4溶液,然后逐滴滴入浓度为cmol·L-1的KMnO4溶液至终点,消耗KMnO4溶液VmL。
①滴定前,滴入MnSO4溶液的目的是_______ 。
②滴定终点的现象为_______ 。
③产品的纯度为_______ (用字母表示)。
④若第三步用稀盐酸溶解,所测纯度_______ (填“偏低”“不变”或“偏高”)


(1)三颈烧瓶中发生的主要反应的化学方程式为
(2)用恒压分液漏斗盛装H2O2和浓氨水相比用普通分液漏斗盛装的好处是
(3)该反应常用冰水浴控制温度在0°C左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高CaO2·8H2O的产率;其二,
(4)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验CaO2·8H2O是否洗涤干净的试剂为
(5)过氧化钙产品纯度测定实验步骤如下:
第一步:准确称取ag产品于烧杯中,加入适量的盐酸使其完全溶解;
第二步:向上述溶液中加入稍过量的(NH4)2C2O4,沉淀完全,过滤并洗涤沉淀;
第三步:将洗涤好的沉淀用稍过量的稀硫酸溶解,溶解液和洗涤液全部转移至锥形瓶中;
第四步:向锥形瓶中滴入几滴MnSO4溶液,然后逐滴滴入浓度为cmol·L-1的KMnO4溶液至终点,消耗KMnO4溶液VmL。
①滴定前,滴入MnSO4溶液的目的是
②滴定终点的现象为
③产品的纯度为
④若第三步用稀盐酸溶解,所测纯度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】苯乙烯是一种重要的有机化工原料,可利用乙苯催化脱氢法制备。实际生产中常在体系中充入一定量的CO2,主要反应如下:
I.C8H10(g) C8H8(g)+H2(g) ΔH1=+117.6kJ·mol-1;
C8H8(g)+H2(g) ΔH1=+117.6kJ·mol-1;
II.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1。
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1。
回答下列问题:
(1)一定温度下,向盛放催化剂的10L恒容密闭容器中充入2molC8H10(g)和1molCO2(g)发生反应I和反应II。20min末达到平衡,C8H8(g)、H2O(g)的体积分数分别为25%和5%。
①0~20min内,用C8H10的物质的量浓度变化表示的平均反应速率 (C8H10)=
(C8H10)=_______ 。
②起始投料量不变,在不同温度、压强下重复实验,测得H2的平衡体积分数与温度和压强的关系如图所示。

由图可知,温度低于T0°C时,以反应_______ (填“I”或“II”)为主,理由为_______ ;T1°C时,三条曲线几乎相交的原因为_______ 。
(2)催化脱氢过程中发生积碳反应: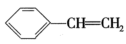 (g)→8C(s)+4H2(g) ΔH3=-126kJ·mol-1。积碳反应可能导致的后果为
(g)→8C(s)+4H2(g) ΔH3=-126kJ·mol-1。积碳反应可能导致的后果为_______ (写一条即可)。
I.C8H10(g)
 C8H8(g)+H2(g) ΔH1=+117.6kJ·mol-1;
C8H8(g)+H2(g) ΔH1=+117.6kJ·mol-1;II.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1。
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1。回答下列问题:
(1)一定温度下,向盛放催化剂的10L恒容密闭容器中充入2molC8H10(g)和1molCO2(g)发生反应I和反应II。20min末达到平衡,C8H8(g)、H2O(g)的体积分数分别为25%和5%。
①0~20min内,用C8H10的物质的量浓度变化表示的平均反应速率
 (C8H10)=
(C8H10)=②起始投料量不变,在不同温度、压强下重复实验,测得H2的平衡体积分数与温度和压强的关系如图所示。

由图可知,温度低于T0°C时,以反应
(2)催化脱氢过程中发生积碳反应:
 (g)→8C(s)+4H2(g) ΔH3=-126kJ·mol-1。积碳反应可能导致的后果为
(g)→8C(s)+4H2(g) ΔH3=-126kJ·mol-1。积碳反应可能导致的后果为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】(1)Ba(OH)2·8H2O固体与NH4Cl固体反应的化学方程式为_____________ 。
(2)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。理论上,每生成1 mol NH3___________ 热量(填“吸收”或“放出”)__________ kJ;事实上,反应的热量总小于理论值,为什么?________________ 。
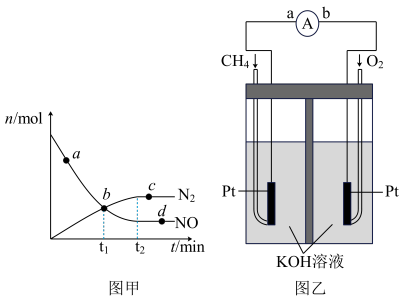
(3)一定条件下发生反应:6NO(g) + 4NH3(g) 5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正)
5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)
(4)已知N2(g)+ 3H2(g) 2NH3(g),若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为
2NH3(g),若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______ ;若平衡时N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______ 。
(5)已知一定条件下发生:2SO2(g) + O2(g) 2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)
2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)

t1________________________ ;t2________________________ ;
t3________________________ ;t4________________________ 。
(6)①某电池采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液,电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中_______ 作正极,负极的电极反应为_________________ 。
②甲烷燃料电池示意图如上图乙,其负极反应方程式为_____________ 。
(2)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。理论上,每生成1 mol NH3
(3)一定条件下发生反应:6NO(g) + 4NH3(g)
 5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正)
5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) 
(4)已知N2(g)+ 3H2(g)
 2NH3(g),若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为
2NH3(g),若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为(5)已知一定条件下发生:2SO2(g) + O2(g)
 2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)
2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)
t1
t3
(6)①某电池采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液,电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中
②甲烷燃料电池示意图如上图乙,其负极反应方程式为
您最近一年使用:0次
【推荐2】(1)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,则该燃料电池的负极的电极反应为___________ 。
(2)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。
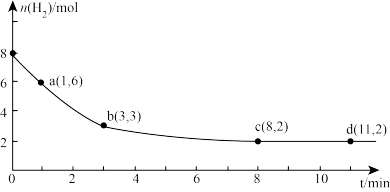
①a点正反应速率______ (填“大于等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是________ mol/L。
③能够说明该反应达到化学平衡状态的标志是__________ (双选)。
A.单位时间内消耗1molCO2,同时生成3molH2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
(2)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。

①a点正反应速率
②平衡时CO2的物质的量浓度是
③能够说明该反应达到化学平衡状态的标志是
A.单位时间内消耗1molCO2,同时生成3molH2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】下图是可逆反应X2(g)+3Y2(g) 2Z(g)在反应过程中的反应速率(v)与时间(t)的关系曲线:
2Z(g)在反应过程中的反应速率(v)与时间(t)的关系曲线:

(1)下列叙述正确的是________
A.t1时,只有正方向反应
B.t2时,反应达到限度
C.t2~t3,反应不再发生
D.t2~t3,各物质的浓度不再发生变化
(2)能说明该反应已达到平衡状态的是__________________
A 恒温恒容时,压强不变 B 单位时间内,消耗a mol X2同时生成2a mol Z
C v正(X2)=3v逆(Y2) D X2、Y2、Z的分子数之比为1∶3∶2
E 恒温恒容时,密度不变 F 恒温恒压时,平均相对分子质量不变
(3)在2 L的密闭容器中发生上述反应,n(Z)随时间的变化如下表:
计算0~2s内,用Y2表示的化学反应速率为_________________________ 。
 2Z(g)在反应过程中的反应速率(v)与时间(t)的关系曲线:
2Z(g)在反应过程中的反应速率(v)与时间(t)的关系曲线:
(1)下列叙述正确的是
A.t1时,只有正方向反应
B.t2时,反应达到限度
C.t2~t3,反应不再发生
D.t2~t3,各物质的浓度不再发生变化
(2)能说明该反应已达到平衡状态的是
A 恒温恒容时,压强不变 B 单位时间内,消耗a mol X2同时生成2a mol Z
C v正(X2)=3v逆(Y2) D X2、Y2、Z的分子数之比为1∶3∶2
E 恒温恒容时,密度不变 F 恒温恒压时,平均相对分子质量不变
(3)在2 L的密闭容器中发生上述反应,n(Z)随时间的变化如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| n(Z)/mol | 0 | 0.50 | 0.80 | 0.90 | 0.90 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氢气具有热值高、无污染等优点,是理想的能源。工业制取氢气的主要方法有煤转化、天然气转化等。煤转化制取氢气的主要原理可简化为如下反应。
反应① ,
, 、
、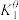
反应② ,
,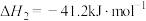 、
、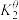
反应③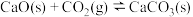 ,
, 、
、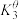
已知:对于反应 ,其标准平衡常数
,其标准平衡常数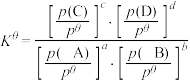 。
。
在温度恒定为 ,压强恒定为
,压强恒定为 的反应炉内加入
的反应炉内加入 、
、 、
、 ,发生上述3个反应,平衡时
,发生上述3个反应,平衡时 的分压
的分压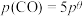 。已知:
。已知: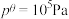 。该温度下
。该温度下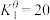 ,
, 。
。
(1)写出反应③的标准平衡常数表达式: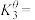
___________ 。
(2)反应④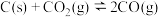 ,
,
___________ 。
(3)该温度下反应(2)的标准平衡常数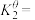
___________ 。
(4)平衡时 的分压
的分压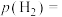
___________  。
。
(5)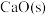 的作用为
的作用为___________ 。平衡后再加入 ,则最终氢气的产率
,则最终氢气的产率___________ (填标号)。
A增大 B.减小 C.不变 D.无法判断
反应①
 ,
,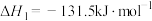 、
、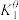
反应②
 ,
,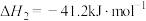 、
、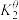
反应③
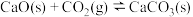 ,
, 、
、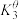
已知:对于反应
 ,其标准平衡常数
,其标准平衡常数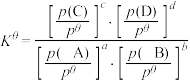 。
。在温度恒定为
 ,压强恒定为
,压强恒定为 的反应炉内加入
的反应炉内加入 、
、 、
、 ,发生上述3个反应,平衡时
,发生上述3个反应,平衡时 的分压
的分压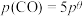 。已知:
。已知: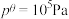 。该温度下
。该温度下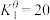 ,
, 。
。(1)写出反应③的标准平衡常数表达式:
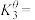
(2)反应④
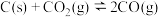 ,
,
(3)该温度下反应(2)的标准平衡常数
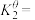
(4)平衡时
 的分压
的分压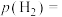
 。
。(5)
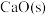 的作用为
的作用为 ,则最终氢气的产率
,则最终氢气的产率A增大 B.减小 C.不变 D.无法判断
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】硫化氢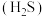 既是一种剧毒且高腐蚀性气体,又是蕴含丰富氢能和硫元素的宝贵资源。
既是一种剧毒且高腐蚀性气体,又是蕴含丰富氢能和硫元素的宝贵资源。
I. 的处理
的处理
(1)处理某种废气中含有的 ,是将废气与空气混合通入
,是将废气与空气混合通入 、
、 、
、 的混合液中,其部分转化过程如图所示。
的混合液中,其部分转化过程如图所示。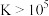 时反应进行的较完全。已知:
时反应进行的较完全。已知: 时
时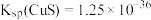 ,
, 的
的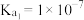 ,
,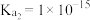 ,则
,则 时过程ii中的反应
时过程ii中的反应____________ (填“能”或“不能”)进行完全。
②过程iii中发生反应的离子方程式为________________________________________
Ⅱ. 的综合利用
的综合利用
(2)根据文献,将 和
和 的混合气体导入石英管反应器热解(一边进料,另一边出料),得到
的混合气体导入石英管反应器热解(一边进料,另一边出料),得到 和
和 ,反应为
,反应为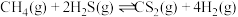 。在
。在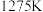 、
、 反应条件下,将物质的量分数之比为
反应条件下,将物质的量分数之比为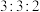 的
的 、
、 、
、 混合气体进行甲烷处理硫化氢反应,平衡时混合气体中
混合气体进行甲烷处理硫化氢反应,平衡时混合气体中 的分压与
的分压与 的分压相同,
的分压相同, 的平衡转化率为
的平衡转化率为_____________ (保留小数点后一位),平衡常数
________  (以分压表示,分压
(以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
(3)通过电化学循环法可将 转化为
转化为 和
和 ,如图所示,其中氧化过程发生两步反应:
,如图所示,其中氧化过程发生两步反应: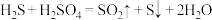 、
、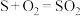 。
。____________________________________ ;
②理论上,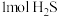 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为_____________ 。
(4)工业上可以通过硫化氢分解制得 和硫蒸气。在某密闭容器中充入
和硫蒸气。在某密闭容器中充入 气体,发生反应:
气体,发生反应: ,
, 气体的平衡转化率与温度、压强的关系如图所示。
气体的平衡转化率与温度、压强的关系如图所示。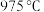 和压强为
和压强为 的条件下,其他条件不变,n点的
的条件下,其他条件不变,n点的 与
与 中较大的是
中较大的是_____________ ,图中m、n点对应温度下的平衡常数:
___________ (填“>”、“=”或“<”)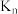 。
。
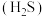 既是一种剧毒且高腐蚀性气体,又是蕴含丰富氢能和硫元素的宝贵资源。
既是一种剧毒且高腐蚀性气体,又是蕴含丰富氢能和硫元素的宝贵资源。I.
 的处理
的处理(1)处理某种废气中含有的
 ,是将废气与空气混合通入
,是将废气与空气混合通入 、
、 、
、 的混合液中,其部分转化过程如图所示。
的混合液中,其部分转化过程如图所示。
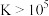 时反应进行的较完全。已知:
时反应进行的较完全。已知: 时
时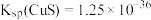 ,
, 的
的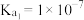 ,
,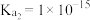 ,则
,则 时过程ii中的反应
时过程ii中的反应②过程iii中发生反应的离子方程式为
Ⅱ.
 的综合利用
的综合利用(2)根据文献,将
 和
和 的混合气体导入石英管反应器热解(一边进料,另一边出料),得到
的混合气体导入石英管反应器热解(一边进料,另一边出料),得到 和
和 ,反应为
,反应为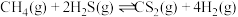 。在
。在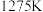 、
、 反应条件下,将物质的量分数之比为
反应条件下,将物质的量分数之比为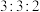 的
的 、
、 、
、 混合气体进行甲烷处理硫化氢反应,平衡时混合气体中
混合气体进行甲烷处理硫化氢反应,平衡时混合气体中 的分压与
的分压与 的分压相同,
的分压相同, 的平衡转化率为
的平衡转化率为
 (以分压表示,分压
(以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。(3)通过电化学循环法可将
 转化为
转化为 和
和 ,如图所示,其中氧化过程发生两步反应:
,如图所示,其中氧化过程发生两步反应: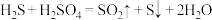 、
、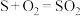 。
。
②理论上,
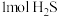 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为(4)工业上可以通过硫化氢分解制得
 和硫蒸气。在某密闭容器中充入
和硫蒸气。在某密闭容器中充入 气体,发生反应:
气体,发生反应: ,
, 气体的平衡转化率与温度、压强的关系如图所示。
气体的平衡转化率与温度、压强的关系如图所示。
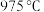 和压强为
和压强为 的条件下,其他条件不变,n点的
的条件下,其他条件不变,n点的 与
与 中较大的是
中较大的是
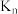 。
。
您最近一年使用:0次
【推荐3】硫化氢(H2S)危害人体健康,造成环境污染。工业上可采用如下反应处理含H2S的尾气。请回答下列问题:
(1)已知:
I.S(g)+O2(g)=SO2(g) △H1=-314.27 kJ·mol-1;
II.2H2S(g)+O2(g)=2S(g)+2H2O(g) △H2=-407.07 kJ·mol-1
则2H2S(g)+SO2(g)=3S(g)+2H2O(g) △H=_____ ,1 mol S(s)完全燃烧放出的热量______ (填“>”“<”或“=”)314.27 kJ。
(2)H2S直接分解可制取H2:2H2S(g)⇌2H2(g)+S2(g) △H>0.一定温度下,起始压强为100 MPa,在体积为5 L的恒容密闭容器中充入1 mol H2S气体,发生该反应。
①下列说法可以判定该反应达到平衡状态的是___________ (填字母)。
A.H2S与H2的物质的量之比不再改变 B.气体的密度不再改变
C.断裂2 mol H-S键的同时断裂1 mol H-H键 D.气体的平均摩尔质量不再改变
②若10 min时反应达到平衡,压强变为原来的1.25倍,则从开始到平衡,v(H2)=___________ mol·L-1·min-1,H2S的转化率为___________ %,化学平衡常数Kp=___________ MPa(用平衡分压代替平衡浓度表示,平衡分压=总压×物质的量分数)。
③若保持其他条件不变,将反应容器改为绝热恒容的密闭容器,则重新达到平衡时,S2(g)的体积分数与原平衡相比将___________ (填“增大”“减小”或“不变”)。
(3)H2S燃料电池的开发成功,使得H2S可以作为一种新型能源被资源化利用,基本工作原理如图所示。

①该电池工作时,负极的电极反应式为___________ 。
②已知1个电子的电量是1.602×10-19 C.则1 kg H2S输出的电量为____ (列出计算式即可)。
(1)已知:
I.S(g)+O2(g)=SO2(g) △H1=-314.27 kJ·mol-1;
II.2H2S(g)+O2(g)=2S(g)+2H2O(g) △H2=-407.07 kJ·mol-1
则2H2S(g)+SO2(g)=3S(g)+2H2O(g) △H=
(2)H2S直接分解可制取H2:2H2S(g)⇌2H2(g)+S2(g) △H>0.一定温度下,起始压强为100 MPa,在体积为5 L的恒容密闭容器中充入1 mol H2S气体,发生该反应。
①下列说法可以判定该反应达到平衡状态的是
A.H2S与H2的物质的量之比不再改变 B.气体的密度不再改变
C.断裂2 mol H-S键的同时断裂1 mol H-H键 D.气体的平均摩尔质量不再改变
②若10 min时反应达到平衡,压强变为原来的1.25倍,则从开始到平衡,v(H2)=
③若保持其他条件不变,将反应容器改为绝热恒容的密闭容器,则重新达到平衡时,S2(g)的体积分数与原平衡相比将
(3)H2S燃料电池的开发成功,使得H2S可以作为一种新型能源被资源化利用,基本工作原理如图所示。

①该电池工作时,负极的电极反应式为
②已知1个电子的电量是1.602×10-19 C.则1 kg H2S输出的电量为
您最近一年使用:0次



