正丁醛可由丙烯通过下列反应制取:
CH3CH=CH2 + CO + H2 CH3CH2CH2CHO(正丁醛)反应①
CH3CH2CH2CHO(正丁醛)反应①
同时发生副反应:CH3CH=CH2 +CO + H2 (CH3)2CHCHO(异丁醛)反应②
(CH3)2CHCHO(异丁醛)反应②
CH3CH=CH2 + H2 CH3CH2CH3反应③
CH3CH2CH3反应③
三个反应在不同温度时的平衡常数见下表。回答问题:
(1)423K时,如果反应在恒容密闭容器中发生,当反应达到平衡时,下列说法错误的是_____ (填序号)。
a.c(CO):c( H2)一定等于1:1
b.反应混合物的密度保持不变
c.丙烯转化率达到最大值
d.单位时间内,n(CO)消耗= n(正丁醛)生成
(2)当反应达到平衡后,若将反应体系的温度从298 K提高到423 K,再次达到平衡后,在生成物中,__________ (填物质名称)的摩尔百分含量降低。
(3)若反应在298K进行,根据平衡常数作出的推测正确的是______ 。
a.反应③的反应速率最大 b.达到平衡后生成物中丙烷的体积百分含量最高
c.反应②达到平衡所需时间最长 d.298K时只有反应③向正反应方向进行
(4)使用催化剂后,单位时间里正丁醛的产量大大提高,反应体系产物中正/异醛比增大。导致这种情况出现的原因是____________________________ 。
CH3CH=CH2 + CO + H2
 CH3CH2CH2CHO(正丁醛)反应①
CH3CH2CH2CHO(正丁醛)反应①同时发生副反应:CH3CH=CH2 +CO + H2
 (CH3)2CHCHO(异丁醛)反应②
(CH3)2CHCHO(异丁醛)反应②CH3CH=CH2 + H2
 CH3CH2CH3反应③
CH3CH2CH3反应③三个反应在不同温度时的平衡常数见下表。回答问题:
| 温度/K | 反应① | 反应② | 反应③ |
| 298 | 2.96×109 | 2.53×109 | 1.32×1015 |
| 423 | 1.05×102 | 5.40×102 | 2.52×102 |
(1)423K时,如果反应在恒容密闭容器中发生,当反应达到平衡时,下列说法错误的是
a.c(CO):c( H2)一定等于1:1
b.反应混合物的密度保持不变
c.丙烯转化率达到最大值
d.单位时间内,n(CO)消耗= n(正丁醛)生成
(2)当反应达到平衡后,若将反应体系的温度从298 K提高到423 K,再次达到平衡后,在生成物中,
(3)若反应在298K进行,根据平衡常数作出的推测正确的是
a.反应③的反应速率最大 b.达到平衡后生成物中丙烷的体积百分含量最高
c.反应②达到平衡所需时间最长 d.298K时只有反应③向正反应方向进行
(4)使用催化剂后,单位时间里正丁醛的产量大大提高,反应体系产物中正/异醛比增大。导致这种情况出现的原因是
2012·上海徐汇·二模 查看更多[1]
(已下线)上海市徐汇区2012届高三4月学习能力诊断化学试题
更新时间:2020-03-30 19:51:19
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】探究化学反应快慢的影响因素在生产生活中具有重要的意义.
Ⅰ.探究温度对速率的影响(可选用试剂: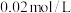 酸性
酸性 溶液、
溶液、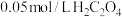 弱酸溶液).
弱酸溶液).
Ⅱ.为了验证“反应生成的 对反应具有催化的作用”,某研究小组用井穴板设计了以下实验:
对反应具有催化的作用”,某研究小组用井穴板设计了以下实验:
①向一个井穴中滴入10滴 溶液,逐滴加入酸性
溶液,逐滴加入酸性 溶液并记录各滴加入后褪色时间.
溶液并记录各滴加入后褪色时间.
②向三个井穴中分别滴加10滴 溶液再分别滴加1、2、3滴
溶液再分别滴加1、2、3滴 溶液,最后,各滴入1滴酸性
溶液,最后,各滴入1滴酸性 溶液,记录褪色时间.
溶液,记录褪色时间.
已知: 为难溶于水的褐色固体,
为难溶于水的褐色固体,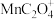 溶液为红色,不稳定,会缓慢分解为
溶液为红色,不稳定,会缓慢分解为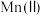 和
和 ;
;
(1)实验①中第6滴出现褐色沉淀的原因是________________ (用离子反应方程式表示).
(2)实验①②的现象说明上述推测正确,催化过程如下:

实验②中催化剂用量增加,褪色时间却略有延长,说明催化剂过量易催化到“催化过程”的第_____ 步,反应过程出现红色的原因是_______________ .
(3)简述微型实验中滴管均套上相同的塑料针头的优点:____________ .
Ⅰ.探究温度对速率的影响(可选用试剂:
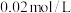 酸性
酸性 溶液、
溶液、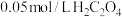 弱酸溶液).
弱酸溶液).| 实验原理: | ||
| 操作 | 现象 | 结论 |
取两支试管,分别加入 酸性 酸性 溶液与 溶液与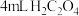 溶液,置于冷水浴中;另取两支试管, 溶液,置于冷水浴中;另取两支试管, | ||
 对反应具有催化的作用”,某研究小组用井穴板设计了以下实验:
对反应具有催化的作用”,某研究小组用井穴板设计了以下实验:①向一个井穴中滴入10滴
 溶液,逐滴加入酸性
溶液,逐滴加入酸性 溶液并记录各滴加入后褪色时间.
溶液并记录各滴加入后褪色时间.②向三个井穴中分别滴加10滴
 溶液再分别滴加1、2、3滴
溶液再分别滴加1、2、3滴 溶液,最后,各滴入1滴酸性
溶液,最后,各滴入1滴酸性 溶液,记录褪色时间.
溶液,记录褪色时间.
| 实验① (  溶液滴数) 溶液滴数) | 褪色用时 | 实验② (  溶液滴数) 溶液滴数) | 褪色用时 |
| 第1滴 | 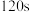 | 1滴 | 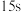 |
| 第2滴 |  | 2滴 |  |
| 第3滴 |  | 3滴 |  |
| 第4滴 |  | 实验②体系颜色变化:红色-浅红色-浅褐色-无色 | |
| 第5滴 |  | ||
| 第6滴 | 褐色沉淀 | ||
 为难溶于水的褐色固体,
为难溶于水的褐色固体,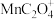 溶液为红色,不稳定,会缓慢分解为
溶液为红色,不稳定,会缓慢分解为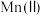 和
和 ;
;(1)实验①中第6滴出现褐色沉淀的原因是
(2)实验①②的现象说明上述推测正确,催化过程如下:

实验②中催化剂用量增加,褪色时间却略有延长,说明催化剂过量易催化到“催化过程”的第
(3)简述微型实验中滴管均套上相同的塑料针头的优点:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】二氧化碳的综合利用是实现碳达峰、碳中和的关键。
I.利用 和
和 合成甲醇,涉及的主要反应如下:
合成甲醇,涉及的主要反应如下:
已知:a.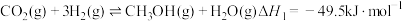
b.
c.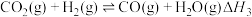
(1)计算
_______ 。
(2)一定条件下,向密闭容器中充入物质的量之比为1:3的 和
和 发生上述反应,使用不同催化剂经相同反应时间,
发生上述反应,使用不同催化剂经相同反应时间, 的转化率和甲醇的选择性随温度的变化如图所示:
的转化率和甲醇的选择性随温度的变化如图所示:

甲醇的选择性
①210-270℃间,在甲醇的选择性上,催化效果较好的是_______ 。
②210-270℃间,催化剂2条件下 的转化率随温度的升高而增大,可能原因为
的转化率随温度的升高而增大,可能原因为_______ 。
II.工业上用 和
和 通过如下反应合成尿素
通过如下反应合成尿素 :
: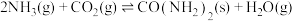 。t℃时,向容积恒定为
。t℃时,向容积恒定为 的密闭容器中充入
的密闭容器中充入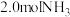 和
和 发生反应。
发生反应。
(3)下列能说明反应达到化学平衡状态的是_______ (填字母)。
a.相同时间内,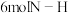 键断裂,同时有
键断裂,同时有 键形成
键形成
b.容器内气体总压强不再变化
c.
d.容器内气体的密度不再改变
(4) 的物质的量随时间的变化如下表所示:
的物质的量随时间的变化如下表所示:
 的平衡转化率为
的平衡转化率为_______ ;t°C时,该反应的平衡常数K=_______ 。
III.中科院研究所利用 和甲酸(HCOOH)的相互转化设计并实现了一种可逆的水系金属二氧化碳电池,结构如图所示:
和甲酸(HCOOH)的相互转化设计并实现了一种可逆的水系金属二氧化碳电池,结构如图所示:
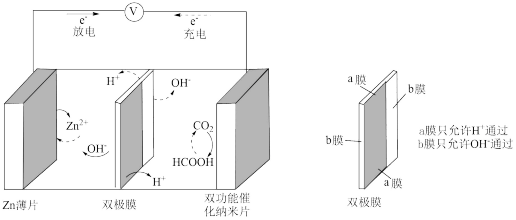
(5)放电时,正极上的电极反应为_______ ;若电池工作时产生a库仑的电量,则理论上消耗锌的质量为_______ g。(已知:转移1mol电子所产生的电量为96500库仑)
I.利用
 和
和 合成甲醇,涉及的主要反应如下:
合成甲醇,涉及的主要反应如下:已知:a.
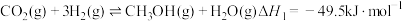
b.

c.
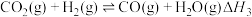
(1)计算

(2)一定条件下,向密闭容器中充入物质的量之比为1:3的
 和
和 发生上述反应,使用不同催化剂经相同反应时间,
发生上述反应,使用不同催化剂经相同反应时间, 的转化率和甲醇的选择性随温度的变化如图所示:
的转化率和甲醇的选择性随温度的变化如图所示:
甲醇的选择性

①210-270℃间,在甲醇的选择性上,催化效果较好的是
②210-270℃间,催化剂2条件下
 的转化率随温度的升高而增大,可能原因为
的转化率随温度的升高而增大,可能原因为II.工业上用
 和
和 通过如下反应合成尿素
通过如下反应合成尿素 :
: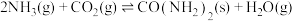 。t℃时,向容积恒定为
。t℃时,向容积恒定为 的密闭容器中充入
的密闭容器中充入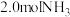 和
和 发生反应。
发生反应。(3)下列能说明反应达到化学平衡状态的是
a.相同时间内,
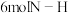 键断裂,同时有
键断裂,同时有 键形成
键形成b.容器内气体总压强不再变化
c.

d.容器内气体的密度不再改变
(4)
 的物质的量随时间的变化如下表所示:
的物质的量随时间的变化如下表所示:| 时间/min | 0 | 30 | 70 | 80 | 100 |
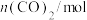 | 1.6 | l.0 | 0.8 | 0.8 | 0.8 |
 的平衡转化率为
的平衡转化率为III.中科院研究所利用
 和甲酸(HCOOH)的相互转化设计并实现了一种可逆的水系金属二氧化碳电池,结构如图所示:
和甲酸(HCOOH)的相互转化设计并实现了一种可逆的水系金属二氧化碳电池,结构如图所示:
(5)放电时,正极上的电极反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氨气广泛应用于化肥、制药、合成纤维等领域。
I.工业上可由氢气和氮气合成氨气。若用 、
、 、
、 、
、 分别表示
分别表示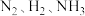 和固体催化剂,则在固体催化剂表面合成氨的过程如图所示:
和固体催化剂,则在固体催化剂表面合成氨的过程如图所示:

(1)吸附后,能量状态最高的是___________ (填序号)。
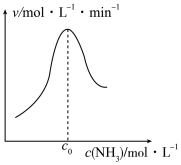
(2)结合上述过程,一定温度下在固体催化剂表面进行 的分解实验,发现
的分解实验,发现 的分解速率与其浓度的关系如图所示。从吸附和解吸过程分析,
的分解速率与其浓度的关系如图所示。从吸附和解吸过程分析,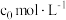 前反应速率增加的原因可能是
前反应速率增加的原因可能是___________ ;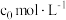 之后反应速率降低的原因可能是
之后反应速率降低的原因可能是___________ 。
II.利用 在催化剂(
在催化剂( )作用下将
)作用下将 还原为
还原为 是目前应用最为广泛的氮氧化物(
是目前应用最为广泛的氮氧化物( )净化方法,其原理是:
)净化方法,其原理是:
主板应: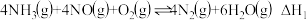
副反应: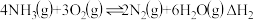
(3)根据盖斯定律可得: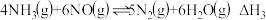
则 =
=___________ (用含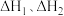 的式子表示)。
的式子表示)。
(4)催化剂 中的
中的 是活性组分。在反应器中以一定流速通过混合气
是活性组分。在反应器中以一定流速通过混合气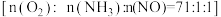 ,在不同温度下进行该催化反应,
,在不同温度下进行该催化反应, 的质量分数对单位时间内NO去除率的影响如图所示。
的质量分数对单位时间内NO去除率的影响如图所示。
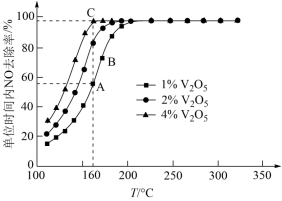
①从起始至对应A、B、C三点的平均反应速率由小到大的顺序为___________ 。
② 的质量分数对该催化剂活性的影响是
的质量分数对该催化剂活性的影响是___________ 。
(5)一定温度下,向1 L恒容密闭容器(含催化剂)中投入1 mol 和1.5 mol NO,发生反应
和1.5 mol NO,发生反应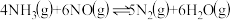 。达到平衡状态时,NO的转化率为60%,则平衡常数为
。达到平衡状态时,NO的转化率为60%,则平衡常数为___________  (列出计算式即可)。
(列出计算式即可)。
I.工业上可由氢气和氮气合成氨气。若用
 、
、 、
、 、
、 分别表示
分别表示 和固体催化剂,则在固体催化剂表面合成氨的过程如图所示:
和固体催化剂,则在固体催化剂表面合成氨的过程如图所示:
(1)吸附后,能量状态最高的是
(2)结合上述过程,一定温度下在固体催化剂表面进行
 的分解实验,发现
的分解实验,发现 的分解速率与其浓度的关系如图所示。从吸附和解吸过程分析,
的分解速率与其浓度的关系如图所示。从吸附和解吸过程分析, 前反应速率增加的原因可能是
前反应速率增加的原因可能是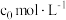 之后反应速率降低的原因可能是
之后反应速率降低的原因可能是
II.利用
 在催化剂(
在催化剂( )作用下将
)作用下将 还原为
还原为 是目前应用最为广泛的氮氧化物(
是目前应用最为广泛的氮氧化物( )净化方法,其原理是:
)净化方法,其原理是:主板应:
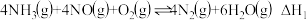
副反应:
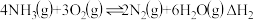
(3)根据盖斯定律可得:
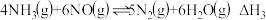
则
 =
=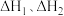 的式子表示)。
的式子表示)。(4)催化剂
 中的
中的 是活性组分。在反应器中以一定流速通过混合气
是活性组分。在反应器中以一定流速通过混合气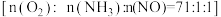 ,在不同温度下进行该催化反应,
,在不同温度下进行该催化反应, 的质量分数对单位时间内NO去除率的影响如图所示。
的质量分数对单位时间内NO去除率的影响如图所示。
①从起始至对应A、B、C三点的平均反应速率由小到大的顺序为
②
 的质量分数对该催化剂活性的影响是
的质量分数对该催化剂活性的影响是(5)一定温度下,向1 L恒容密闭容器(含催化剂)中投入1 mol
 和1.5 mol NO,发生反应
和1.5 mol NO,发生反应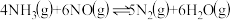 。达到平衡状态时,NO的转化率为60%,则平衡常数为
。达到平衡状态时,NO的转化率为60%,则平衡常数为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g) 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3物质的量浓度分别为0.1mol/L和0.3mol/L,则10min内生成SO3的化学反应速率为___________ ;SO2的转化率为___________ 。
(2)下列关于该反应的说法正确的是_________ 。
A.增加O2的浓度能加快反应速率B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是______ 。
A.O2为0.2mol/LB.SO2为0.25mol/L
C.SO3为0.4mol/LD.SO2、SO3均为0.15mol/L
 2SO3(g)。
2SO3(g)。(1)一定条件下,SO2与O2反应10min后,若SO2和SO3物质的量浓度分别为0.1mol/L和0.3mol/L,则10min内生成SO3的化学反应速率为
(2)下列关于该反应的说法正确的是
A.增加O2的浓度能加快反应速率B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是
A.O2为0.2mol/LB.SO2为0.25mol/L
C.SO3为0.4mol/LD.SO2、SO3均为0.15mol/L
您最近一年使用:0次
【推荐2】利用太阳能等可再生能源,通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇,发生的主要反应是CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
请回答下列有关问题:
(1)若二氧化碳加氢制甲醇反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是___________(填字母)。
(2)常压下,二氧化碳加氢制甲醇反应时的能量变化如图1所示,则该反应的ΔH=___________ 。
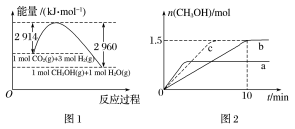
(3)在2 L恒容密闭容器a和b中分别投入2 mol CO2和6 mol H2,在不同温度下进行二氧化碳加氢制甲醇的反应,各容器中甲醇的物质的量与时间的关系如图2所示。
①若容器a、容器b中的反应温度分别为T1、T2,则判断T1___________ (填“>”“<”或“=”)T2.若容器b中改变条件时,反应情况会由曲线b变为曲线c,则改变的条件是___________ 。
②计算容器b中0~10 min氢气的平均反应速率v(H2)=___________ mol·L-1·min-1。
③在容器b中该反应的平衡常数为___________ (保留3位有效数字)。若平衡时向容器b中再充入1 mol CO2和3 mol H2,重新达平衡时,混合气体中甲醇的物质的量分数___________ (填“>”“<”或“=”)30%。
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。请回答下列有关问题:
(1)若二氧化碳加氢制甲醇反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是___________(填字母)。
A. | B.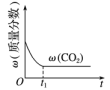 | C. | D. |

(3)在2 L恒容密闭容器a和b中分别投入2 mol CO2和6 mol H2,在不同温度下进行二氧化碳加氢制甲醇的反应,各容器中甲醇的物质的量与时间的关系如图2所示。
①若容器a、容器b中的反应温度分别为T1、T2,则判断T1
②计算容器b中0~10 min氢气的平均反应速率v(H2)=
③在容器b中该反应的平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)通过活性炭对汽车尾气进行处理,相关原理为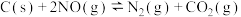 。下列情况能说明该反应达到平衡状态的是
。下列情况能说明该反应达到平衡状态的是___________ 。
A.
B.气体的总物质的量保持不变
C.恒温、恒压条件下,混合气体的平均摩尔质量保持不变
D.恒温、恒容条件下,混合气体的密度保持不变
E.单位时间内断裂1mol 同时生成1mol C=O
同时生成1mol C=O
(2)在催化转化器中,汽车尾气中的CO和NO可发生反应 ,若在容积为10L的密闭容器中进行该反应,起始时充入0.4mol CO、0.2mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
,若在容积为10L的密闭容器中进行该反应,起始时充入0.4mol CO、0.2mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
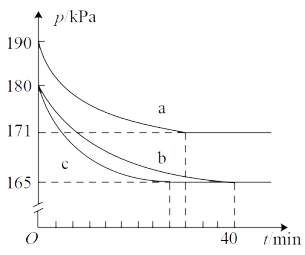
在 温度下,实验b从开始至40min达到平衡时的反应速率
温度下,实验b从开始至40min达到平衡时的反应速率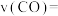
___________ ;NO的平衡转化率为___________ 。
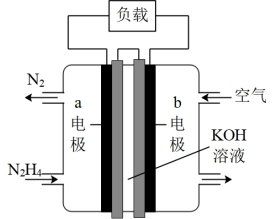
(3)为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,负极发生的反应式为___________ ,当电池放电转移10mol电子时,至少消耗___________ g。
(1)通过活性炭对汽车尾气进行处理,相关原理为
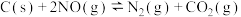 。下列情况能说明该反应达到平衡状态的是
。下列情况能说明该反应达到平衡状态的是A.

B.气体的总物质的量保持不变
C.恒温、恒压条件下,混合气体的平均摩尔质量保持不变
D.恒温、恒容条件下,混合气体的密度保持不变
E.单位时间内断裂1mol
 同时生成1mol C=O
同时生成1mol C=O(2)在催化转化器中,汽车尾气中的CO和NO可发生反应
 ,若在容积为10L的密闭容器中进行该反应,起始时充入0.4mol CO、0.2mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
,若在容积为10L的密闭容器中进行该反应,起始时充入0.4mol CO、0.2mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
在
 温度下,实验b从开始至40min达到平衡时的反应速率
温度下,实验b从开始至40min达到平衡时的反应速率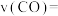
(3)为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,负极发生的反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】CO和 可作为能源和化工原料,应用十分广泛。工业上可利用CO或
可作为能源和化工原料,应用十分广泛。工业上可利用CO或 与
与 反应来制备甲醇。
反应来制备甲醇。
反应①: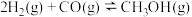 ,
,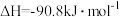
反应②: ,
,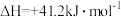
(1)写出用 与
与 反应制备甲醇的热化学方程式
反应制备甲醇的热化学方程式________________ 。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应: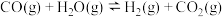 ,该反应平衡常数随温度的变化如下表所示:
,该反应平衡常数随温度的变化如下表所示:
回答下列问题:
①该反应的化学平衡常数表达式为
________________ 。
②升高温度,该平衡的移动方向是________________ (填“正向”或“逆向”)。
(3)某温度下,平衡浓度符合下式: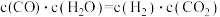 ,试判断此时的温度为
,试判断此时的温度为____ 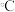 。
。
(4)一定条件下,可以由 和
和 合成
合成 ,同时还生成
,同时还生成 。向恒容密闭容器中充入一定量的
。向恒容密闭容器中充入一定量的 和
和 ,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示:
,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示:
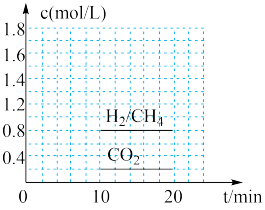
该温度下的的平衡常数等于________________ 。
 可作为能源和化工原料,应用十分广泛。工业上可利用CO或
可作为能源和化工原料,应用十分广泛。工业上可利用CO或 与
与 反应来制备甲醇。
反应来制备甲醇。反应①:
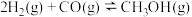 ,
,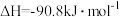
反应②:
 ,
,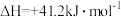
(1)写出用
 与
与 反应制备甲醇的热化学方程式
反应制备甲醇的热化学方程式(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:
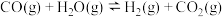 ,该反应平衡常数随温度的变化如下表所示:
,该反应平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
①该反应的化学平衡常数表达式为

②升高温度,该平衡的移动方向是
(3)某温度下,平衡浓度符合下式:
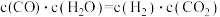 ,试判断此时的温度为
,试判断此时的温度为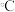 。
。(4)一定条件下,可以由
 和
和 合成
合成 ,同时还生成
,同时还生成 。向恒容密闭容器中充入一定量的
。向恒容密闭容器中充入一定量的 和
和 ,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示:
,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示:
该温度下的的平衡常数等于
您最近一年使用:0次
【推荐2】为降低温室效应,CO2的捕集利用技术成为研究的重点。
(1)一种利用CO2的反应为:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0。下列措施能使已达到平衡时反应的正反应速率增大,且平衡向正反应方向移动的是___________ 。
A. 及时分离出水蒸气 B. 适当降低温度
C. 增大CO2的浓度 D. 缩小体积,增大压强
(2)CO2和H2发生如下反应可以制取甲醇和二甲醚。
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(l)+H2O(l) ΔH1=﹣49.5kJ·mol-1
反应Ⅱ:H2O(l)=H2O(g) ΔH2=+44.0kJ·mol-1
反应Ⅲ:由CH3OH合成CH3OCH3反应的能量变化如图所示

判断反应Ⅲ是放热反应还是吸热反应,并说明你作出判断的理由:___________ 。
(3)CO合成甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g) ΔH,在容积均为2L的甲、乙两个恒容密闭容器中分别充入2molCO、4molH2与4molCO、8molH2,在催化剂作用下发生反应,平衡时甲醇的体积分数与温度的关系如图所示。

①能判断反应已达到化学平衡状态的依据是___________ 。
A.混合气体的密度不变 B.2v正(H2)=v逆(CH3OH)
C.容器中的气体的压强不变 D.c(CO)∶c(H2)∶c(CH3OH)=1∶2∶1
②曲线Ⅰ代表的是容器___________ (填“甲”或“乙”)中发生的反应。
③A、B、C三点的平衡常数KA、KB、KC大小关系是___________ ,KC=___________ mol-2/L2,
④300℃时,当甲容器中CH3OH的体积分数处于D点时,此时v(正)___________ v(逆)。
(1)一种利用CO2的反应为:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0。下列措施能使已达到平衡时反应的正反应速率增大,且平衡向正反应方向移动的是
A. 及时分离出水蒸气 B. 适当降低温度
C. 增大CO2的浓度 D. 缩小体积,增大压强
(2)CO2和H2发生如下反应可以制取甲醇和二甲醚。
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(l)+H2O(l) ΔH1=﹣49.5kJ·mol-1
反应Ⅱ:H2O(l)=H2O(g) ΔH2=+44.0kJ·mol-1
反应Ⅲ:由CH3OH合成CH3OCH3反应的能量变化如图所示

判断反应Ⅲ是放热反应还是吸热反应,并说明你作出判断的理由:
(3)CO合成甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g) ΔH,在容积均为2L的甲、乙两个恒容密闭容器中分别充入2molCO、4molH2与4molCO、8molH2,在催化剂作用下发生反应,平衡时甲醇的体积分数与温度的关系如图所示。

①能判断反应已达到化学平衡状态的依据是
A.混合气体的密度不变 B.2v正(H2)=v逆(CH3OH)
C.容器中的气体的压强不变 D.c(CO)∶c(H2)∶c(CH3OH)=1∶2∶1
②曲线Ⅰ代表的是容器
③A、B、C三点的平衡常数KA、KB、KC大小关系是
④300℃时,当甲容器中CH3OH的体积分数处于D点时,此时v(正)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】I.H2O2能缓慢分解生成水和氧气,但分解速率较慢,加入催化剂会加快分解速率。某化学兴趣小组为研究不同催化剂对H2O2分解反应的催化效果,设计了如图甲、乙、丙所示的三组实验。
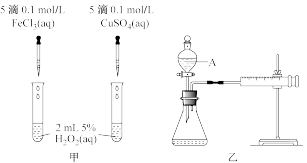
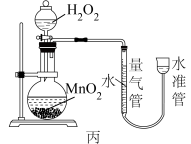
(1)定性分析:可以通过观察甲装置的_______ 现象,而定性得出关于Fe3+和Cu2+催化效果的结论。有同学认为该实验不能比较Fe3+和Cu2+的催化效果,理由是_______ 。
(2)定量测定:用乙装置做对照试验,仪器A的名称是_______ 。实验时组装好装置乙,关闭A的旋塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。这一操作的实验目的是_______ 。实验时以2min时间为准,需要测量的数据是_______ 。(其它可能影响实验的因素均已忽略)
II.CO2可用于合成多种化工原料。用 CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
(3)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。
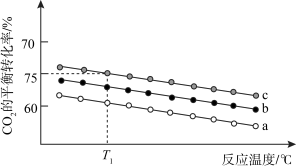
①反应A的ΔH1_______ 0(填“>”或“<”)。
②曲线c对应的投料是_______ 。
(4)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对CO2的转化率影响如图2所示。
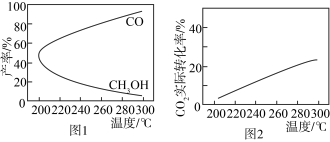
由图像可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是_______ 。


(1)定性分析:可以通过观察甲装置的
(2)定量测定:用乙装置做对照试验,仪器A的名称是
II.CO2可用于合成多种化工原料。用 CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1(3)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。

①反应A的ΔH1
②曲线c对应的投料是
(4)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对CO2的转化率影响如图2所示。

由图像可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是
您最近一年使用:0次
【推荐1】金属钛( )在航空航天、医疗器械等工业领域有着重要用途。回答下列问题:
)在航空航天、医疗器械等工业领域有着重要用途。回答下列问题:
(1)目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原
,再进一步还原 得到钛。
得到钛。 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在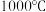 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:
直接氯化: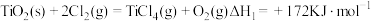 ,
,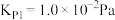
碳氯化: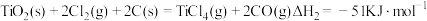 ,
,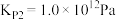
运用以上数据分析,你认为以上两个方法更优越的是__________ ,理由是__________ 。
(2)已知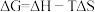 ,
, 和
和 类似,只取决于反应体系的始态和终态。根据如图回答问题。
类似,只取决于反应体系的始态和终态。根据如图回答问题。

①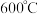 时,反应
时,反应
________ 自发进行(填“能”或“不能”)。
②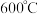 时,
时,
________ 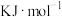 。
。
(3)钛酸锂是一种理想的嵌入型电极材料。某新型钛酸锂电池与普通石墨烯锂电池相比,电位比较高,安全性相较好,工作原理如图所示。
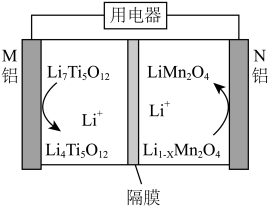
①电池的正极为______ (填“M”或“N”)
②放电时, 通过隔膜向
通过隔膜向______ 极(填“M”或“N”)移动。
③放电时,电极N的电极反应式为______ 。
 )在航空航天、医疗器械等工业领域有着重要用途。回答下列问题:
)在航空航天、医疗器械等工业领域有着重要用途。回答下列问题:(1)目前生产钛的方法之一是将金红石(
 )转化为
)转化为 ,再进一步还原
,再进一步还原 得到钛。
得到钛。 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在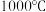 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:直接氯化:
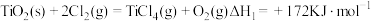 ,
,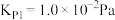
碳氯化:
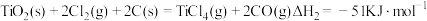 ,
,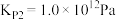
运用以上数据分析,你认为以上两个方法更优越的是
(2)已知
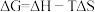 ,
, 和
和 类似,只取决于反应体系的始态和终态。根据如图回答问题。
类似,只取决于反应体系的始态和终态。根据如图回答问题。
①
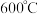 时,反应
时,反应
②
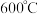 时,
时,
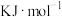 。
。(3)钛酸锂是一种理想的嵌入型电极材料。某新型钛酸锂电池与普通石墨烯锂电池相比,电位比较高,安全性相较好,工作原理如图所示。

①电池的正极为
②放电时,
 通过隔膜向
通过隔膜向③放电时,电极N的电极反应式为
您最近一年使用:0次
【推荐2】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如图所示:

(1)已知: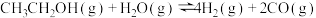
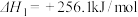
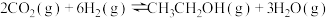

请写出反应II的热化学方程式______ 。
(2)反应II,在进气比[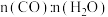 ]不同时,测得相应的CO平衡转化率见右图(各点的反应温度可能相同或不同,其他反应条件都相同)。
]不同时,测得相应的CO平衡转化率见右图(各点的反应温度可能相同或不同,其他反应条件都相同)。

①经分析,A和E两点对应的反应温度相同,其原因是KA=KB=______ (填数值)。该温度下,要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是______ 。
②比较A、B两点对应的反应速率大小:vA______ vB(填“<”“=”或“>”)。.
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。已知碳酸的电离常数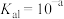 ,
,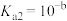 ,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中
,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中
______ 。

(1)已知:
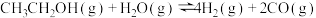
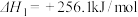
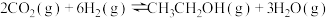

请写出反应II的热化学方程式
(2)反应II,在进气比[
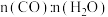 ]不同时,测得相应的CO平衡转化率见右图(各点的反应温度可能相同或不同,其他反应条件都相同)。
]不同时,测得相应的CO平衡转化率见右图(各点的反应温度可能相同或不同,其他反应条件都相同)。
①经分析,A和E两点对应的反应温度相同,其原因是KA=KB=
②比较A、B两点对应的反应速率大小:vA
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。已知碳酸的电离常数
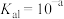 ,
, ,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中
,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】I.将CO2转化成甲醇燃料是减排、环保的一种科学方法。
已知:2H2(g)+O2(g) =2H2O(g);△H=-483.6kJ·mol-1①
2CO2(g)+4H2O(g) 2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
则用CO2与H2反应制备 CH3OH(g),同时生成水蒸气的热化学方程式为___________________
II.在容积为2L的密闭容器中,进行如下反应:A(g)+2B(g)⇌ C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
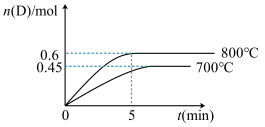
试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为____________ 。
(2)能判断该反应达到化学平衡状态的依据是_______________ 。
a.容器中压强不变 b.混合气体中c(A)不变
c.2v正(B)=v逆(D) d.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=________ ,该反应为_______ 反应(填吸热或放热),判断理由是______________________________ 。
(4)800℃时,某时刻测得体系中各物质的量如下:n(A)=0.9mol,n(B)=2.0mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应________ 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
已知:2H2(g)+O2(g) =2H2O(g);△H=-483.6kJ·mol-1①
2CO2(g)+4H2O(g)
 2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②则用CO2与H2反应制备 CH3OH(g),同时生成水蒸气的热化学方程式为
II.在容积为2L的密闭容器中,进行如下反应:A(g)+2B(g)⇌ C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。

试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为
(2)能判断该反应达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(A)不变
c.2v正(B)=v逆(D) d.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=
(4)800℃时,某时刻测得体系中各物质的量如下:n(A)=0.9mol,n(B)=2.0mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应
您最近一年使用:0次



