(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。
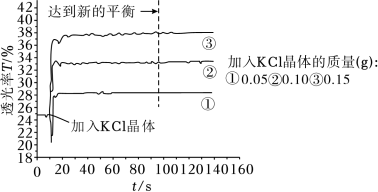
已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl-
 [FeCl4]-(黄色)。
[FeCl4]-(黄色)。①采用FeCl3稀溶液是为了避免
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O
 +I2=S4O
+I2=S4O +2I-;
+2I-;ii.I2+I-
 I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式
 的溶度积常数
的溶度积常数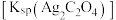 的测定,某兴趣小组设计如下步骤。
的测定,某兴趣小组设计如下步骤。
(1)步骤Ⅰ中需要配制
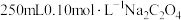 溶液、
溶液、 溶液、
溶液、 标准溶液。
标准溶液。①配制
 溶液时,选用棕色的容量瓶而不选用普通容量瓶的原因为
溶液时,选用棕色的容量瓶而不选用普通容量瓶的原因为②用
 固体配制该溶液时,需要用电子天平称量
固体配制该溶液时,需要用电子天平称量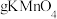 固体(该电子天平称量时可读数到
固体(该电子天平称量时可读数到 )。
)。(2)用碱性滴定管量取
 溶液于洁净的棕色锥形瓶中,然后用棕色滴定管量取一定体积的
溶液于洁净的棕色锥形瓶中,然后用棕色滴定管量取一定体积的 溶液注入到棕色锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化
溶液注入到棕色锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化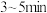 ,用过滤器过滤,滤液用干燥洁净的烧杯盛接。
,用过滤器过滤,滤液用干燥洁净的烧杯盛接。①量取
 溶液时选用碱式滴定管的主要原因为
溶液时选用碱式滴定管的主要原因为②为方便数据处理,“一定体积”最好是
 。
。(3)准确量取
 所得滤液注入锥形瓶中,加入足量的
所得滤液注入锥形瓶中,加入足量的 的硫酸,用所配
的硫酸,用所配 标准溶液滴定,实验三次,消耗
标准溶液滴定,实验三次,消耗 标准溶液的平均值为
标准溶液的平均值为 (已知:
(已知: )。
)。①滴定终点现象为
②
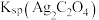 的溶度积测定值为
的溶度积测定值为③若步骤Ⅱ中烧杯盛接的滤液浑浊,会使测量值
 是工业制备的一种重要原料,很多物质的制备都需要用到氯气.比如工业上用
是工业制备的一种重要原料,很多物质的制备都需要用到氯气.比如工业上用 制备
制备 ,反应原理为:
,反应原理为: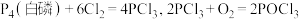 。已知:
。已知: 的部分性质如下:
的部分性质如下:| 熔点/℃ | 沸点/℃ | 相对分子质量 | 其它 | |
 |  | 75.5 | 137.5 | 遇水生成 和HCl 和HCl |
 | 2 | 105.3 | 153.5 | 遇水生成 和HCl 和HCl |
 空间构型为
空间构型为①五氧化二磷②碱石灰③无水氯化钙
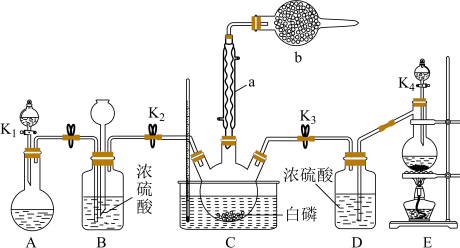
(2)装置E中用软锰矿制备气体的离子方程式为
(3)C反应温度控制在60~65℃,不能过高或过低的原因是
(4)通过测定三氯氧磷粗产品(还含有一定量的
 )中氧元素含量,可进一步计算产品三氯氧磷的纯度,实验步骤如下:
)中氧元素含量,可进一步计算产品三氯氧磷的纯度,实验步骤如下:①取ag产品置于盛50.00mL蒸馏水的水解瓶中,摇动至完全水解,将水解液配成100.00mL溶液,预处理排除含磷粒子的影响。
②取10.00mL溶液于锥形瓶中,向其中加入
 的
的 溶液
溶液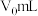 ,使
,使 完全沉淀,然后选择
完全沉淀,然后选择 作指示剂,用
作指示剂,用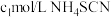 溶液滴定过量
溶液滴定过量 至终点,记下所用体积为
至终点,记下所用体积为 。滴定终点的现象:
。滴定终点的现象:(5)产品中氧元素的质量分数为
(6)资料表明,
 与
与 性质相近,乙醇在过量无水
性质相近,乙醇在过量无水 的作用下制备溴乙烷的反应机理如下图所示,请写出该条件下制备溴乙烷总反应方程式
的作用下制备溴乙烷的反应机理如下图所示,请写出该条件下制备溴乙烷总反应方程式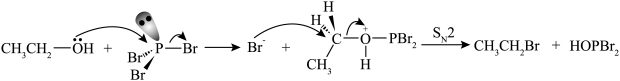
 法测定水中化学需氧量(COD),即水体中还原性物质每消耗
法测定水中化学需氧量(COD),即水体中还原性物质每消耗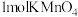 折算为
折算为 的消耗量。其操作步骤如下:
的消耗量。其操作步骤如下:①取水样
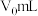 ,先加入足量稀硫酸酸化,再加入
,先加入足量稀硫酸酸化,再加入 的
的 标准液,煮沸30min(充分氧化水中的还原性物质),溶液呈稳定的红色,冷却至室温。
标准液,煮沸30min(充分氧化水中的还原性物质),溶液呈稳定的红色,冷却至室温。②向①中溶液中加入
 的
的 标准液(过量)。
标准液(过量)。③用
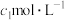 的
的 标准液滴定②中溶液至滴定终点,消耗
标准液滴定②中溶液至滴定终点,消耗 标准液
标准液 。
。根据上述实验原理,下列说法错误的是
A.若水样中 含量偏高,则所测水样中COD偏大 含量偏高,则所测水样中COD偏大 |
| B.步骤③滴定终点俯视读数,则所测水样中COD偏大 |
| C.步骤①中若煮沸时间过短,则所测水样中COD偏小 |
D.步骤①煮沸后,若红色消失说明水样中COD偏大,需补加 标准液 标准液 |

已知:①双氧水(H2O2)在弱酸性或中性条件下性质较稳定,在碱性条件下不稳定。
②273 K时,

(1)判断“酸浸1”完成的标志是
(2)“除杂”时,待充分反应后将溶液煮沸并趁热过滤,“滤渣”的主要成分为
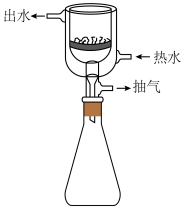
(3)“转化”需在冰水浴中进行,生成CaO2·8H2O晶体的离子方程式为
(4)测定产品中CaO2含量。高锰酸钾滴定法原理为:在酸性条件下,CaO2与稀酸反应生成H2O2,用标准酸性KMnO4溶液滴定所生成的H2O2,以确定CaO2含量。下列关于滴定分析的说法,
| A.滴定时应一直观察滴定管中溶液体积的变化 |
| B.当滴入半滴酸性KMnO4溶液后,溶液颜色从无色刚好变为浅红色,且半分钟内不变色,表示已经到达滴定终点 |
| C.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测定结果偏小 |
| D.读取 KMnO4溶液体积时,滴定前俯视读数,滴定后仰视读数,则测定结果偏大 |
(5)以电石渣[主要成分为Ca(OH)2,还含有少量SiO2等杂质]为原料也可制备CaO2,设计制备CaO2·8H2O晶体的实验方案:
 溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:(ⅰ)


(ⅱ)
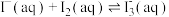
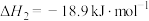
(ⅲ)
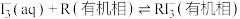

(1)根据盖斯定律,反应


(2)基态碘原子价层电子的轨道表示式为
(3)①反应条件会影响碘的萃取率。其他条件不变时,不同温度下达平衡时碘萃取率
[
 ]曲线如图所示:
]曲线如图所示: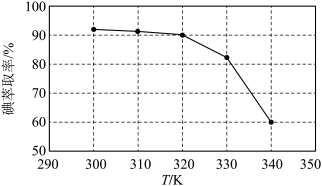
 的挥发及
的挥发及 分解产生的影响)。当萃取温度超过320 K时,
分解产生的影响)。当萃取温度超过320 K时, 的分解导致碘萃取率明显下降。
的分解导致碘萃取率明显下降。②下列说法不正确的是
A.增大溶液的pH,碘萃取率降低 B.增大萃取剂用量,碘萃取率升高
C.萃取体系平衡后加水稀释,
 变小 D.增大
变小 D.增大 的浓度,反应(ⅰ)的速率增大
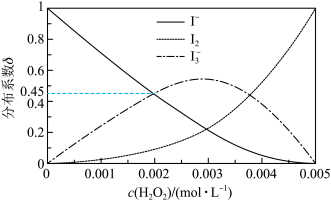
的浓度,反应(ⅰ)的速率增大(4)未加萃取剂时,固定总碘浓度为
 ,平衡时溶液中的
,平衡时溶液中的 、
、 、
、 分布系数
分布系数 与溶液中初始
与溶液中初始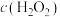 关系如图所示。[总碘浓度
关系如图所示。[总碘浓度 各组分折合为
各组分折合为 后的浓度之和,
后的浓度之和, ,如
,如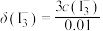 ]
]
 、
、 、
、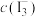 分别为
分别为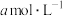 、
、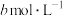 、
、 ,则
,则 、
、 、
、 之间的关系式为
之间的关系式为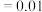 。
。②计算反应
 的平衡常数
的平衡常数
(5)测定卤水中的
 方法:取
方法:取 卤水于锥形瓶中,加适量氧化剂恰好将
卤水于锥形瓶中,加适量氧化剂恰好将 全部氧化为
全部氧化为 ;加
;加 溶液酸化后,再加入适量
溶液酸化后,再加入适量 溶液,密闭静置后,用
溶液,密闭静置后,用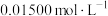
 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗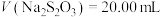 ,则卤水中
,则卤水中
 。(已知:
。(已知: )
)
7 . Na2S2O3标准溶液是氧化还原反应中常用的还原性标定试剂,但是 固体通常含有一些杂质,且易风化和潮解,Na2S2O3溶液也容易被O2氧化。因此,Na2S2O3标准溶液配制好后常用
固体通常含有一些杂质,且易风化和潮解,Na2S2O3溶液也容易被O2氧化。因此,Na2S2O3标准溶液配制好后常用 进行标定。但是由于
进行标定。但是由于 与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。故应先用
与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。故应先用 与过量的KI反应,定量生成
与过量的KI反应,定量生成 ,再用Na2S2O3滴定
,再用Na2S2O3滴定 ,发生反应的化学方程式为:
,发生反应的化学方程式为: 、
、 。我们将这种
。我们将这种 与
与 联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
已知: 与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
(1)
 标准溶液的配制:
标准溶液的配制:①配制480 mL 0.1 mol/L的 标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、
标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、
②将下述实验步骤A到F按实验过程先后次序排列
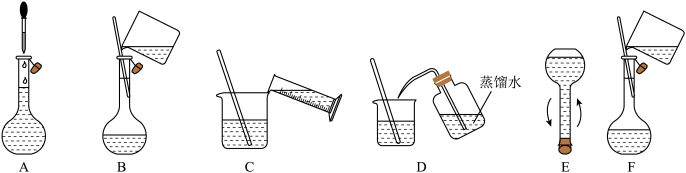
(2)
 标准溶液的标定:取20.00 mL 0.017 mol/L
标准溶液的标定:取20.00 mL 0.017 mol/L  溶液于250 mL锥形瓶中,加5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用
溶液于250 mL锥形瓶中,加5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用 溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算
溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算 标准溶液的浓度。
标准溶液的浓度。①用 溶液。
溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是
③如何判定滴定结束?
④列式并计算 标准溶液的浓度。
标准溶液的浓度。
| KI溶液 |
|
|
20.00 mL 0.017 mol/L | 10 mL 100 g/L | 20.35 | |
20.45 | |||
20.40 | |||
21.20 |
(3)借鉴(2)的方法,用碘量法测量
 溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L
溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L  溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的
溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的 溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用
溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用 溶液继续滴定至终点。
溶液继续滴定至终点。①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么?
②写出 溶液与KI反应的离子方程式
溶液与KI反应的离子方程式
(4)借鉴(3)的方法,某小组用碘量法测量磷酸铁锂溶液中
 的物质的量浓度。
的物质的量浓度。提出问题: 与
与 是可逆反应,
是可逆反应, 的存在是否会影响滴定?
的存在是否会影响滴定?
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出 与
与 反应的离子方程式:
反应的离子方程式:
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用 溶液进行标定,发现消耗的
溶液进行标定,发现消耗的 溶液体积相同。
溶液体积相同。
实验小结: 是否会影响滴定:
是否会影响滴定:

实验步骤:
(ⅰ)连接仪器,检验装置的气密性,盛装药品;打开K1,通一段时间N2;
(ⅱ)关闭K1,加入适量浓盐酸,接通冷凝装置,加热管式炉;
(ⅲ)待反应结束,停止加热,打开K1,再通一段时间N2.
回答下列问题:
(1)仪器甲的名称为
(2)装置D的产物中含有极性的二元化合物分子,则该反应的化学方程式为
(3)反应结束后通入N2的目的是
(4)已知AgSCN是一种白色沉淀且
 。
。 产率的测定方法如下(不考虑杂质的反应):
产率的测定方法如下(不考虑杂质的反应):①mgB2O3与足量木炭、氯气反应,取产品的20%于水解瓶中完全水解,稀释至100.00mL。
②取10.00mL该溶液于锥形瓶中,加入V1mLc1mol⋅L-1AgNO3溶液,加入适量硝基苯,用力摇动,将沉淀表面完全覆盖。
③以
 溶液为指示剂,用c2mol⋅L-1KSCN标准溶液滴定过量AgNO3溶液,消耗标准溶液V2mL。
溶液为指示剂,用c2mol⋅L-1KSCN标准溶液滴定过量AgNO3溶液,消耗标准溶液V2mL。判断滴定终点的现象是
I.制备
步骤1:将mg淀粉溶于水与少量硫酸加入反应器中,保持85~90℃约30min,然后逐渐降温至60℃左右。
步骤2:控制反应温度在55~60℃条件下,边搅拌边缓慢滴加含有适量催化剂的混酸(65%硝酸与98%硫酸),主要反应为
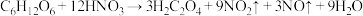 。严格控制混酸的滴加速度,防止发生副反应。3h左右,冷却,减压过滤得粗品,精制得草酸晶体
。严格控制混酸的滴加速度,防止发生副反应。3h左右,冷却,减压过滤得粗品,精制得草酸晶体 。
。Ⅱ.纯度测定
称取制得的草酸晶体
 ,配成100.00mL溶液。取出20.00mL,用cmol·L-1酸性KMnO4标准溶液滴定,重复2~3次,滴定终点时,平均消耗标准溶液VmL。对于上述实验,下列说法正确的是
,配成100.00mL溶液。取出20.00mL,用cmol·L-1酸性KMnO4标准溶液滴定,重复2~3次,滴定终点时,平均消耗标准溶液VmL。对于上述实验,下列说法正确的是A.65%浓硝酸( )的物质的量浓度约为13.6mol·L-1 )的物质的量浓度约为13.6mol·L-1 |
B.草酸晶体的产率为 |
| C.配制的草酸溶液物质的量浓度为0.025cVmol·L-1 |
D.草酸晶体的纯度为 |
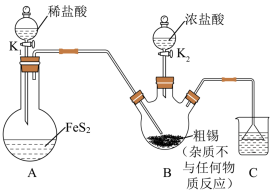
已知:还原性:Fe2+<I-<Sn2+。
回答下列问题:
(1)装置A中发生反应的离子方程式为
(2)在装置B中现制备SnCl2溶液而不直接用SnCl2溶液,主要原因是
(3)开关
 先打开的是
先打开的是(4)为测定
 纯度,进行如下操作:
纯度,进行如下操作:①向mg产品中加入稍过量的
 溶液(
溶液( )。
)。②将①中悬浊液离心过滤后,向滤液中加入
 的
的 溶液,充分反应后,用淀粉溶液作指示剂,用
溶液,充分反应后,用淀粉溶液作指示剂,用 的
的 溶液进行滴定(
溶液进行滴定( ),达到滴定终点时消耗
),达到滴定终点时消耗 溶液,则
溶液,则 的纯度为
的纯度为 ;下列操作不会影响
;下列操作不会影响 纯度测定的是
纯度测定的是A.①中盛
 溶液的滴定管未润洗
溶液的滴定管未润洗B.②中滴定结束后滴定管中有气泡产生
C.②中离心不完全,滤液中还含有少量淡黄色沉淀





