名校
解题方法
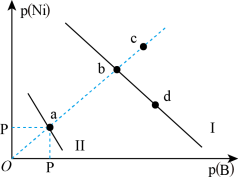
1 . 已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=-lgc(S2-)或-lgc(CO )。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
 )。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
| A.常温下NiCO3的溶解度大于NiS的溶解度 |
| B.向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动 |
| C.对于曲线Ⅰ,在b点加热,b点向c点移动 |
D.P为3.5且对应的阴离子是CO |
您最近一年使用:0次
2021-09-05更新
|
3100次组卷
|
42卷引用:四川省资阳市高中2018届高三第二次诊断性考试理科综合化学试题
四川省资阳市高中2018届高三第二次诊断性考试理科综合化学试题西北师大附中2018届下学期高三年级第二次模拟理综化学试卷西藏自治区拉萨中学2018届高三第七次月考理综化学试题【全国市级联考】河北省保定市2018届高三第二次模拟考试理科综合化学试题【全国市级联考】江西省南昌市2018届高三第三次模拟考试理综化学试题【全国百强校】广东省阳春市第一中学2018届高三第九次月考理综化学试题【市级联考】湖北省十堰市2019届高三下学期模拟化学试题四川省泸县第四中学2019届高三下学期三诊模拟理科综合化学试题辽宁省六校协作体2020届高三上学期期中考试化学试题步步为赢 高二化学寒假作业:综合检测(一)福建省厦门外国语学校2020届高三12月月考化学试题2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡的曲线分析【精编25题】吉林省梅河口市第五中学2020届高三下学期模拟考试化学试题(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编鲁科版(2019)选择性必修1化学反应原理 综合训练高中必刷题高二选择性必修1化学反应原理综合训练(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)第三章 水溶液中的离子平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)易错17 难溶电解质的溶解平衡及应用-备战2021年高考化学一轮复习易错题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过素养 学科素养拓展训练人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 过素养 学科素养拓展训练山东省临朐县实验中学2020-2021学年高二上学期12月月结学情检测化学试题(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)选择性必修1(SJ)专题3专题培优专练选择性必修1 化学反应原理综合训练(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)3.4.2 沉淀溶解平衡原理的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)2021年高考全国乙卷化学试题变式题陕西省宝鸡市陈仓区2022届高三上学期第一次教学质量检测化学试题江西省九江市第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)【直击双一流】06-备战2022年高考化学名校进阶模拟卷(通用版)湖南省株洲市第一中学2021-2022学年高三下学期期中考试化学试题陕西省汉中中学2021-2022学年高二上学期第四次月考化学试题吉林省长春市第五中学2022-2023学年高二上学期期中考试化学试题湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型27 沉淀溶解平衡常数及其应用图象(已下线)T13-溶液中的离子平衡浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题
解题方法
2 . 根据各图曲线表征的信息,得出的结论错误的是


| A.图1表示常温下向体积为10 mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液的pH变化曲线,则c点有:c(CH3COOH)+2c(H+)=2c(OH-)+c(CH3COO-) |
| B.图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性 |
| C.由图3曲线,可确定Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI),故用0.0100 mol·L-1 AgNO3标准溶液,滴定浓度均为0.1000 mol·L-1 Cl-、Br-及I-的混合溶液时,首先沉淀的是I- |
| D.图4表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示盐酸,Ⅱ表示醋酸,且溶液导电性:b>a>c |
您最近一年使用:0次
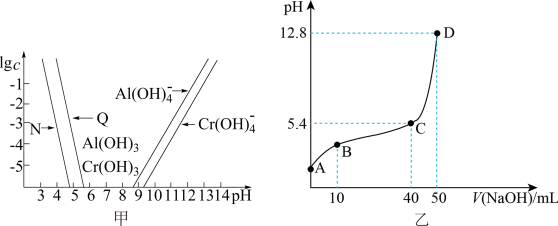
3 . 已知:①Ksp[Al(OH)3]=1.3×10-33,Ksp[Cr(OH)3]>Ksp[Al(OH)3];
②Cr(OH)3和Al(OH)3类似,是两性氢氧化物;
③离子浓度为10-5mol/L时可认为沉淀完全。
图甲为Cr和Al两种元素在水溶液中的存在形式与pH的关系,纵轴lgc表示lgc(M3+)或 。图乙为常温下,向含有物质的量浓度均为cmol/L的盐酸和CrCl3溶液中滴加浓度为cmol/L的NaOH溶液时pH与NaOH溶液体积的关系图。
。图乙为常温下,向含有物质的量浓度均为cmol/L的盐酸和CrCl3溶液中滴加浓度为cmol/L的NaOH溶液时pH与NaOH溶液体积的关系图。
下列说法正确的是
②Cr(OH)3和Al(OH)3类似,是两性氢氧化物;
③离子浓度为10-5mol/L时可认为沉淀完全。
图甲为Cr和Al两种元素在水溶液中的存在形式与pH的关系,纵轴lgc表示lgc(M3+)或
 。图乙为常温下,向含有物质的量浓度均为cmol/L的盐酸和CrCl3溶液中滴加浓度为cmol/L的NaOH溶液时pH与NaOH溶液体积的关系图。
。图乙为常温下,向含有物质的量浓度均为cmol/L的盐酸和CrCl3溶液中滴加浓度为cmol/L的NaOH溶液时pH与NaOH溶液体积的关系图。
下列说法正确的是
| A.图甲中Q代表Al3+ |
| B.图乙中,pH=5时,c(Cr3+)=1.0×10-3.8mol/L |
| C.图乙中,A到D过程中,溶液中水的电离程度先减小后增大 |
| D.根据图甲所示,若溶液中Al3+和Cr3+的起始浓度均为0.1mol/L,通过调节pH能实现两种元素的分离 |
您最近一年使用:0次
名校
解题方法
4 . 常温下,向20 mL 0.1 mol·L-1Na2CO3溶液中滴加0.1 mol·L-1 CaCl2溶液,碳酸根离子浓度与氯化钙溶液体积的关系如图所示。已知:pC=-lg c(CO ),Ksp(CdCO3)=1.0×10-12,Ksp(CaCO3)=3.6×10-9.下列说法正确的是
),Ksp(CdCO3)=1.0×10-12,Ksp(CaCO3)=3.6×10-9.下列说法正确的是

 ),Ksp(CdCO3)=1.0×10-12,Ksp(CaCO3)=3.6×10-9.下列说法正确的是
),Ksp(CdCO3)=1.0×10-12,Ksp(CaCO3)=3.6×10-9.下列说法正确的是
| A.图象中V0=20,m=5 |
B.a点溶液:c(OH-)>2c(HCO )+2c(H2CO3) )+2c(H2CO3) |
| C.若Na2CO3溶液的浓度变为0.05 mol·L-1,则n点向c点方向迁移 |
| D.若用CdCl2溶液替代CaCl2溶液,则n点向b点方向迁移 |
您最近一年使用:0次
2021-07-02更新
|
860次组卷
|
2卷引用:四川省成都七中(高新校区)2020-2021学年高二下学期期末零诊模拟化学试题
5 . 常温下,向20mL等浓度的NaCl溶液和Na2CrO4溶液中分别滴加AgNO3溶液,滴加过程中pCl=-lg c(Cl-)、pCr=-lg c(CrO )随AgNO3溶液体积变化如图。下列说法错误的是
)随AgNO3溶液体积变化如图。下列说法错误的是

 )随AgNO3溶液体积变化如图。下列说法错误的是
)随AgNO3溶液体积变化如图。下列说法错误的是
| A.AgNO3溶液的浓度为0.01mol·L-1 |
| B.L1代表pCr随AgNO3溶液体积变化的曲线 |
| C.Ksp(AgCl)的数量级为1×10-10 |
| D.若将原溶液浓度均降低一倍,图中b点将移动至c点 |
您最近一年使用:0次
名校
解题方法
6 . 用0.1000mol·L-1AgNO3溶液滴定50.00mL0.0500mol·L-1KI溶液的滴定曲线如图所示。
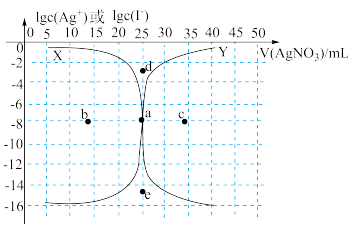
已知:Ksp(AgI)=4×10-16。下列有关描述正确的是

已知:Ksp(AgI)=4×10-16。下列有关描述正确的是
| A.曲线x代表lgc(Ag+)随v(AgNO3)变化而变化的曲线 |
| B.a点表示反应终点,其坐标是(25.00,-7.7) |
| C.相同实验条件下,若改为0.0500mol·L-1KCl溶液,反应终点由a向e方向移动 |
| D.相同实验条件下,若改为0.0500mol·L-1AgNO3溶液,反应终点a向b方向移动 |
您最近一年使用:0次
2021-05-31更新
|
731次组卷
|
4卷引用:四川省达州市普通高中2021届高三第二次诊断性测试理科综合化学试题
四川省达州市普通高中2021届高三第二次诊断性测试理科综合化学试题(已下线)第26讲 难溶电解质的溶解平衡(精练)-2022年高考化学一轮复习讲练测河北省石家庄市第二中学2021-2022学年高三上学期九月第四次考试化学试题辽宁省实验中学2021-2022学年度高三上学期第三次阶段测试化学试题
7 . 常温下,用0.100mol•L-1的NH4SCN标准溶液滴定25.00mL未知浓度的AgNO3溶液,以NH4Fe(SO4)2•12H2O为指示剂,测得溶液中pSCN=-lgc(SCN)、pAg=‒lgc(Ag+)随加入NH4SCN溶液的体积变化如图所示。已知: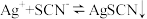 ,Ksp(Ag2CrO4)=1.0×10-12,Ksp(Ag2SO4)=1.4×10-5,Ksp(Ag2CO3)=8×10-12.回答下列问题:
,Ksp(Ag2CrO4)=1.0×10-12,Ksp(Ag2SO4)=1.4×10-5,Ksp(Ag2CO3)=8×10-12.回答下列问题:

(1)滴定终点的现象:_______ 。
(2)该温度下AgSCN溶度积常数Ksp=_______ 。
(3)为防止指示剂失效,溶液应维持____ (填“酸性”或“碱性”,),若用K2CrO4做指示剂,应控制其浓度不超过___ 。(假设c(Ag+)≤10-5mol·L-1,完全沉淀)
(4)当加入15.00mLNH4SCN溶液时,悬浊液中生成少量的Ag2SO4,则此时溶液中c( )=
)=___ 。
(5)滴定终点,再加入10mL0.005mol·L-1的Na2CO3溶液,__ (填“有”或“无”,)沉淀生成。
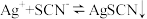 ,Ksp(Ag2CrO4)=1.0×10-12,Ksp(Ag2SO4)=1.4×10-5,Ksp(Ag2CO3)=8×10-12.回答下列问题:
,Ksp(Ag2CrO4)=1.0×10-12,Ksp(Ag2SO4)=1.4×10-5,Ksp(Ag2CO3)=8×10-12.回答下列问题:
(1)滴定终点的现象:
(2)该温度下AgSCN溶度积常数Ksp=
(3)为防止指示剂失效,溶液应维持
(4)当加入15.00mLNH4SCN溶液时,悬浊液中生成少量的Ag2SO4,则此时溶液中c(
 )=
)=(5)滴定终点,再加入10mL0.005mol·L-1的Na2CO3溶液,
您最近一年使用:0次
名校
解题方法
8 . 测定溶液中Cl-的浓度时,常用标准AgNO3溶液滴定,K2CrO4作指示剂。根据如下关于AgCl、Ag2CrO4的溶度积图,判断下列说法正确 的是
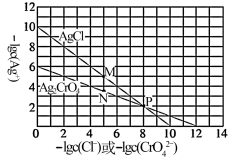

| A.P点时,二者的溶度积常数相同 |
| B.M点时,对AgCl溶液而言为饱和状态,对Ag2CrO4溶液而言为过饱和状态 |
C.向c(Cl-)=c( )=1×10-2mol·L-1的混合溶液中逐滴滴加1×10-3mol·L-1AgNO3溶液,振荡,先产生AgCl沉淀,当溶液中c(Cl-)降至1×10-5mol·L-1时,c( )=1×10-2mol·L-1的混合溶液中逐滴滴加1×10-3mol·L-1AgNO3溶液,振荡,先产生AgCl沉淀,当溶液中c(Cl-)降至1×10-5mol·L-1时,c( )=1×10-3.5mol·L-1 )=1×10-3.5mol·L-1 |
| D.当Cl-按化学计量比完全反应后,过量的一滴AgNO3溶液与K2CrO4反应沉淀颜色有明显变化。 |
您最近一年使用:0次
2021-05-28更新
|
1305次组卷
|
7卷引用:河南省实验中学2021届高三5月第四次模拟考试理综化学试题
河南省实验中学2021届高三5月第四次模拟考试理综化学试题(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)内蒙古赤峰二中2021-2022学年高三上学期第一次月考化学试题湖南省永州市第四中学2022届高三第三次调研考试化学试题(已下线)专题11 水溶液中的离子反应与平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)题型40 沉淀滴定—直接滴定法、莫尔法第三章 章末训练
名校
解题方法
9 . 根据下列图示,相应叙述正确的是
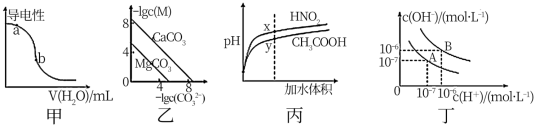

| A.图甲表示一定温度下,CH3COOH稀溶液加水时溶液导电性变化,a点pH值大于b点 |
| B.图乙表示一定温度下,MCO3(M:Mg2+、Ca2+)的沉淀溶解平衡曲线,则Ksp(MgCO3)<Ksp(CaCO3) |
| C.图丙是稀释相同体积、相同pH的HNO2和CH3COOH稀溶液时,溶液的pH随加水体积的变化,所含溶质的物质的量浓度x点小于y点 |
| D.图丁中,曲线B对应温度下,将0.02mol·L-1Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,混合溶液的pH=12 |
您最近一年使用:0次
2021-05-03更新
|
428次组卷
|
3卷引用:江苏省扬州市邗江中学2020-2021学年高二下学期期中考试化学试题
江苏省扬州市邗江中学2020-2021学年高二下学期期中考试化学试题江苏省扬州市江都区大桥高级中学2020-2021学年高二5月学情调研化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)
10 . 某温度下,分别向10mL浓度均为0.1mol·L-1的CuCl2和ZnCl2溶液中滴加0.1mol·L-1的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)和-lgc(Zn2+)与Na2S溶液体积(V)的关系如图所示。[已知:Ksp(ZnS)>Ksp(CuS), 1g3≈0.5],下列说法正确的是
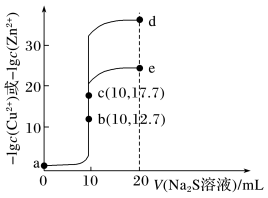

| A.a点的ZnCl2溶液中:c(Cl-)<2[c(Zn2+)+c(H+)] |
| B.由图象可以计算得出该温度下Ksp(ZnS)=10-35.4 |
| C.a—b—e为滴定CuCl2溶液的曲线 |
| D.d点纵坐标约为33.9 |
您最近一年使用:0次



