新疆乌鲁木齐地区2021-2022学年高三下学期第一次质量监测化学试题
新疆
高三
阶段练习
2022-03-03
260次
整体难度:
容易
考查范围:
认识化学科学、化学与STSE、常见无机物及其应用、有机化学基础、物质结构与性质、化学反应原理、化学实验基础
新疆乌鲁木齐地区2021-2022学年高三下学期第一次质量监测化学试题
新疆
高三
阶段练习
2022-03-03
260次
整体难度:
容易
考查范围:
认识化学科学、化学与STSE、常见无机物及其应用、有机化学基础、物质结构与性质、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
容易(0.94)
解题方法
1. 冬季的乌鲁木齐特别适宜开展冰雪运动,冰雪运动场地需要大量的人造冰雪。将过冷水和压缩空气喷出可产生人造冰雪。下列说法错误的是
| A.冰和雪从化学角度看是同种物质,化学性质相同 |
| B.滑冰项目所用的滑冰鞋制造时需要使用有机材料和金属材料 |
| C.运动场馆的建设当中要使用大量的水泥,水泥中含有Na、Si、O等元素 |
| D.人造冰雪的制造过程主要发生化学变化 |
您最近一年使用:0次
单选题
|
容易(0.94)
2. 下列化学用语正确的是
A.原子核内有8个中子的碳原子: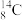 |
B.18O结构示意图: |
| C.N2的结构式: N-N |
D.溴乙烷分子比例模型: |
您最近一年使用:0次
单选题
|
适中(0.65)
3. 下列过程涉及氧化还原反应的是
| A.工业上用SO3与水反应制备硫酸 |
| B.用CO2人工合成淀粉[化学式: (C6H10O5)n ] |
| C.蒸馒头时用Na2CO3中和面粉发酵过程中产生的酸 |
| D.制糖工业用活性炭使糖浆脱色 |
【知识点】 氧化还原反应定义、本质及特征解读
您最近一年使用:0次
单选题
|
适中(0.65)
4. 设N0是阿伏加德罗常数的值。下列说法正确的是
| A.lmol·L-1 CuCl2溶液中含Cl- 数目为2 N0 |
| B.标准状况下,2.24L NH3中含有的电子数为1.8 N0 |
| C.过氧化钠与水反应,生成0.1mol氧气转移的电子数为0.1 N0 |
| D.0.05mol由乙烷和乙烯组成的混合气体完全燃烧,生成CO2的分子个数为0.1 N0 |
您最近一年使用:0次
单选题
|
较易(0.85)
5. 关于有机反应类型,下列判断错误的是
| A.C6H12O6→2C2H5OH + 2CO2↑(水解反应) |
B. +Br2 +Br2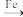  +HBr(取代反应) +HBr(取代反应) |
C.CH2 = CH2 + CH3COOH  CH3COOCH2CH3(加成反应) CH3COOCH2CH3(加成反应) |
D.CH3CHO+H2 CH3CH2OH (还原反应) CH3CH2OH (还原反应) |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
6. 下列实验操作、现象与结论均正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 用无锈铁丝蘸取待测液做焰色反应 | 火焰呈紫色(透过蓝色钴玻璃) | 待测液中一定含有钾盐 |
| B | 向品红溶液中通入某气体 | 品红溶液褪色 | 该气体一定是SO2 |
| C | 向蛋白质溶液中滴加饱和CuSO4溶液 | 有固体析出 | 蛋白质发生盐析 |
| D | 向酸性KMnO4溶液中加入Fe3O4 | 紫色褪去 | Fe3O4含有Fe(II) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
7. X、Y、Z、W四种短周期主族元素,原子序数依次增大。X元素原子的最外层电子数是其内层电子数的2倍,Y的原子序数等于W元素原子的最外层电子数,Z为短周期原子半径最大的元素,W元素的简单氢化物在水中完全电离。下列说法正确的是
| A.Y单质的氧化性比W单质的氧化性强 |
| B.四种元素的单质熔点最高的是Z单质 |
| C.X的简单氢化物可与W的单质反应生成五种化合物 |
| D.Y的最高价氧化物对应的水化物可以与锌反应产生氢气 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
8. 观察下表,空格中有机物的化学式及其一氯代物异构体的数目分别是
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 分子式 | CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A.C5H12 8种 | B.C5H10 5种 | C.C5H12 3种 | D.C6H10 8种 |
【知识点】 同分异构体的数目的确定解读
您最近一年使用:0次
单选题
|
较易(0.85)
9. CO与H2在某种催化剂作用下合成CH3OH的反应机理如图(吸附在催化剂表面的物种用*标记)。下列说法正确的是( N0代表阿伏加德罗常数的值)


| A.由图可知CO(g)+2H2(g)=CH3OH(g) ΔH=1.0N0eV/mol |
| B.该反应历程中决速步骤的活化能为1.2eV |
C.虚线框内的反应为CH3O*+ H2(g)=CH3OH* H2(g)=CH3OH* |
| D.温度一定时,使用催化剂能加快反应速率,同时提高CO的平衡转化率 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
10. 下列离子方程式正确的是
| A.生活中用食醋除水垢:CaCO3+2H+=Ca2++CO2↑+H2O |
| B.用FeS沉淀工业废水中的Cu2+:FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq) |
C.用热碱液洗涤油污:CO +2H2O +2H2O H2CO3+2OH- H2CO3+2OH- |
| D.稀盐酸除铁锈:Fe(OH)3+3H+=Fe3++3H2O |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
11. 下列气体的制备方案有错误的是


| 气体 | 试剂 | 制备装置 | 收集方法 | |
| A | Cl2 | KMnO4+浓盐酸 | b | c |
| B | H2 | Zn+稀H2SO4 | b | e |
| C | NO | Cu+稀HNO3 | b | c |
| D | NH3 | Ca(OH)2+NH4Cl | a | d |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-02更新
|
352次组卷
|
4卷引用:新疆乌鲁木齐地区2021-2022学年高三下学期第一次质量监测化学试题
单选题
|
较易(0.85)
解题方法
12. 部分含硅物质的分类与相应化合价关系如下图所示。下列推断合理的


| A.b在常温常压下一定是固体 |
| B.可将CO2通入e的水溶液中制得d的胶体 |
| C.T业上用木炭做还原剂将c转化为a过程中,产生大量的CO2 |
| D.可存在a→c→d→e的直接转化关系 |
您最近一年使用:0次
2021-12-24更新
|
249次组卷
|
2卷引用:广东省高考研究会高考测评研究院2021-2022学年高三上学期阶段性学习效率检测调研卷化学试题
单选题
|
适中(0.65)
13. 二氧化碳(CO2)的捕获和储存对于应对全球气候变化的巨大挑战具有重要意义。下图以CO2为动力源,HCOOH为放电产物的水基锂-二氧化碳新型电池,工作原理如图,下列说法正确的是


| A.放电时,CO2发生还原反应 |
| B.电子从Li电极流出,经过溶液流回锂电极 |
| C.吸收CO2的一极为负极 |
| D.充电时,阳极电极反应式:HCOOH-2e-+2OH-=CO2↑+2H2O |
您最近一年使用:0次
单选题
|
较难(0.4)
名校
解题方法
14. 常温下,向20 mL 0.1 mol·L-1Na2CO3溶液中滴加0.1 mol·L-1 CaCl2溶液,碳酸根离子浓度与氯化钙溶液体积的关系如图所示。已知:pC=-lg c(CO ),Ksp(CdCO3)=1.0×10-12,Ksp(CaCO3)=3.6×10-9.下列说法正确的是
),Ksp(CdCO3)=1.0×10-12,Ksp(CaCO3)=3.6×10-9.下列说法正确的是

 ),Ksp(CdCO3)=1.0×10-12,Ksp(CaCO3)=3.6×10-9.下列说法正确的是
),Ksp(CdCO3)=1.0×10-12,Ksp(CaCO3)=3.6×10-9.下列说法正确的是
| A.图象中V0=20,m=5 |
B.a点溶液:c(OH-)>2c(HCO )+2c(H2CO3) )+2c(H2CO3) |
| C.若Na2CO3溶液的浓度变为0.05 mol·L-1,则n点向c点方向迁移 |
| D.若用CdCl2溶液替代CaCl2溶液,则n点向b点方向迁移 |
您最近一年使用:0次
2021-07-02更新
|
861次组卷
|
2卷引用:四川省成都七中(高新校区)2020-2021学年高二下学期期末零诊模拟化学试题
二、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
15. 化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下方程式分解:2Mg5Al3(OH)19(H2O)4 27H2O+10MgO+3Al2O3
27H2O+10MgO+3Al2O3
(1)写出Al在周期表中的位置_______ ,铝、镁、氧三种元素的离子半径由大到小的顺序为_______ (填写离子符号)。
(2)该化合物作阻燃剂的两条依据是_______ 、_______ 。
(3)写出Al2O3中阴离子的电子式_______ ,用离子方程式表示除去固体产物中Al2O3的原理_______ 。
(4)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理_______ 。
(5)在25℃、101kPa下,已知12g的Mg在O2中完全燃烧后恢复至原状态,放热302.4kJ,该反应的热化学方程式是_______ 。
 27H2O+10MgO+3Al2O3
27H2O+10MgO+3Al2O3(1)写出Al在周期表中的位置
(2)该化合物作阻燃剂的两条依据是
(3)写出Al2O3中阴离子的电子式
(4)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理
(5)在25℃、101kPa下,已知12g的Mg在O2中完全燃烧后恢复至原状态,放热302.4kJ,该反应的热化学方程式是
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
适中(0.65)
16. 工业上常用电解精制饱和食盐水的方法制取氢氧化钠、氢气、氯气等化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。

(1)写出电解饱和食盐水的离子方程式_______ 。试预测离子交换膜法电解食盐水中离子交换膜可能的作用_______ 、_______ 。
(2)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。NaClO2就是一种高效氧化剂和优质漂白剂。
①NaClO2中Cl元素的化合价为_______ ;NaClO2溶液呈碱性,原因是_______ (用离子方程式表示)。
②NaClO2在溶液中可生成ClO2、HClO2、ClO 、Cl-等,其中ClO2、HClO2都具有漂白和消毒作用,但ClO2是有毒气体。25°C时,各组分浓度随pH变化情况如图所示(Cl-未画)。HClO2的电离平衡常数Ka=
、Cl-等,其中ClO2、HClO2都具有漂白和消毒作用,但ClO2是有毒气体。25°C时,各组分浓度随pH变化情况如图所示(Cl-未画)。HClO2的电离平衡常数Ka=_______ ,使用该漂白剂的最佳pH为_______ (选填“3”“5”或“7”)。

③完成并配平NaClO2在溶液中生成ClO2的离子方程式:_______ 。
_______ClO +_______→_______Cl-+________ClO2+_______H2O
+_______→_______Cl-+________ClO2+_______H2O
其中氧化剂与还原剂的物质的量之比为_______ 。

(1)写出电解饱和食盐水的离子方程式
(2)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。NaClO2就是一种高效氧化剂和优质漂白剂。
①NaClO2中Cl元素的化合价为
②NaClO2在溶液中可生成ClO2、HClO2、ClO
 、Cl-等,其中ClO2、HClO2都具有漂白和消毒作用,但ClO2是有毒气体。25°C时,各组分浓度随pH变化情况如图所示(Cl-未画)。HClO2的电离平衡常数Ka=
、Cl-等,其中ClO2、HClO2都具有漂白和消毒作用,但ClO2是有毒气体。25°C时,各组分浓度随pH变化情况如图所示(Cl-未画)。HClO2的电离平衡常数Ka=
③完成并配平NaClO2在溶液中生成ClO2的离子方程式:
_______ClO
 +_______→_______Cl-+________ClO2+_______H2O
+_______→_______Cl-+________ClO2+_______H2O其中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
17. 次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O,M=154.0g/mol)俗称吊白块,不稳定,120°C时会分解。在印染、医药以及原子能工业中有广泛应用。实验室制备吊白块的方案如下:
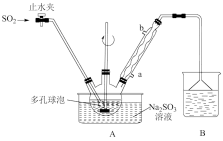
[NaHSO3的制备]
(1)如图,在A中加入一定量Na2SO3溶液,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
①A中多孔球泡的作用是_______ ,B中溶液是_______
②冷凝管中冷却水从_______ (填“a”或“b”)口进。
③写出A中发生反应的化学方程式_______ 。
[吊白块的制备]
(2)如图,向仪器C中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80-90°C下,反应约3h,过滤,浓缩,结晶制得吊白块。
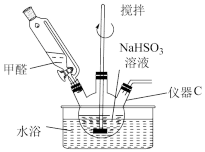
①仪器C的名称为_______ 。
②用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是_______ 。
③将仪器C中的反应温度恒定在80-90°C的目的是_______ 。
[吊白块纯度的测定]
(3)将0.8000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100°C水蒸气;吊白块分解并释放出甲醛,用含60.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO +5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4再重复实验2次,平均消耗草酸溶液的体积为50.00mL。
+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4再重复实验2次,平均消耗草酸溶液的体积为50.00mL。
①滴定终点的判断方法是_______ 。
②产品的纯度为_______ (精确到0.01%)。
③下列操作会导致测定的纯度偏高的是_______ 。
A.KMnO4标准溶液久置释放出O2而变质
B.滴定前尖嘴处有气泡,滴定后无气泡
C.起始读数正确,滴定后俯视读数
D.滴定时当溶液由紫红色变成无色时立即读数,半分钟后又变回紫红色

[NaHSO3的制备]
(1)如图,在A中加入一定量Na2SO3溶液,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
①A中多孔球泡的作用是
②冷凝管中冷却水从
③写出A中发生反应的化学方程式
[吊白块的制备]
(2)如图,向仪器C中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80-90°C下,反应约3h,过滤,浓缩,结晶制得吊白块。

①仪器C的名称为
②用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是
③将仪器C中的反应温度恒定在80-90°C的目的是
[吊白块纯度的测定]
(3)将0.8000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100°C水蒸气;吊白块分解并释放出甲醛,用含60.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO
 +5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4再重复实验2次,平均消耗草酸溶液的体积为50.00mL。
+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4再重复实验2次,平均消耗草酸溶液的体积为50.00mL。①滴定终点的判断方法是
②产品的纯度为
③下列操作会导致测定的纯度偏高的是
A.KMnO4标准溶液久置释放出O2而变质
B.滴定前尖嘴处有气泡,滴定后无气泡
C.起始读数正确,滴定后俯视读数
D.滴定时当溶液由紫红色变成无色时立即读数,半分钟后又变回紫红色
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
18. 氮氧化物气体是造成光化学污染的主要气体,降低氮氧化物气体的排放是环境保护的重要课题。
(1)氮氧化物间可以相互转化。已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步,第一步:2NO(g)
2NO2(g)的反应历程分两步,第一步:2NO(g) N2O2(g)(快),第二步:N2O2(g)+O2(g)
N2O2(g)(快),第二步:N2O2(g)+O2(g) 2NO2(g)(慢),比较第一步反应的活化能E1与第二步反应的活化能E2大小:E1
2NO2(g)(慢),比较第一步反应的活化能E1与第二步反应的活化能E2大小:E1_______ E2(填“<”“>”或“=”)。
(2)已知:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746.5kJ·mol-1,恒温、恒容条件下,将2.0molNO和1.0molCO充入一个容积为2L的密闭容器中进行上述反应,反应过程中部分物质的物质的量变化如图所示。
N2(g)+2CO2(g) ΔH=-746.5kJ·mol-1,恒温、恒容条件下,将2.0molNO和1.0molCO充入一个容积为2L的密闭容器中进行上述反应,反应过程中部分物质的物质的量变化如图所示。

0-9min内N2的平均反应速率v(N2)=_______ mol·L-1·min-1;第12min时CO2的浓度为_______ mol·L-1;第12min时改变的反应条件可能为_______ (填字母代号)
a.升高温度 b.加入NO c.加催化剂 d.减小压强 e.降低温度
(3)T°C时,存在如下平衡:2NO2(g) N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~1gc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~1gc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。

①T°C时,该反应的平衡常数K=_______ 。
②T°C时,往刚性容器中充入一定量NO2,平衡后测得c(N2O4)为1.0mol·L-1,则平衡时NO2的物质的量分数为_______ (以分数表示)。平衡后v正=________ mol·L-1·min-1(用含a的表达式表示)。
(4)利用反应NO2+NH3→N2+H2O(未配平)制作如图所示的电池,用以消除氮氧化物的污染。电池工作时,OH-移向_______ 电极(填“甲”或“乙”),写出负极电极反应式:_______ 。

(1)氮氧化物间可以相互转化。已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步,第一步:2NO(g)
2NO2(g)的反应历程分两步,第一步:2NO(g) N2O2(g)(快),第二步:N2O2(g)+O2(g)
N2O2(g)(快),第二步:N2O2(g)+O2(g) 2NO2(g)(慢),比较第一步反应的活化能E1与第二步反应的活化能E2大小:E1
2NO2(g)(慢),比较第一步反应的活化能E1与第二步反应的活化能E2大小:E1(2)已知:2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH=-746.5kJ·mol-1,恒温、恒容条件下,将2.0molNO和1.0molCO充入一个容积为2L的密闭容器中进行上述反应,反应过程中部分物质的物质的量变化如图所示。
N2(g)+2CO2(g) ΔH=-746.5kJ·mol-1,恒温、恒容条件下,将2.0molNO和1.0molCO充入一个容积为2L的密闭容器中进行上述反应,反应过程中部分物质的物质的量变化如图所示。
0-9min内N2的平均反应速率v(N2)=
a.升高温度 b.加入NO c.加催化剂 d.减小压强 e.降低温度
(3)T°C时,存在如下平衡:2NO2(g)
 N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~1gc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~1gc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
①T°C时,该反应的平衡常数K=
②T°C时,往刚性容器中充入一定量NO2,平衡后测得c(N2O4)为1.0mol·L-1,则平衡时NO2的物质的量分数为
(4)利用反应NO2+NH3→N2+H2O(未配平)制作如图所示的电池,用以消除氮氧化物的污染。电池工作时,OH-移向

您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
19. 用黄铁矿(主要成分FeS2)还原硫酸渣制备铁黄颜料(主要成分为FeOOH),工业流程如下:
+
c(Fe2+)或c(Fe3+)浓度分别为1mol·L-1,形成对应沉淀的pH范围如下表:
(1)从物质分类的角度,FeOOH属于_______ 。
(2)步骤②被氧化的元素是_______ (填写元素符号)。
(3)制备晶种:为制备高品质铁黄产品,需先制备少量铁黄晶种。实验时,将NaOH按一定计量比加入到FeSO4溶液中,混合溶液的pH随时间变化关系如图所示。搅拌混合均匀,0-15分钟时段,溶液pH明显降低,请用离子方程式解释原因:_______ 。在晶种制备阶段,晶种液未出现红褐色沉淀。pH约为6时,铁元素存在的主要形式为_______ (填写化学符号),此时通入空气,15~80分钟时段,pH基本不变,结合方程式解释原因_______ 。
+
pH为4.5~5时制得铁黄晶种。
(4)二次氧化时,溶液的pH应控制到3~4,过低会造成铁黄质量降低,原因可能是_______ 。
(5)步骤④中检验洗涤是否完全的方法是_______ 。
(6)铁黄的化学式还可以写成Fe2O3·xH2O。为了测定铁黄中结晶水的含量,用分析天平准确称量m1g样品置于坩埚中加热,冷却;经反复操作,当样品恒重时称得质量为m2g,则x=_______ (用含m1、m2的表达式表示)。
+

c(Fe2+)或c(Fe3+)浓度分别为1mol·L-1,形成对应沉淀的pH范围如下表:
| Fe(OH)2 | FeOOH | |
| 开始沉淀的pH | 5.8 | 1.2 |
| 沉淀完全的pH | 8.3 | 2.8 |
(1)从物质分类的角度,FeOOH属于
(2)步骤②被氧化的元素是
(3)制备晶种:为制备高品质铁黄产品,需先制备少量铁黄晶种。实验时,将NaOH按一定计量比加入到FeSO4溶液中,混合溶液的pH随时间变化关系如图所示。搅拌混合均匀,0-15分钟时段,溶液pH明显降低,请用离子方程式解释原因:
+

pH为4.5~5时制得铁黄晶种。
(4)二次氧化时,溶液的pH应控制到3~4,过低会造成铁黄质量降低,原因可能是
(5)步骤④中检验洗涤是否完全的方法是
(6)铁黄的化学式还可以写成Fe2O3·xH2O。为了测定铁黄中结晶水的含量,用分析天平准确称量m1g样品置于坩埚中加热,冷却;经反复操作,当样品恒重时称得质量为m2g,则x=
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:认识化学科学、化学与STSE、常见无机物及其应用、有机化学基础、物质结构与性质、化学反应原理、化学实验基础
试卷题型(共 19题)
题型
数量
单选题
14
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 物理变化与化学变化 高分子材料 金属与合金性能比较 水泥 | |
| 2 | 0.94 | 有关粒子结构的化学用语 原子结构示意图、离子结构示意图 有机物的结构式、结构简式、比例模型、球棍模型、最简式 溴乙烷的组成、结构 | |
| 3 | 0.65 | 氧化还原反应定义、本质及特征 | |
| 4 | 0.65 | 阿伏加德罗常数的求算 22.4L/mol适用条件 过氧化钠与水的反应 乙烯燃烧 | |
| 5 | 0.85 | 取代反应 加成反应 苯的取代反应 乙醛的加成反应 | |
| 6 | 0.65 | 二氧化硫的漂白性 焰色试验 Fe2+的鉴别及其应用 蛋白质的变性 | |
| 7 | 0.65 | 甲烷与氯气反应的四种产物结构、性质及用途 根据原子结构进行元素种类推断 晶体的类型与物质熔点、硬度、导电性的关系 | |
| 8 | 0.65 | 同分异构体的数目的确定 | |
| 9 | 0.85 | 碰撞理论及活化能 活化能及其对反应速率的影响 催化剂对化学反应速率的影响 | |
| 10 | 0.65 | 离子方程式的正误判断 几种铁的氧化物的化学性质 盐类水解在生活、生产中的应用 沉淀的溶解与生成 | |
| 11 | 0.85 | 氯气的实验室制法 氨气的实验室制法 常见气体的制备与收集 化学实验方案的设计与评价 | |
| 12 | 0.85 | 硅的制备 二氧化硅的化学性质 硅酸的制备 硅酸钠与二氧化碳反应 | |
| 13 | 0.65 | 原电池电子流向判断及应用 原电池原理的综合应用 电解池电极反应式及化学方程式的书写与判断 | |
| 14 | 0.4 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 溶度积规则及其应用 | |
| 二、解答题 | |||
| 15 | 0.65 | 共价型分子结构式、电子式 离子方程式的书写 热化学方程式 元素周期表提供的元素信息 | 原理综合题 |
| 17 | 0.65 | 酸碱中和滴定原理的应用 酸碱中和滴定的误差分析 探究物质组成或测量物质的含量 综合实验设计与评价 | 实验探究题 |
| 18 | 0.65 | 活化能及其对反应速率的影响 浓度对化学平衡移动的影响 化学平衡常数的有关计算 原电池电极反应式书写 | 原理综合题 |
| 19 | 0.65 | 氧化还原反应的规律 有关铁及其化合物转化的流程题型 探究物质组成或测量物质的含量 | 工业流程题 |
| 三、填空题 | |||
| 16 | 0.65 | 氧化还原反应方程式的配平 盐溶液的酸碱性判断 氯碱工业 弱电解质的电离平衡常数 | |



