2020高三·全国·专题练习
解题方法
1 . 已知C60分子结构和C60晶胞示意图(如图1、图2所示):
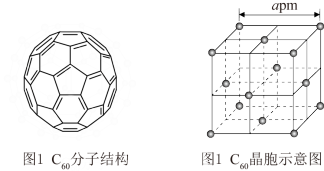
则一个C60分子中含有σ键的个数为___________ ,C60晶体密度的计算式为___________ g·cm-3.(NA为阿伏加德罗常数的值)

则一个C60分子中含有σ键的个数为
您最近半年使用:0次
名校
解题方法
2 . 已知钼(Mo)的晶胞如图所示,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏加 德罗常数的值。
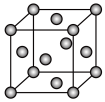
(1)钼晶体的堆积方式为_______________ ,晶体中粒子的配位数为________________ 。
(2)构成钼晶体的粒子是__________________ ,晶胞中所含的粒子数为___________ 。
(3)金属钼的密度为______________ g·cm-3。

(1)钼晶体的堆积方式为
(2)构成钼晶体的粒子是
(3)金属钼的密度为
您最近半年使用:0次
2020-09-07更新
|
775次组卷
|
5卷引用:宁夏银川市长庆高级中学2019-2020学年高二下学期期中考试化学试题
宁夏银川市长庆高级中学2019-2020学年高二下学期期中考试化学试题新疆昌吉回族自治州呼图壁县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)第03章 不同聚集状态的物质与性质(A卷基础强化篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)吉林省长春市第二十九中学2020-2021学年高二下学期第一学程考试化学试题江西省九江市柴桑区第一中学2020-2021学年高二下学期5月月考化学试题
3 . 如图所示是金属钠的晶胞示意图,该晶胞平均含有的钠原子数是( )


| A.9 | B.5 | C.3 | D.2 |
您最近半年使用:0次
2020-06-23更新
|
199次组卷
|
4卷引用:辽宁省锦州市黑山县黑山中学2019-2020学年高二6月月考化学试题
4 . 有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是
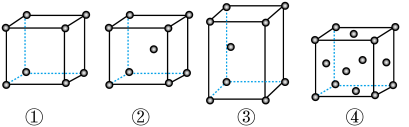

| A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积 |
| B.每个晶胞都是规则排列的 |
| C.晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| D.空间利用率的大小关系为:①<②<③<④ |
您最近半年使用:0次
2020-06-11更新
|
241次组卷
|
3卷引用:四川省武胜烈面中学校2019-2020学年高二下学期期中考试化学试题
5 . 工业上生产铬单质涉及的反应如下:
Na2Cr2O7+2C Cr2O3+Na2CO3+CO↑
Cr2O3+Na2CO3+CO↑
Cr2O3+2Al 2Cr+Al2O3
2Cr+Al2O3
(1) Cr基态原子的核外电子排布式为________ 。
(2) Na、O、C的第一电离能从大到小的顺序为________ 。
(3) 与CO 互为等电子体的一种分子为
互为等电子体的一种分子为________ (填化学式)。
(4) Cr2O3具有两性,溶于NaOH溶液形成配合物Na[Cr(OH)4]。
Na[Cr(OH)4]中配体的化学式为____________ ,1 mol该配合物中含σ键数目为_________ 。
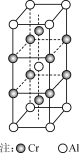
(5) 合金CrAl晶体的晶胞如右图所示,写出该合金的化学式:________ 。
Na2Cr2O7+2C
 Cr2O3+Na2CO3+CO↑
Cr2O3+Na2CO3+CO↑Cr2O3+2Al
 2Cr+Al2O3
2Cr+Al2O3(1) Cr基态原子的核外电子排布式为

(2) Na、O、C的第一电离能从大到小的顺序为
(3) 与CO
 互为等电子体的一种分子为
互为等电子体的一种分子为(4) Cr2O3具有两性,溶于NaOH溶液形成配合物Na[Cr(OH)4]。
Na[Cr(OH)4]中配体的化学式为
(5) 合金CrAl晶体的晶胞如右图所示,写出该合金的化学式:
您最近半年使用:0次
2020-05-21更新
|
413次组卷
|
2卷引用:江苏省泰州市2020届高三第二次模拟考试(5月) 化学试题
解题方法
6 . 钙、钛、氧可形成如图所示的晶胞,则所形成的物质的化学式可表示为( )
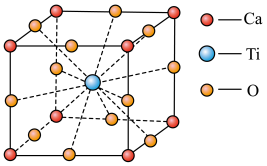

| A.Ca8TiO12 | B.Ca4TiO6 | C.Ca4TiO3 | D.CaTiO3 |
您最近半年使用:0次
7 . 已知某金属晶体的晶胞结构如图所示,则在该晶体中所含金属原子的配位数为


| A.6 | B.8 | C.10 | D.12 |
您最近半年使用:0次
2020-04-11更新
|
316次组卷
|
3卷引用:课时1 金属晶体——A学习区 夯实基础(鲁科版选修3)
8 . 金属原子在二维平面里放置有如图所示的两种方式,下列说法正确的是
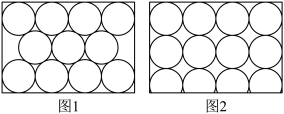

| A.图1为非密置层,配位数为6 |
| B.图2为密置层,配位数为4 |
| C.图1在三维空间里堆积可得A3型和A1型两种堆积模型 |
| D.图2在三维空间里堆积可得A3型堆积模型 |
您最近半年使用:0次
2020-04-11更新
|
236次组卷
|
2卷引用:课时1 金属晶体——A学习区 夯实基础(鲁科版选修3)
名校
解题方法
9 . 硅及其化合物在材料领域中应用广泛。回答下列问题:
(1)硅单质有晶体硅和无定形硅两种,区别晶体硅和无定形硅的科学方法是___________
(2)基态硅的价电子排布式为_________ ,其核外电子的运动状态有_____ 种。
(3)CCl4和SiCl4常温下均呈液态,SiCl4熔沸点较高的原因为________ CCl4不水解,但SiCl4遇水即强烈水解,则SiCl4水解的化学方程式为__________ 。
(4)SiF4的热稳定性比SiCl4强的原因是____ 。
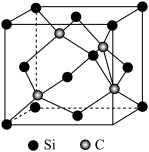
(5)碳化硅(SiC)的结构与金刚石类似,碳化硅的硬度仅次于金刚石,其晶胞结构如图所示。则Si原子的配位数为_______ ,若晶体的密度为ρg/cm3 ,阿伏加 德罗常数为NA,则距离最近的Si原子与C原子之间的距离为
,阿伏加 德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______________ cm。(用ρ和NA的式子表示) 
(1)硅单质有晶体硅和无定形硅两种,区别晶体硅和无定形硅的科学方法是
(2)基态硅的价电子排布式为
(3)CCl4和SiCl4常温下均呈液态,SiCl4熔沸点较高的原因为
(4)SiF4的热稳定性比SiCl4强的原因是
(5)碳化硅(SiC)的结构与金刚石类似,碳化硅的硬度仅次于金刚石,其晶胞结构如图所示。则Si原子的配位数为
 ,阿伏加 德罗常数为NA,则距离最近的Si原子与C原子之间的距离为
,阿伏加 德罗常数为NA,则距离最近的Si原子与C原子之间的距离为

您最近半年使用:0次
10 . 过渡金属元素在医药、催化剂、新材料等领域有着广泛的应用。回答下列问题:
(1)下列有关说法正确的是_____ 。
A.铜元素焰色反应的光谱为吸收光谱
B.金属键没有方向性和饱和性
C.基态铁原子核外未成对电子有4个
D.锌属于过渡元素,处于元素周期表的d区
(2)[Co(NH3)5Br](NO3)3是钻元素形成的一种配位化合物。
①该配位化合物中心离子的价电子排布式为___ ,中心离子的配位数为____ 。
②该配位化合物中含氮离子的中心原子的杂化类型为______ 。
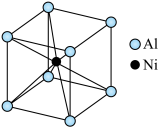
(3)①一种铝镍合金的结构如图,与其结构相似的化合物是_____ 。
a.氯化钠
b.氯化铯
c.石英
d.金刚石
②NiO、CoO的晶体结构均属于NaCl型(Ni2+和Co2+的半径分别为69pm和74pm),NiO的熔点比CoO高,其原因是____ 。
③已知CuO Cu2O+O2↑(未配平),试从结构的角度解释这一反应能够发生的原因
Cu2O+O2↑(未配平),试从结构的角度解释这一反应能够发生的原因_____ 。
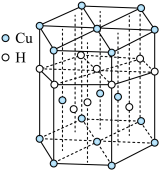
(4)Cu与H可形成一种红色晶体,其晶胞结构如图所示,则该化合物的化学式为____ ,一个晶胞的质量为_____ g(NA为阿伏加 德罗常数的值)。
(1)下列有关说法正确的是
A.铜元素焰色反应的光谱为吸收光谱
B.金属键没有方向性和饱和性
C.基态铁原子核外未成对电子有4个
D.锌属于过渡元素,处于元素周期表的d区
(2)[Co(NH3)5Br](NO3)3是钻元素形成的一种配位化合物。
①该配位化合物中心离子的价电子排布式为
②该配位化合物中含氮离子的中心原子的杂化类型为
(3)①一种铝镍合金的结构如图,与其结构相似的化合物是

a.氯化钠
b.氯化铯
c.石英
d.金刚石
②NiO、CoO的晶体结构均属于NaCl型(Ni2+和Co2+的半径分别为69pm和74pm),NiO的熔点比CoO高,其原因是
③已知CuO
 Cu2O+O2↑(未配平),试从结构的角度解释这一反应能够发生的原因
Cu2O+O2↑(未配平),试从结构的角度解释这一反应能够发生的原因(4)Cu与H可形成一种红色晶体,其晶胞结构如图所示,则该化合物的化学式为

您最近半年使用:0次
2019-10-19更新
|
410次组卷
|
2卷引用:山东省烟台市第一中学2020届高三上学期第一次月考化学试题



