1 . 、臭氧 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。
(1)基态铁原子有___________ 种空间运动状态不同的电子; 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间构型为
的空间构型为___________ (用文字描述); 为
为___________ 分子(填“极性”、“非极性”)。
(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因___________ 。
(3)硫单质的常见形式为 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有___________ 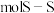 键。
键。 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为___________ 键。 结构属立方晶系,晶胞如图所示,
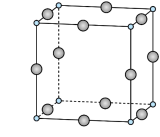
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。(1)基态铁原子有
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为 为
为(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因
(3)硫单质的常见形式为
 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有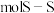 键。
键。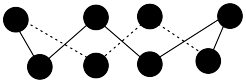
 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近半年使用:0次
名校
解题方法
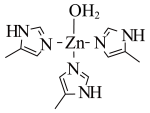
2 . 锌在工业中有重要作用,也是人体必须的微量元素。人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。碳酸酐酶的部分结构如图所示:
(1)Zn基态原子核外电子排布式_______ 。
(2)碳酸酐酶的部分结构中与Zn2+配位的原子是____ (填元素符号),该物质中碳原子的轨道杂化类型是_____ ,碳酸酐酶中H—O—H键角比H2O中H—O—H键角___ (填“大于”“小于”或“等于”)。
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第二电离能I2(Zn)_____ I2(Cu)(填“大于”或“小于”),原因是_____ 。
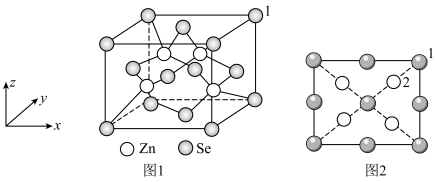
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图1所示。
①与 原子距离最近且等距离的
原子距离最近且等距离的 的个数为
的个数为_______ 。
②1号原子的坐标为 ,图2是
,图2是 晶胞沿z轴的投影图,2号原子的坐标为
晶胞沿z轴的投影图,2号原子的坐标为_______ 。
③晶胞中距离最近的两个Se的距离为a nm,设 为阿伏加德罗常数的值,该晶体密度为
为阿伏加德罗常数的值,该晶体密度为_______  。
。
(1)Zn基态原子核外电子排布式
(2)碳酸酐酶的部分结构中与Zn2+配位的原子是
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第二电离能I2(Zn)
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图1所示。
①与
 原子距离最近且等距离的
原子距离最近且等距离的 的个数为
的个数为②1号原子的坐标为
 ,图2是
,图2是 晶胞沿z轴的投影图,2号原子的坐标为
晶胞沿z轴的投影图,2号原子的坐标为③晶胞中距离最近的两个Se的距离为a nm,设
 为阿伏加德罗常数的值,该晶体密度为
为阿伏加德罗常数的值,该晶体密度为 。
。
您最近半年使用:0次
解题方法
3 . 铜及其化合物在生活、生产中用途广泛。以黄铜矿为原料冶炼铜涉及多个反应,其中一个反应为
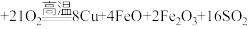 。回答下列问题:
。回答下列问题:
(1)基态铜原子的价层电子的轨道表示式(电子排布图)为______________ ,基态铜原子核外电子的空间运动状态(原子轨道)有__________ 种。
(2)高温下CuO能转化为 的原因是
的原因是_____________ (从原子结构角度分析)。
(3) 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是___________ ,属于极性分子的是___________ , 、
、 、
、 、
、 四种含硫微粒的空间结构分别为
四种含硫微粒的空间结构分别为____________ 、____________ 、____________ 、____________ 。
(4) 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是_______________ ,1360℃是__________ 的熔点。
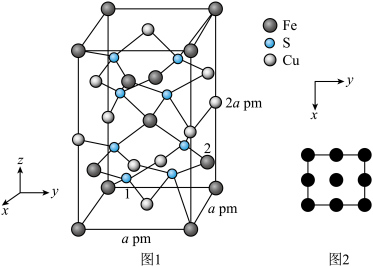
(5) 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为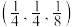 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为____________ 。晶胞参数分别为a pm,a pm、2a pm, 晶体的密度为
晶体的密度为___________  (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。

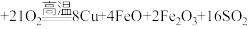 。回答下列问题:
。回答下列问题:(1)基态铜原子的价层电子的轨道表示式(电子排布图)为
(2)高温下CuO能转化为
 的原因是
的原因是(3)
 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是 、
、 、
、 、
、 四种含硫微粒的空间结构分别为
四种含硫微粒的空间结构分别为(4)
 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是(5)
 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为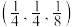 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为 晶体的密度为
晶体的密度为 (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
您最近半年使用:0次
名校
解题方法
4 . 硒化锌是一种重要的半导体材料,其立方晶胞结构如图甲所示,乙图为该晶胞沿z轴方向在xy平面的投影,已知晶胞边长为a pm,设阿伏加德罗常数的值为NA。下列说法不正确的是
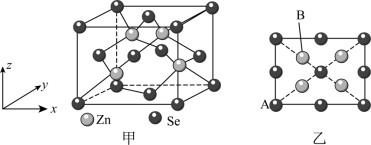
| A.Zn在周期表中的位置是第四周期ⅡB族 |
| B.该晶体的化学式为ZnSe |
| C.将Zn和Se的位置全部互换后所得晶体结构不变 |
| D.图中A点原子的坐标为(0,0,0),则B点原子的坐标为(0.75,0.25,0.75) |
您最近半年使用:0次
5 . Fe有δ、γ、α三种同素异形体,其晶胞结构如图所示:___________ 个。
(2)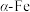 延展时,
延展时,___________ (填“可以”或“不可以”)转变为 。
。
(3)若δ—Fe晶体的晶胞边长为a cm, 表示阿伏加德罗常数的值,则δ—Fe单质的密度为
表示阿伏加德罗常数的值,则δ—Fe单质的密度为___________ 。

(2)
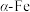 延展时,
延展时, 。
。(3)若δ—Fe晶体的晶胞边长为a cm,
 表示阿伏加德罗常数的值,则δ—Fe单质的密度为
表示阿伏加德罗常数的值,则δ—Fe单质的密度为
您最近半年使用:0次
名校
解题方法
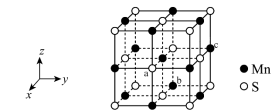
6 . 下图是MnS晶胞,其与NaCl晶胞属于同种类型。前者的熔点明显高于后者,其主要原因是___________ ;每个晶胞中平均分摊___________ 个S2-。
您最近半年使用:0次
名校
解题方法
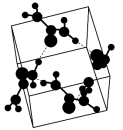
7 . 尿素晶体的晶胞如图所示。推测尿素晶体中存在的主要作用力为共价键和___________ 。每个尿素晶胞中含有___________ 个尿素分子。
您最近半年使用:0次
名校
解题方法
8 . 镓( )是非常重要的稀土金属,其化合物广泛应用于诸多领域。
)是非常重要的稀土金属,其化合物广泛应用于诸多领域。
(1)镓元素在元素周期表中的位置是___________ 。
(2)工业上利用炼锌矿渣[主要含可溶性铁酸镓 、铁酸锌
、铁酸锌 ]提取
]提取 。矿渣经“酸浸”后所得酸浸液含有
。矿渣经“酸浸”后所得酸浸液含有 、
、 、
、 等离子,经萃取富集其中的镓元素用于后续反应可制备氮化镓晶体。萃取工艺流程如下图所示。
等离子,经萃取富集其中的镓元素用于后续反应可制备氮化镓晶体。萃取工艺流程如下图所示。
①“酸浸”过程中 发生的反应的离子方程式为
发生的反应的离子方程式为___________ 。
②萃取剂水杨羟肟酸的结构简式如图1所示,萃取时分子中的 、
、 原子能与金属离子形成稳定的配位键。解释
原子能与金属离子形成稳定的配位键。解释 、
、 原子能作为配位原子的原因
原子能作为配位原子的原因___________ 。___________ (填试剂)充分反应后再进行萃取。
④“反萃取”后,溶液中镓元素的存在形式为___________ 。(填离子符号)
(3)氮化镓是非常重要的半导体材料,其立方晶胞如图2所示,与金刚石结构相似。 原子采用
原子采用___________ 杂化轨道成键。
②常压下,该晶体熔点为 ,其晶体类型为
,其晶体类型为___________ 。
③已知 晶体中距离最近的
晶体中距离最近的 原子间的核间距为
原子间的核间距为 ,
, 的摩尔质量为
的摩尔质量为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  。
。
 )是非常重要的稀土金属,其化合物广泛应用于诸多领域。
)是非常重要的稀土金属,其化合物广泛应用于诸多领域。(1)镓元素在元素周期表中的位置是
(2)工业上利用炼锌矿渣[主要含可溶性铁酸镓
 、铁酸锌
、铁酸锌 ]提取
]提取 。矿渣经“酸浸”后所得酸浸液含有
。矿渣经“酸浸”后所得酸浸液含有 、
、 、
、 等离子,经萃取富集其中的镓元素用于后续反应可制备氮化镓晶体。萃取工艺流程如下图所示。
等离子,经萃取富集其中的镓元素用于后续反应可制备氮化镓晶体。萃取工艺流程如下图所示。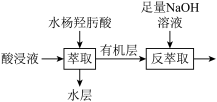
| 金属离子 |  |  |  |  |
| 萃取率/% | 0 | 0 | 99 | 97~98.5 |
 发生的反应的离子方程式为
发生的反应的离子方程式为②萃取剂水杨羟肟酸的结构简式如图1所示,萃取时分子中的
 、
、 原子能与金属离子形成稳定的配位键。解释
原子能与金属离子形成稳定的配位键。解释 、
、 原子能作为配位原子的原因
原子能作为配位原子的原因
④“反萃取”后,溶液中镓元素的存在形式为
(3)氮化镓是非常重要的半导体材料,其立方晶胞如图2所示,与金刚石结构相似。
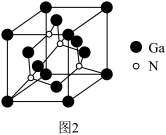
 原子采用
原子采用②常压下,该晶体熔点为
 ,其晶体类型为
,其晶体类型为③已知
 晶体中距离最近的
晶体中距离最近的 原子间的核间距为
原子间的核间距为 ,
, 的摩尔质量为
的摩尔质量为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 。
。
您最近半年使用:0次
解题方法
9 . 氮族元素包括氮(N)、磷(P)、砷( )、锑(
)、锑( )、铋(
)、铋( )和镆(
)和镆( )六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
)六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
(1) 基态原子核外电子排布式为
基态原子核外电子排布式为___________ , 基态原子核外有
基态原子核外有___________ 个未成对电子。
(2) 与同周期元素
与同周期元素 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3)氮气分子内存在氮氮三键,性质稳定,试从分子结构的角度解释P、 的单质化学性质比
的单质化学性质比 活泼的原因是
活泼的原因是___________ 。
(4) 离子中P的杂化类型为
离子中P的杂化类型为___________ , 分子的空间构型均为
分子的空间构型均为___________ ,其键角依次减小的原因是___________ 。
(5)氮和铜形成的一种二元化合物具有良好的电学和光学性能,其晶胞结构如图所示,则N的配位数为___________ ,该晶体密度为___________  (列出计算式,
(列出计算式, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。
 )、锑(
)、锑( )、铋(
)、铋( )和镆(
)和镆( )六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
)六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:(1)
 基态原子核外电子排布式为
基态原子核外电子排布式为 基态原子核外有
基态原子核外有(2)
 与同周期元素
与同周期元素 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)氮气分子内存在氮氮三键,性质稳定,试从分子结构的角度解释P、
 的单质化学性质比
的单质化学性质比 活泼的原因是
活泼的原因是(4)
 离子中P的杂化类型为
离子中P的杂化类型为 分子的空间构型均为
分子的空间构型均为(5)氮和铜形成的一种二元化合物具有良好的电学和光学性能,其晶胞结构如图所示,则N的配位数为
 (列出计算式,
(列出计算式, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。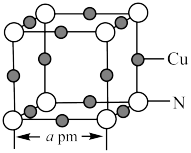
您最近半年使用:0次
2024-04-19更新
|
80次组卷
|
2卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
10 . LiF晶胞结构如图所示。
(2)LiF晶胞中,Li+位于F-围成的________空隙中。
(3)已知该晶胞棱长为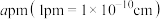 ,
, 表示阿伏加德罗常数,则LiF晶体的密度为
表示阿伏加德罗常数,则LiF晶体的密度为________ g·cm-3。
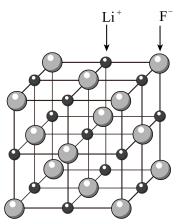
| A.氯化钠 | B.氟化钙 | C.金刚石 | D.二氧化碳 |
(2)LiF晶胞中,Li+位于F-围成的________空隙中。
| A.正四面体 | B.正八面体 |
| C.立方体 | D.平面正方形 |
(3)已知该晶胞棱长为
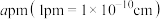 ,
, 表示阿伏加德罗常数,则LiF晶体的密度为
表示阿伏加德罗常数,则LiF晶体的密度为
您最近半年使用:0次



