名校
解题方法
1 . 铝及铝的化合物是当前用途十分广泛的、最经济适用的材料之一。回答下列问题:
(1)基态Al原子的核外电子排布式________ ;Al3+的最高能级电子云轮廓形状为________ ;铝的第一电离能低于镁的原因是________ 。
(2)氧炔焰的温度可以达到3200℃左右,用于焊接金属铝、不锈钢、铜等金属。乙炔中心C原子的轨道杂化类型为________ 。铝的熔点660℃、沸点2327℃,高于镁的熔点648℃、沸点1107℃,原因是________ 。
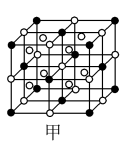
(3)冰晶石(Na3AlF6)是炼铝的助熔剂,由两种微粒构成,冰晶石的晶胞结构如下图所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心以及大立方体的体心,那么大立方体的●所代表的微粒是________ (填微粒符号)。________ ,配位数为________ 。若已知Al的原子半径为rnm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则Al晶体的密度为________ g/cm3(用字母表示)。
(1)基态Al原子的核外电子排布式
(2)氧炔焰的温度可以达到3200℃左右,用于焊接金属铝、不锈钢、铜等金属。乙炔中心C原子的轨道杂化类型为
(3)冰晶石(Na3AlF6)是炼铝的助熔剂,由两种微粒构成,冰晶石的晶胞结构如下图所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心以及大立方体的体心,那么大立方体的●所代表的微粒是

您最近半年使用:0次
2 . 某种离子型铁的氧化物晶胞如图所示,它由A、B两种正方体单元构成,且两种正方体单元中氧离子的空间位置相同。通过Li+嵌入或脱嵌该晶胞的棱心和体心,可将该晶体设计为纳米硅基锂电池的正极材料 (m、n为正整数)。已知:脱嵌率=
(m、n为正整数)。已知:脱嵌率=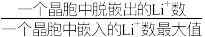 ×100%。
×100%。
 (m、n为正整数)。已知:脱嵌率=
(m、n为正整数)。已知:脱嵌率=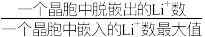 ×100%。
×100%。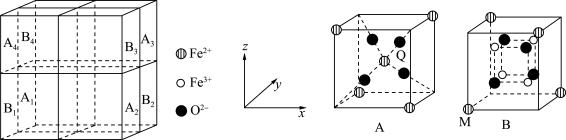
| A.当Li+嵌入晶胞体心和所有棱心,则该锂电池正极材料的化学式为LiFe6O8 |
| B.若该锂电池正极材料中n(Fe2+):n(Fe3+)=5:7则Li+的脱嵌率为75% |
C.该锂电池充电时正极发生的反应为 |
| D.该锂电池放电时,每转移2mol e-,正极材料增重14g |
您最近半年使用:0次
名校
解题方法
3 . NA为阿伏加德罗常数的值,下列有关说法正确的是
| A.42g C3H6所含的σ键数为9NA |
| B.1mol石墨中含有0.5NA个六元碳环 |
| C.NaHSO4晶体中阴阳离子的数目之和为2NA |
| D.标准状况下,2.24L CH4与2.24L Cl2发生反应,生成的气体分子数为0.2NA |
您最近半年使用:0次
名校
解题方法
4 . A、B、C、D、B、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍;B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的VIB族,F元素的基态原子中有4个未成对电子。
(1)A元素单质的结构式为___________ ;基态E元素原子价层电子排布图为____________ 。
(2)A的氢化物A2H4分子属于___________ 分子(填“极性或非极性);A与B形成的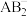 的空间构型为
的空间构型为___________ 。
(3)酸性条件下,E元素的离子 和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:
和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:___________________________________ 。
(4)元素C和D组成的简单化合物空间构型为________________ 。
(5)元素B与E形成的一种化合物广泛应用于录音磁带,其晶胞如图。若晶胞参数(边长)为apm,NA为阿伏加德罗常数的值,则该晶胞的密度为__________  。
。
(1)A元素单质的结构式为
(2)A的氢化物A2H4分子属于
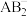 的空间构型为
的空间构型为(3)酸性条件下,E元素的离子
 和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:
和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:(4)元素C和D组成的简单化合物空间构型为
(5)元素B与E形成的一种化合物广泛应用于录音磁带,其晶胞如图。若晶胞参数(边长)为apm,NA为阿伏加德罗常数的值,则该晶胞的密度为
 。
。
您最近半年使用:0次
名校
解题方法
5 . 铜离子可与含N、含O的微粒形成多种结构。向CuSO4溶液中滴加氨水可最终形成如图所示的配离子。___________ 。关于该微粒说法正确的是___________ 。
A.1mol该微粒中有22mol共价键
B.该微粒中的N、O原子构成了立方体结构
C.电负性N>O>H
D.该微粒中可与溶剂水分子形成氢键的只有N、O原子
(2)铜元素位于元素周期表的___________ 区。铜原子价电子排布式 为___________ 。
A.s区 B.p区 C.ds区 D.f区
(3)Cu2+无法与BF3中的B原子形成配位键的原因是___________ 。
(4)Cu2+可形成如图所示晶体。该晶胞中负离子为 CN—,“连接”着每一对相邻的Fe3+与Cu2+(部分 示例位置已用箭头标出)。___________ 个。
②已知相邻的Fe3+与Cu2+核间距为apm,则相邻的Fe3+与K+核间距为___________ pm。
③该晶体的化学式为___________ 。

A.1mol该微粒中有22mol共价键
B.该微粒中的N、O原子构成了立方体结构
C.电负性N>O>H
D.该微粒中可与溶剂水分子形成氢键的只有N、O原子
(2)铜元素位于元素周期表的
A.s区 B.p区 C.ds区 D.f区
(3)Cu2+无法与BF3中的B原子形成配位键的原因是
(4)Cu2+可形成如图所示晶体。该晶胞中

②已知相邻的Fe3+与Cu2+核间距为apm,则相邻的Fe3+与K+核间距为
③该晶体的化学式为
您最近半年使用:0次
解题方法
6 . 氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
(1)基态F原子的核外电子排布式为___________ 。基态F原子的电子有___________ 种空间运动状态。
(2)氟氧化物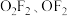 的结构已经确定。
的结构已经确定。
①依据上表数据推测 键的稳定性:
键的稳定性:
___________  (填“>”或“<”)。
(填“>”或“<”)。
② 中
中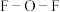 的键角小于
的键角小于 中
中 的键角,解释原因:
的键角,解释原因:___________ 。
(3) 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。
①已知:氢键 中三原子在一条直线上时,作用力最强。测定结果表明,
中三原子在一条直线上时,作用力最强。测定结果表明,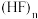 固体中
固体中 分子排列成锯齿形。画出含2个
分子排列成锯齿形。画出含2个 的重复单元结构:
的重复单元结构:___________ 。
② 中加入
中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:___________ 。
(4)工业上用蒬石(主要成分 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。 晶体中距离
晶体中距离 最近的
最近的 有
有___________ 个。
②晶体中 与
与 的最近距离为
的最近距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度
。该晶体的密度
___________  (列出计算式)。
(列出计算式)。
(1)基态F原子的核外电子排布式为
(2)氟氧化物
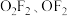 的结构已经确定。
的结构已经确定。 |  | |
 键长/pm 键长/pm | 121 | 148 |
 键的稳定性:
键的稳定性:
 (填“>”或“<”)。
(填“>”或“<”)。②
 中
中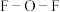 的键角小于
的键角小于 中
中 的键角,解释原因:
的键角,解释原因:(3)
 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。①已知:氢键
 中三原子在一条直线上时,作用力最强。测定结果表明,
中三原子在一条直线上时,作用力最强。测定结果表明,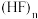 固体中
固体中 分子排列成锯齿形。画出含2个
分子排列成锯齿形。画出含2个 的重复单元结构:
的重复单元结构:②
 中加入
中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:(4)工业上用蒬石(主要成分
 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。
 晶体中距离
晶体中距离 最近的
最近的 有
有②晶体中
 与
与 的最近距离为
的最近距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度
。该晶体的密度
 (列出计算式)。
(列出计算式)。
您最近半年使用:0次
解题方法
7 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为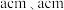 和
和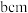 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为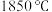 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
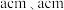 和
和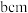 ,结构如下图所示。
,结构如下图所示。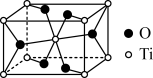
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
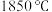 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近半年使用:0次
解题方法
8 . 钛铁基储氢合金是由钛、铁两种元素组成的金属间化合物。一种钛铁合金的晶胞如图ⅰ所示,该合金吸收的氢位于体心立方正八面体的中心,氢被4个钛原子和2个铁原子包围,如图ⅱ所示。不正确 的是

A.钛铁合金的化学式: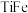 |
B.钛铁合金中每个 周围距离最近且等距的 周围距离最近且等距的 有8个 有8个 |
| C.钛铁合金与钛、铁的纯金属相比,熔点更低,硬度更大 |
D.如图ⅱ所示的每个体心立方正八面体均填充1个氢原子,则理论上形成的金属氢化物的化学式: |
您最近半年使用:0次
9 . 硒(Se,原子序数为34)在电子工业中可用作光电管、太阳能电池等。某工业提取过程将阳极泥(硒主要以Se单质和Cu2Se的形式存在)在空气中煅烧,可得铜、硒的氧化物,用二氧化硫还原SeO2可得硒。Cu2Se晶胞结构如图所示,下列说法错误的是
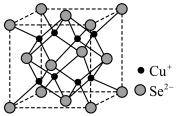
| A.Cu2Se晶胞中Se2-的配位数为8 |
| B.SeO2分子是直线形分子 |
| C.还原时,生成1molSe反应转移4mol电子 |
D.煅烧时,Cu2Se可能发生反应: |
您最近半年使用:0次
解题方法
10 . 科研工作者合成了低温超导化合物M,再利用低温去插层法,获得了一个新化合物N。二者的晶体结构如图所示,下列说法正确的是
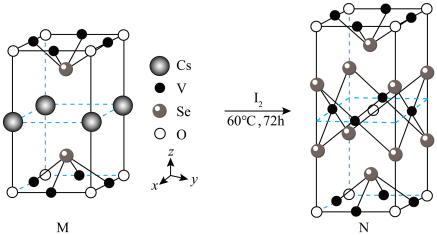
| A.去插层过程中Cs元素均转化为Cs单质 | B.N的化学式为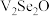 |
| C.M中与Cs原子最临近的Se原子有2个 | D.N中V原子填充了Se原子构成的正八面体空隙 |
您最近半年使用:0次



