1 .  被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为
被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为 ,含少量
,含少量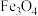 、
、 和
和 )为原料制备
)为原料制备 的流程如下:
的流程如下: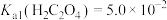 ,
,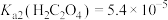 ,
, ;
;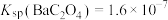 ,
,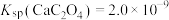 。
。
回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有_____ 种。
(2)浸渣的主要成分为_____ 和_____ (填化学式),“浸出”步骤中 与
与 溶液反应的原理为
溶液反应的原理为_____ (用离子方程式表示)。
(3)若浸出液中 ,
, ,“除钙”步骤中,当沉钙率为90%时,钡损率为
,“除钙”步骤中,当沉钙率为90%时,钡损率为_____ 。
(4)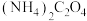 溶液显
溶液显_____ (填“酸”“碱”或“中”)性;“沉钛”步骤所得沉淀为 ,该步骤生成的能循环利用的物质是
,该步骤生成的能循环利用的物质是_____ (填化学式)。
(5)“热解”步骤的化学方程式为_____ 。
(6) 在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。
在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。 ,则B点微粒的坐标为
,则B点微粒的坐标为_____ 。
②Ti在晶胞中的位置为_____ ;晶胞中一个Ba周围与其最近的O的个数为_____ 。
 被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为
被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为 ,含少量
,含少量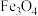 、
、 和
和 )为原料制备
)为原料制备 的流程如下:
的流程如下: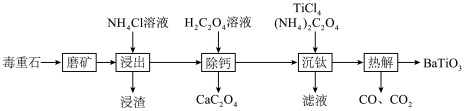
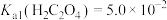 ,
,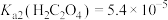 ,
, ;
;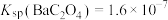 ,
,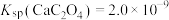 。
。回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有
(2)浸渣的主要成分为
 与
与 溶液反应的原理为
溶液反应的原理为(3)若浸出液中
 ,
, ,“除钙”步骤中,当沉钙率为90%时,钡损率为
,“除钙”步骤中,当沉钙率为90%时,钡损率为(4)
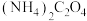 溶液显
溶液显 ,该步骤生成的能循环利用的物质是
,该步骤生成的能循环利用的物质是(5)“热解”步骤的化学方程式为
(6)
 在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。
在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。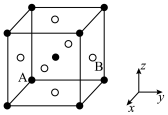
 ,则B点微粒的坐标为
,则B点微粒的坐标为②Ti在晶胞中的位置为
您最近半年使用:0次
2 . 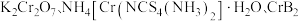 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: 原子有
原子有___________ 种能量不同的电子,价电子排布式为___________ 。
(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量, 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为___________  ;
;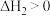 ,其原因是
,其原因是___________ 。
(3)雷氏盐的化学式为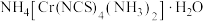 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为___________ 。
②雷氏盐中所含化学键类型___________ 。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一 分子的
分子的 模型名称为
模型名称为___________ ,与配体 互为等电子体的分子和离子有
互为等电子体的分子和离子有___________ 、___________ (各写1种)。
(4)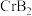 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
___________ (列出计算式)。
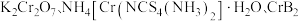 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: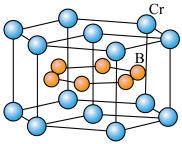
 原子有
原子有(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为 ;
;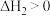 ,其原因是
,其原因是(3)雷氏盐的化学式为
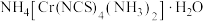 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②雷氏盐中所含化学键类型
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一
 分子的
分子的 模型名称为
模型名称为 互为等电子体的分子和离子有
互为等电子体的分子和离子有(4)
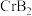 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
您最近半年使用:0次
名校
解题方法
3 . 铁及其化合物在生产生活中有重要应用。Fe的某种硫化物的晶胞如图所示,该晶胞为立方体,晶胞棱长为anm。___________ ;写出其阴离子的电子式___________ 。
(2)下列说法正确的是___________。
(3)已知阿伏加德罗常数的值为 ,该晶胞密度为
,该晶胞密度为___________  。铁原子之间最短距离为
。铁原子之间最短距离为___________ 。
(4)在该晶胞中,每个 周围它最近且等距的
周围它最近且等距的 有
有___________ 个;下列属于从该晶体结构中分割出的部分结构图的是___________ 。(白球、黑球分别代表题中阴、阳离子)
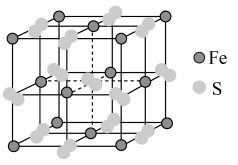
(2)下列说法正确的是___________。
| A.该晶胞与NaCl晶胞结构相似 |
| B.该晶胞中的阴离子存在两种不同取向 |
C.该晶体结构中存在 和 和 |
| D.该物质中含有离子键、共价键和分子间作用力 |
(3)已知阿伏加德罗常数的值为
 ,该晶胞密度为
,该晶胞密度为 。铁原子之间最短距离为
。铁原子之间最短距离为(4)在该晶胞中,每个
 周围它最近且等距的
周围它最近且等距的 有
有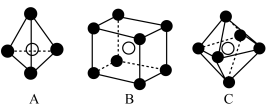
您最近半年使用:0次
解题方法
4 . 研究发现, 氧化物负载的M氧化物纳米粒子和
氧化物负载的M氧化物纳米粒子和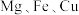 等元素纳米粒子催化剂在合成淀粉过程中有较高的催化活性。以
等元素纳米粒子催化剂在合成淀粉过程中有较高的催化活性。以 和
和 为主要原料人工合成淀粉涉及的部分反应如下:
为主要原料人工合成淀粉涉及的部分反应如下:
反应i: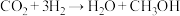
反应ii: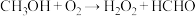
(1) 在元素周期表中的位置为
在元素周期表中的位置为_______ ,基态 原子核外电子占据的最高能级的原子轨道形状为
原子核外电子占据的最高能级的原子轨道形状为_______ 。
(2)第一电离能: ,其原因是
,其原因是_______ 。
(3)反应ii中, 中π键的形成方式为
中π键的形成方式为_______ (填“肩并肩”或“头碰头”), 的同素异形体
的同素异形体 为
为_______ (填“极性”或“非极性”)分子。
(4)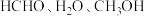 三者的沸点从高到低的顺序为
三者的沸点从高到低的顺序为_______ ,原因是_______ 。
(5) 具有
具有 型结构(如图),
型结构(如图), 的配位数为
的配位数为_______ ;已知 的晶胞参数
的晶胞参数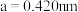 ,则
,则 的半径为
的半径为_______ 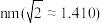 。
。
 氧化物负载的M氧化物纳米粒子和
氧化物负载的M氧化物纳米粒子和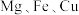 等元素纳米粒子催化剂在合成淀粉过程中有较高的催化活性。以
等元素纳米粒子催化剂在合成淀粉过程中有较高的催化活性。以 和
和 为主要原料人工合成淀粉涉及的部分反应如下:
为主要原料人工合成淀粉涉及的部分反应如下:反应i:
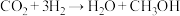
反应ii:
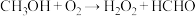
(1)
 在元素周期表中的位置为
在元素周期表中的位置为 原子核外电子占据的最高能级的原子轨道形状为
原子核外电子占据的最高能级的原子轨道形状为(2)第一电离能:
 ,其原因是
,其原因是(3)反应ii中,
 中π键的形成方式为
中π键的形成方式为 的同素异形体
的同素异形体 为
为(4)
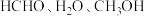 三者的沸点从高到低的顺序为
三者的沸点从高到低的顺序为(5)
 具有
具有 型结构(如图),
型结构(如图), 的配位数为
的配位数为 的晶胞参数
的晶胞参数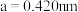 ,则
,则 的半径为
的半径为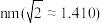 。
。
您最近半年使用:0次
名校
解题方法
5 . 铝及铝的化合物是当前用途十分广泛的、最经济适用的材料之一。回答下列问题:
(1)基态Al原子的核外电子排布式________ ;Al3+的最高能级电子云轮廓形状为________ ;铝的第一电离能低于镁的原因是________ 。
(2)氧炔焰的温度可以达到3200℃左右,用于焊接金属铝、不锈钢、铜等金属。乙炔中心C原子的轨道杂化类型为________ 。铝的熔点660℃、沸点2327℃,高于镁的熔点648℃、沸点1107℃,原因是________ 。
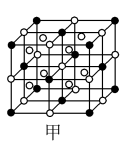
(3)冰晶石(Na3AlF6)是炼铝的助熔剂,由两种微粒构成,冰晶石的晶胞结构如下图所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心以及大立方体的体心,那么大立方体的●所代表的微粒是________ (填微粒符号)。________ ,配位数为________ 。若已知Al的原子半径为rnm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则Al晶体的密度为________ g/cm3(用字母表示)。
(1)基态Al原子的核外电子排布式
(2)氧炔焰的温度可以达到3200℃左右,用于焊接金属铝、不锈钢、铜等金属。乙炔中心C原子的轨道杂化类型为
(3)冰晶石(Na3AlF6)是炼铝的助熔剂,由两种微粒构成,冰晶石的晶胞结构如下图所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心以及大立方体的体心,那么大立方体的●所代表的微粒是

您最近半年使用:0次
名校
解题方法
6 . A、B、C、D、B、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍;B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的VIB族,F元素的基态原子中有4个未成对电子。
(1)A元素单质的结构式为___________ ;基态E元素原子价层电子排布图为____________ 。
(2)A的氢化物A2H4分子属于___________ 分子(填“极性或非极性);A与B形成的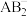 的空间构型为
的空间构型为___________ 。
(3)酸性条件下,E元素的离子 和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:
和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:___________________________________ 。
(4)元素C和D组成的简单化合物空间构型为________________ 。
(5)元素B与E形成的一种化合物广泛应用于录音磁带,其晶胞如图。若晶胞参数(边长)为apm,NA为阿伏加德罗常数的值,则该晶胞的密度为__________  。
。
(1)A元素单质的结构式为
(2)A的氢化物A2H4分子属于
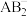 的空间构型为
的空间构型为(3)酸性条件下,E元素的离子
 和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:
和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:(4)元素C和D组成的简单化合物空间构型为
(5)元素B与E形成的一种化合物广泛应用于录音磁带,其晶胞如图。若晶胞参数(边长)为apm,NA为阿伏加德罗常数的值,则该晶胞的密度为
 。
。
您最近半年使用:0次
名校
解题方法
7 . 铜离子可与含N、含O的微粒形成多种结构。向CuSO4溶液中滴加氨水可最终形成如图所示的配离子。___________ 。关于该微粒说法正确的是___________ 。
A.1mol该微粒中有22mol共价键
B.该微粒中的N、O原子构成了立方体结构
C.电负性N>O>H
D.该微粒中可与溶剂水分子形成氢键的只有N、O原子
(2)铜元素位于元素周期表的___________ 区。铜原子价电子排布式 为___________ 。
A.s区 B.p区 C.ds区 D.f区
(3)Cu2+无法与BF3中的B原子形成配位键的原因是___________ 。
(4)Cu2+可形成如图所示晶体。该晶胞中负离子为 CN—,“连接”着每一对相邻的Fe3+与Cu2+(部分 示例位置已用箭头标出)。___________ 个。
②已知相邻的Fe3+与Cu2+核间距为apm,则相邻的Fe3+与K+核间距为___________ pm。
③该晶体的化学式为___________ 。

A.1mol该微粒中有22mol共价键
B.该微粒中的N、O原子构成了立方体结构
C.电负性N>O>H
D.该微粒中可与溶剂水分子形成氢键的只有N、O原子
(2)铜元素位于元素周期表的
A.s区 B.p区 C.ds区 D.f区
(3)Cu2+无法与BF3中的B原子形成配位键的原因是
(4)Cu2+可形成如图所示晶体。该晶胞中

②已知相邻的Fe3+与Cu2+核间距为apm,则相邻的Fe3+与K+核间距为
③该晶体的化学式为
您最近半年使用:0次
解题方法
8 . 氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
(1)基态F原子的核外电子排布式为___________ 。基态F原子的电子有___________ 种空间运动状态。
(2)氟氧化物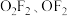 的结构已经确定。
的结构已经确定。
①依据上表数据推测 键的稳定性:
键的稳定性: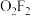
___________  (填“>”或“<”)。
(填“>”或“<”)。
② 中
中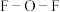 的键角小于
的键角小于 中
中 的键角,解释原因:
的键角,解释原因:___________ 。
(3) 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。
①已知:氢键 中三原子在一条直线上时,作用力最强。测定结果表明,
中三原子在一条直线上时,作用力最强。测定结果表明,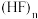 固体中
固体中 分子排列成锯齿形。画出含2个
分子排列成锯齿形。画出含2个 的重复单元结构:
的重复单元结构:___________ 。
② 中加入
中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:___________ 。
(4)工业上用蒬石(主要成分 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。 晶体中距离
晶体中距离 最近的
最近的 有
有___________ 个。
②晶体中 与
与 的最近距离为
的最近距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度
。该晶体的密度
___________  (列出计算式)。
(列出计算式)。
(1)基态F原子的核外电子排布式为
(2)氟氧化物
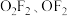 的结构已经确定。
的结构已经确定。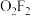 |  | |
 键长/pm 键长/pm | 121 | 148 |
 键的稳定性:
键的稳定性: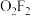
 (填“>”或“<”)。
(填“>”或“<”)。②
 中
中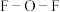 的键角小于
的键角小于 中
中 的键角,解释原因:
的键角,解释原因:(3)
 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。①已知:氢键
 中三原子在一条直线上时,作用力最强。测定结果表明,
中三原子在一条直线上时,作用力最强。测定结果表明,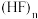 固体中
固体中 分子排列成锯齿形。画出含2个
分子排列成锯齿形。画出含2个 的重复单元结构:
的重复单元结构:②
 中加入
中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:(4)工业上用蒬石(主要成分
 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。
 晶体中距离
晶体中距离 最近的
最近的 有
有②晶体中
 与
与 的最近距离为
的最近距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度
。该晶体的密度
 (列出计算式)。
(列出计算式)。
您最近半年使用:0次
解题方法
9 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为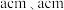 和
和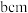 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为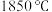 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为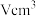 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
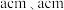 和
和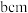 ,结构如下图所示。
,结构如下图所示。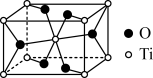
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
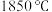 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为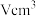 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近半年使用:0次
名校
解题方法
10 .  、
、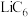 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:
(1)基态Co原子的价电子中,两种自旋状态的电子数之比为___________ 。
(2)Co(Ⅲ)可形成多种配合物。
①已知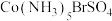 中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加
中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加 溶液无明显现象,滴加
溶液无明显现象,滴加 溶液有淡黄色沉淀生成,则该配合物可表示为
溶液有淡黄色沉淀生成,则该配合物可表示为______________________ 。
② 结构如图所示,
结构如图所示, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则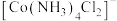 的空间结构有
的空间结构有___________ 种。 的结构如下图,该配合物中存在的作用力类型有
的结构如下图,该配合物中存在的作用力类型有___________ (填标号)。
(3) 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。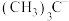 的空间结构为
的空间结构为___________ ;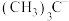 、
、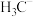 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是______________ 。
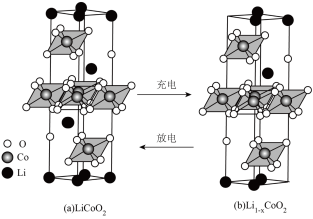
(4)①正极材料 的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有
的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有___________ 个O;充电时, 脱出部分
脱出部分 ,形成
,形成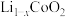 ,结构如图(b)则
,结构如图(b)则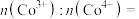
___________ 。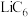 晶胞结构如图(c),
晶胞结构如图(c), 原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为
原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为______________________  (用
(用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
 、
、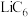 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:(1)基态Co原子的价电子中,两种自旋状态的电子数之比为
(2)Co(Ⅲ)可形成多种配合物。
①已知
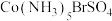 中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加
中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加 溶液无明显现象,滴加
溶液无明显现象,滴加 溶液有淡黄色沉淀生成,则该配合物可表示为
溶液有淡黄色沉淀生成,则该配合物可表示为②
 结构如图所示,
结构如图所示, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则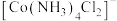 的空间结构有
的空间结构有
 的结构如下图,该配合物中存在的作用力类型有
的结构如下图,该配合物中存在的作用力类型有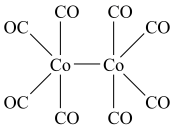
(3)
 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。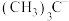 的空间结构为
的空间结构为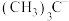 、
、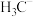 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是(4)①正极材料
 的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有
的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有 脱出部分
脱出部分 ,形成
,形成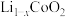 ,结构如图(b)则
,结构如图(b)则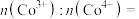
 晶胞结构如图(c),
晶胞结构如图(c), 原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为
原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为 (用
(用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。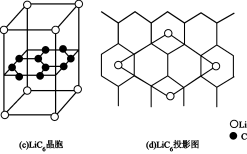
您最近半年使用:0次



