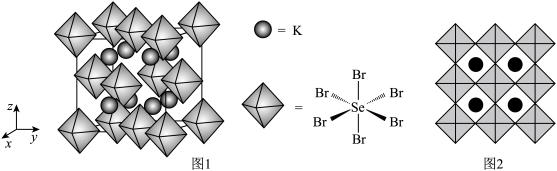
1 . 砷化镓晶胞结构如图甲所示,晶胞参数为a pm,将Mn掺杂到晶体中得到稀磁性半导体材料如图乙所示,下列说法错误的是
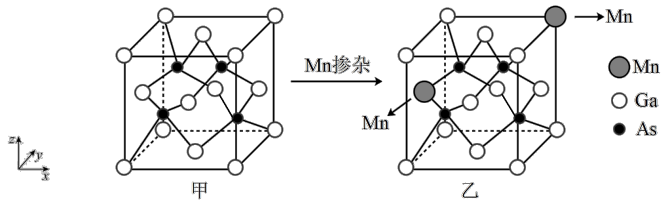
A.甲中Ga和As的最近距离是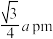 |
| B.甲中As原子位于以Ga为顶点的正四面体的体心上 |
| C.乙中与Mn最近且等距离的As的个数为4 |
| D.乙中Ga原子与As原子的个数比为7:8 |
您最近半年使用:0次
2 . 甲醛释氢对氢能源和含甲醛污水处理有重要意义。
(1)HCHO电催化释氢
催化电解含较低浓度的HCHO、NaOH混合溶液,可获得 与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。 与
与 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为_________________ 。
②电解时,电极b上同时产生 与
与 的物质的量之比为1∶2,则电极b上的电极反应式为
的物质的量之比为1∶2,则电极b上的电极反应式为_____________ 。
③电解过程中每产生1 mol ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为______ mol。
(2)HCHO水化释氢
45℃时,碱性条件下Ag作催化剂可将甲醛转化为 ,反应的机理如图所示。
,反应的机理如图所示。 表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。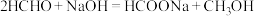 。
。
①若将甲醛中的氢用D原子标记为DCDO,得到的氢气产物为_______ (填化学式)。
②NaOH浓度低于1 mol⋅L 时,NaOH浓度增大产生氢气会加快的原因是
时,NaOH浓度增大产生氢气会加快的原因是__________ 。
③若NaOH浓度过大, 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是__________________ 。
(3)甲烷与水在催化剂作用下可产生氢气与碳氧化物,与甲烷水化法制氢气相比,甲醛制氢的优点有______________ 。
(1)HCHO电催化释氢
催化电解含较低浓度的HCHO、NaOH混合溶液,可获得
 与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
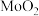 与
与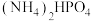 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为②电解时,电极b上同时产生
 与
与 的物质的量之比为1∶2,则电极b上的电极反应式为
的物质的量之比为1∶2,则电极b上的电极反应式为③电解过程中每产生1 mol
 ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为(2)HCHO水化释氢
45℃时,碱性条件下Ag作催化剂可将甲醛转化为
 ,反应的机理如图所示。
,反应的机理如图所示。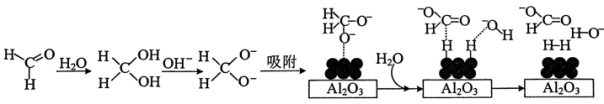
 表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
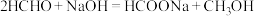 。
。①若将甲醛中的氢用D原子标记为DCDO,得到的氢气产物为
②NaOH浓度低于1 mol⋅L
 时,NaOH浓度增大产生氢气会加快的原因是
时,NaOH浓度增大产生氢气会加快的原因是③若NaOH浓度过大,
 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是(3)甲烷与水在催化剂作用下可产生氢气与碳氧化物,与甲烷水化法制氢气相比,甲醛制氢的优点有
您最近半年使用:0次
7日内更新
|
457次组卷
|
2卷引用:江苏省苏锡常镇四市2024届高三一模考试化学试题
3 . 氧化铈( )常用作玻璃工业添加剂,在其立方晶胞中掺杂
)常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性能。
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性能。 晶胞中
晶胞中 与最近
与最近 的核间距为a pm,下列说法正确的是
的核间距为a pm,下列说法正确的是
 )常用作玻璃工业添加剂,在其立方晶胞中掺杂
)常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性能。
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性能。 晶胞中
晶胞中 与最近
与最近 的核间距为a pm,下列说法正确的是
的核间距为a pm,下列说法正确的是
| A.已知M点原子的分数坐标为(0,0,0),则N点原子的分数坐标为(1,0,1) |
B. 晶胞中与 晶胞中与 最近且等距的 最近且等距的 的个数为6 的个数为6 |
C. 晶体的密度为 晶体的密度为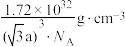 |
D.若掺杂 后得到 后得到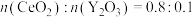 的晶体,则此晶体中 的晶体,则此晶体中 的空缺率为5% 的空缺率为5% |
您最近半年使用:0次
解题方法
4 .  常用于制备磁芯、磁盘和传感器等,它的晶胞(如图)为等轴晶系。下列叙述错误的是
常用于制备磁芯、磁盘和传感器等,它的晶胞(如图)为等轴晶系。下列叙述错误的是 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
 常用于制备磁芯、磁盘和传感器等,它的晶胞(如图)为等轴晶系。下列叙述错误的是
常用于制备磁芯、磁盘和传感器等,它的晶胞(如图)为等轴晶系。下列叙述错误的是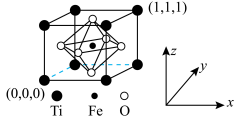
 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。A. 的分数坐标为 的分数坐标为 |
| B.氧离子构成正八面体形 |
C. 和 和 之间的距离为 之间的距离为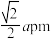 |
D. 晶体密度为 晶体密度为 |
您最近半年使用:0次
解题方法
5 . 一种基于 的锌基催化剂,可高效催化丙烷转化为丙烯。立方
的锌基催化剂,可高效催化丙烷转化为丙烯。立方 的晶胞如图,晶胞参数为
的晶胞如图,晶胞参数为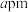 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。下列说法不正确的是
。下列说法不正确的是
 的锌基催化剂,可高效催化丙烷转化为丙烯。立方
的锌基催化剂,可高效催化丙烷转化为丙烯。立方 的晶胞如图,晶胞参数为
的晶胞如图,晶胞参数为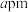 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。下列说法不正确的是
。下列说法不正确的是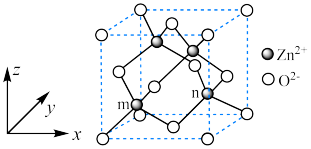
A.该 晶体的摩尔体积为 晶体的摩尔体积为  |
B.与 最近的 最近的 有12个 有12个 |
C. 之间的最短距离为 之间的最短距离为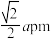 |
D.若坐标取向不变,将 点 点 平移至原点,则 平移至原点,则 点 点 位于晶胞xy面的面心 位于晶胞xy面的面心 |
您最近半年使用:0次
名校
解题方法
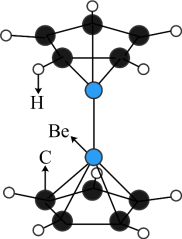
6 . 2023年6月,科学家首次合成含铍-铍能的固态化合物,相关成果发表于《科学》杂质。该分子入选2023年最“炫”分子榜单,其结构如图所示,回答下列问题: 原子最外层电子的电子云轮廓图为
原子最外层电子的电子云轮廓图为_____ (填序号)。
A.球形 B.哑铃形
(2)下列电子排布式分别代表铍微粒,其中失去1个电子所需能量最多的是_____。
(3)“固态双铍化合物的化学式为_____ ,它不含_____ (填标号)。
A.极性键 B.非极性键 C.金属键 D. 键
键
(4)卤化铍的熔点如表所示:
① 中
中 原子的杂化方式为
原子的杂化方式为_____ ;
②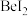
_____ (填“能”或“不能)溶于四氯化碳:
③ 、
、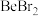 、
、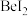 的熔点依次升高的原因是
的熔点依次升高的原因是_____ 。
(5) 易形成配离子
易形成配离子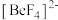 ,其中心阳离子的配位数为
,其中心阳离子的配位数为_____ ,配体是_____ (填化学符号),配离子的空间构型为_____ 。
(6)离子晶体中稳定配位多面体的理论半径比如表所示:
已知铍离子、氧离子的半径分别为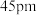 、
、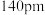 ,
, 的配位多面体是
的配位多面体是_____ 。
(7)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。这种氧化物的化学式为_____ ;设晶胞参数为 ,用
,用 表示阿伏加德罗参数的值,则
表示阿伏加德罗参数的值,则 晶体的密度为
晶体的密度为_____  (用含a和
(用含a和 的式子表示)。
的式子表示)。
 原子最外层电子的电子云轮廓图为
原子最外层电子的电子云轮廓图为A.球形 B.哑铃形
(2)下列电子排布式分别代表铍微粒,其中失去1个电子所需能量最多的是_____。
A.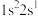 | B. | C.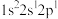 | D. |
(3)“固态双铍化合物的化学式为
A.极性键 B.非极性键 C.金属键 D.
 键
键(4)卤化铍的熔点如表所示:
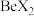 | 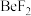 |  | 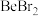 | 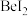 |
熔点/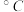 | 552 | 399 | 488 | 510 |
 中
中 原子的杂化方式为
原子的杂化方式为②
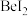
③
 、
、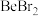 、
、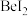 的熔点依次升高的原因是
的熔点依次升高的原因是(5)
 易形成配离子
易形成配离子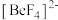 ,其中心阳离子的配位数为
,其中心阳离子的配位数为(6)离子晶体中稳定配位多面体的理论半径比如表所示:
| 配位多面体 | 配位数 | 半径比(r+/r-) |
| 平面三角形 | 3 | 0.15~0.225 |
| 四面体 | 4 | 0.225~0.414 |
| 八面体 | 6 | 0.414~0.732 |
| 立方体 | 8 | 0.732~1.000 |
| 立方八面体 | 12 | 1.000 |
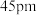 、
、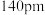 ,
, 的配位多面体是
的配位多面体是(7)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。这种氧化物的化学式为
 ,用
,用 表示阿伏加德罗参数的值,则
表示阿伏加德罗参数的值,则 晶体的密度为
晶体的密度为 (用含a和
(用含a和 的式子表示)。
的式子表示)。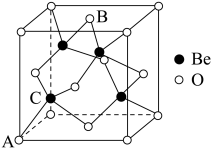
您最近半年使用:0次
名校
解题方法
7 . 我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为_____ 。SiCl4可发生水解反应,机理如下: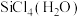 中Si采取的杂化类型为
中Si采取的杂化类型为_____ (填标号)。
(2)CO2分子中σ键和π键的比值_____ 。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是_____ 。
(4)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2._____ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为_____ nm(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为

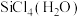 中Si采取的杂化类型为
中Si采取的杂化类型为(2)CO2分子中σ键和π键的比值
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(4)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2.
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近半年使用:0次
名校
解题方法
8 . 镓(Ga)用途非常广泛。
(1)GaAs的晶胞结构如图甲。将Mn掺杂到 的晶体中得到稀磁性半导体材料(图乙)。
的晶体中得到稀磁性半导体材料(图乙)。___________ 。
②GaAs晶胞中Ga和As原子之间最短距离为anm,且恰好为体对角线的 ,阿伏加德罗常数为NA,则该晶体的密度为
,阿伏加德罗常数为NA,则该晶体的密度为___________ g/cm3(列出表达式)。
③掺杂Mn之后,晶体中Mn、Ga、As的原子个数比为___________ (最简整数比)。
(2)GaN的制备:以Ga(CH3)3为原料,在一定条件下使其与NH3发生系列反应得到GaN和另一种产物,该过程的化学方程式为___________ 。
(3)与镓同主族的硼B具有缺电子性,B形成的[B4O5(OH)4]2-结构如图所示,则该离子存在的作用力有___________ (填选项),B原子的杂化方式为___________ 。
(1)GaAs的晶胞结构如图甲。将Mn掺杂到
 的晶体中得到稀磁性半导体材料(图乙)。
的晶体中得到稀磁性半导体材料(图乙)。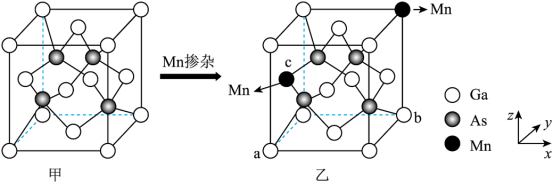
②GaAs晶胞中Ga和As原子之间最短距离为anm,且恰好为体对角线的
 ,阿伏加德罗常数为NA,则该晶体的密度为
,阿伏加德罗常数为NA,则该晶体的密度为③掺杂Mn之后,晶体中Mn、Ga、As的原子个数比为
(2)GaN的制备:以Ga(CH3)3为原料,在一定条件下使其与NH3发生系列反应得到GaN和另一种产物,该过程的化学方程式为
(3)与镓同主族的硼B具有缺电子性,B形成的[B4O5(OH)4]2-结构如图所示,则该离子存在的作用力有
您最近半年使用:0次
解题方法
9 . 硼及其化合物在科研、工业等方面有许多用途。
(1)基态B原子价层电子排布式是___________ 。
(2)六方氮化硼晶体也被称为“白石墨”,具有和石墨晶体相似的层状结构,如图所示。___________ 。
②分析六方氮化硼晶体层间是否存在化学键并说明依据:___________ 。
(3)氮化硼量子点(粒径大小为2~10nm)可用于检测金属离子,如Fe2+或Fe3+的检测原理如下图。___________ 。
②n=___________ (填数字)。
(4)NaBH4是一种重要的储氢材料,其晶胞结构由Ⅰ、Ⅱ两部分组成,如图所示。___________ 。
②已知阿伏加德罗常数为NA,该晶体的密度为___________ g·cm-3。(1nm=10-7cm)
(1)基态B原子价层电子排布式是
(2)六方氮化硼晶体也被称为“白石墨”,具有和石墨晶体相似的层状结构,如图所示。

②分析六方氮化硼晶体层间是否存在化学键并说明依据:
(3)氮化硼量子点(粒径大小为2~10nm)可用于检测金属离子,如Fe2+或Fe3+的检测原理如下图。

②n=
(4)NaBH4是一种重要的储氢材料,其晶胞结构由Ⅰ、Ⅱ两部分组成,如图所示。

②已知阿伏加德罗常数为NA,该晶体的密度为
您最近半年使用:0次
名校
解题方法
10 . 我国科学家合成了以 、
、 、
、 为核心元素的催化剂实现高效硝酸盐电还原为氨。催化剂晶体的典型晶胞结构如下图所示。下列说法正确的是
为核心元素的催化剂实现高效硝酸盐电还原为氨。催化剂晶体的典型晶胞结构如下图所示。下列说法正确的是
 、
、 、
、 为核心元素的催化剂实现高效硝酸盐电还原为氨。催化剂晶体的典型晶胞结构如下图所示。下列说法正确的是
为核心元素的催化剂实现高效硝酸盐电还原为氨。催化剂晶体的典型晶胞结构如下图所示。下列说法正确的是
A.基态 原子的价层电子排布式为 原子的价层电子排布式为 |
B.晶胞(a)中共有6个 原子 原子 |
C.晶体(b)的化学式为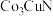 |
D.晶胞(a)中离 原子最近且等距的 原子最近且等距的 原子数目为8 原子数目为8 |
您最近半年使用:0次



