1 . 乙醇是一种清洁的替代能源,催化加氢制备乙醇技术是当前的研究热点。
(1) 催化加氢制备乙醇的反应为
催化加氢制备乙醇的反应为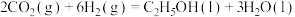 。
。
①若要计算上述反应的 ,须查阅的两个数据是
,须查阅的两个数据是 的燃烧热和
的燃烧热和___________ 。
②某金属有机骨架负载的铜基催化剂上, 加氢生成
加氢生成 的部分反应机理如图所示。
的部分反应机理如图所示。 过程中两个
过程中两个 均参与反应,画出
均参与反应,画出 的结构式(注明电荷)
的结构式(注明电荷)___________ 。
(2)乙酸甲酯催化加氢制备乙醇主要涉及如下反应:
反应Ⅰ:

反应Ⅱ:
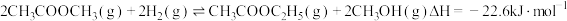
在其他条件不变时,将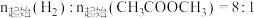 的混合气体以一定流速通入装有铜基催化剂的反应管,测得
的混合气体以一定流速通入装有铜基催化剂的反应管,测得 转化率、
转化率、 选择性
选择性 选择性
选择性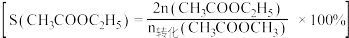 ]随温度的变化如图所示。
]随温度的变化如图所示。 与
与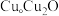 的晶胞如图所示(立方体),
的晶胞如图所示(立方体), 晶体的密度可表示为
晶体的密度可表示为___________  (用含
(用含 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。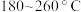 下均有
下均有 ,其原因是
,其原因是___________ 。
③ 范围内,
范围内, 转化率随温度升高而迅速增大的主要原因是
转化率随温度升高而迅速增大的主要原因是___________ 。
④温度高于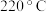 时,催化剂的催化活性下降,其原因可能是
时,催化剂的催化活性下降,其原因可能是___________ 。
(1)
 催化加氢制备乙醇的反应为
催化加氢制备乙醇的反应为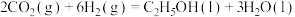 。
。①若要计算上述反应的
 ,须查阅的两个数据是
,须查阅的两个数据是 的燃烧热和
的燃烧热和②某金属有机骨架负载的铜基催化剂上,
 加氢生成
加氢生成 的部分反应机理如图所示。
的部分反应机理如图所示。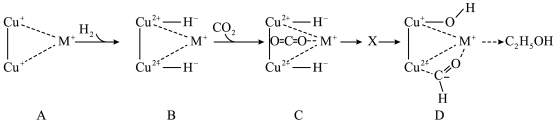
 过程中两个
过程中两个 均参与反应,画出
均参与反应,画出 的结构式(注明电荷)
的结构式(注明电荷)(2)乙酸甲酯催化加氢制备乙醇主要涉及如下反应:
反应Ⅰ:

反应Ⅱ:
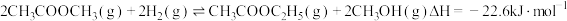
在其他条件不变时,将
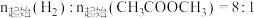 的混合气体以一定流速通入装有铜基催化剂的反应管,测得
的混合气体以一定流速通入装有铜基催化剂的反应管,测得 转化率、
转化率、 选择性
选择性 选择性
选择性 ]随温度的变化如图所示。
]随温度的变化如图所示。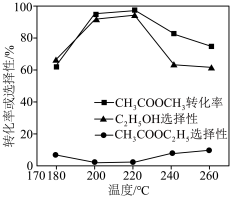
 与
与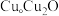 的晶胞如图所示(立方体),
的晶胞如图所示(立方体), 晶体的密度可表示为
晶体的密度可表示为 (用含
(用含 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。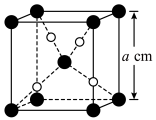
 下均有
下均有 ,其原因是
,其原因是③
 范围内,
范围内, 转化率随温度升高而迅速增大的主要原因是
转化率随温度升高而迅速增大的主要原因是④温度高于
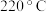 时,催化剂的催化活性下降,其原因可能是
时,催化剂的催化活性下降,其原因可能是
您最近半年使用:0次
解题方法
2 . 三氯化锑( )用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为
)用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为 ,还含有
,还含有 、
、 、
、 和
和 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图: 具有强氧化性,“浸出液”主要含盐酸和
具有强氧化性,“浸出液”主要含盐酸和 ,还含
,还含 、
、 、
、 和
和 等杂质;
等杂质;
②常温下, 、
、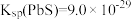 ;
;
③溶液中离子浓度小于或等于 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
回答下列问题:
(1)除将辉锑矿粉碎外,还能加快辉锑矿“酸浸”速率的措施有___________ (填一条即可)。
(2)“滤渣1”的主要成分有___________ (写化学式)。
(3)“浸出液”中加入适量 的目的是
的目的是___________ (填化学方程式)。
(4)当 、
、 共沉淀时,溶液中
共沉淀时,溶液中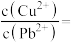
___________ (保留两位有效数字)。
(5)“除砷”时,氧化产物为 ,则
,则 (可溶于水)与
(可溶于水)与 反应的离子方程式为
反应的离子方程式为___________ 。
(6)已知:“电解” 溶液时有
溶液时有 生成。则上述流程中可循环利用的物质有
生成。则上述流程中可循环利用的物质有___________ 。
(7) 晶体中
晶体中 原子沿z轴方向在
原子沿z轴方向在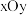 平面的投影图(即俯视图)如图,其中O原子略去,
平面的投影图(即俯视图)如图,其中O原子略去, 原子旁标注的数字表示每个
原子旁标注的数字表示每个 原子位于z轴的高度,则
原子位于z轴的高度,则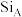 位于晶胞的
位于晶胞的___________ (填“面心”或“棱心”),晶体的密度为___________  。
。
 )用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为
)用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为 ,还含有
,还含有 、
、 、
、 和
和 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图:
 具有强氧化性,“浸出液”主要含盐酸和
具有强氧化性,“浸出液”主要含盐酸和 ,还含
,还含 、
、 、
、 和
和 等杂质;
等杂质;②常温下,
 、
、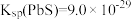 ;
;③溶液中离子浓度小于或等于
 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。回答下列问题:
(1)除将辉锑矿粉碎外,还能加快辉锑矿“酸浸”速率的措施有
(2)“滤渣1”的主要成分有
(3)“浸出液”中加入适量
 的目的是
的目的是(4)当
 、
、 共沉淀时,溶液中
共沉淀时,溶液中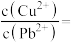
(5)“除砷”时,氧化产物为
 ,则
,则 (可溶于水)与
(可溶于水)与 反应的离子方程式为
反应的离子方程式为(6)已知:“电解”
 溶液时有
溶液时有 生成。则上述流程中可循环利用的物质有
生成。则上述流程中可循环利用的物质有(7)
 晶体中
晶体中 原子沿z轴方向在
原子沿z轴方向在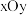 平面的投影图(即俯视图)如图,其中O原子略去,
平面的投影图(即俯视图)如图,其中O原子略去, 原子旁标注的数字表示每个
原子旁标注的数字表示每个 原子位于z轴的高度,则
原子位于z轴的高度,则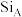 位于晶胞的
位于晶胞的 。
。
您最近半年使用:0次
解题方法
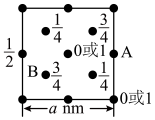
3 . 实验室可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3 与KSCN溶液混合,可得到配位数为5的配合物的化学式是___________ 。K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的 结构如图所示(K+未画出),则一个晶胞中的K+个数为
结构如图所示(K+未画出),则一个晶胞中的K+个数为___________ 。
 结构如图所示(K+未画出),则一个晶胞中的K+个数为
结构如图所示(K+未画出),则一个晶胞中的K+个数为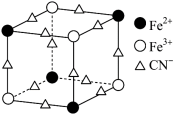
您最近半年使用:0次
解题方法
4 . 钙钛矿是指通式为ABO3的一类化合物,最早发现钙钛矿石中的CaTiO3,因此而得名。钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等的功能材料。
1.基态 原子中未成对电子数为
原子中未成对电子数为___________ 。
2. 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是___________ 。
 的立方晶胞如图1所示。
的立方晶胞如图1所示。___________ 。
4.金属离子与氧离子间的作用力为 。
5.晶胞中与 距离最近且相等的
距离最近且相等的 数目为 。
数目为 。
一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子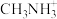 ,其晶胞如图2所示。
,其晶胞如图2所示。 具有相同的空间位置的微粒是 。
具有相同的空间位置的微粒是 。
7.有机碱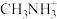 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是___________ 。
8.若晶胞参数为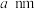 ,则晶体密度为
,则晶体密度为___________  (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
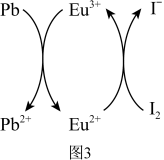
用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了的器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图3所示。___________ 、___________ 。
1.基态
 原子中未成对电子数为
原子中未成对电子数为2.
 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  |  |  |
熔点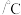 | 377 | -24.12 | 38.3 | 155 |
 的立方晶胞如图1所示。
的立方晶胞如图1所示。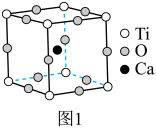
4.金属离子与氧离子间的作用力为 。
| A.离子键 | B.金属键 | C.共价键 | D.分子间作用力 |
 距离最近且相等的
距离最近且相等的 数目为 。
数目为 。| A.4 | B.8 | C.12 | D.16 |
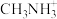 ,其晶胞如图2所示。
,其晶胞如图2所示。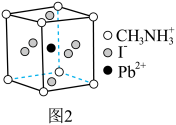
 具有相同的空间位置的微粒是 。
具有相同的空间位置的微粒是 。A. | B. | C. | D.无 |
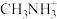 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是8.若晶胞参数为
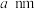 ,则晶体密度为
,则晶体密度为 (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了的器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图3所示。
您最近半年使用:0次
5 . 丙烯是三大合成材料的基本原料之一。可以用丙烷直接脱氢、丙烷氧化脱氢和电解法制丙烯。已知下列反应的热化学方程式:
直接脱氢ⅰ: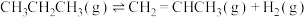
 kJ⋅mol
kJ⋅mol
氧化脱氢ⅱ: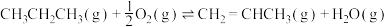
ⅲ:
 kJ⋅mol
kJ⋅mol
(1)
______ kJ⋅mol 。
。
(2)一定条件下,在装有锌基催化剂(ZnO)的恒压密闭容器中,发生直接脱氢反应,丙烯的平衡产率x与平衡常数 的关系可表示为:
的关系可表示为: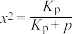 ,式中p为系统总压。p分别为a MPa和b MPa时(
,式中p为系统总压。p分别为a MPa和b MPa时( ),丙烯平衡产率与温度的关系如图1所示。
),丙烯平衡产率与温度的关系如图1所示。______ (填“Ⅰ”或“Ⅱ”), ℃时,
℃时,
______ MPa。
②实验证明,系统总压不变,在丙烷中混入一些水蒸气,丙烷的平衡转化率增大,其原因是____________ 。
③立方ZnO的晶胞如下图2所示,则该晶体中 的配位数为
的配位数为______ ;晶胞参数为cpm, 与
与 间的最小距离为
间的最小距离为______ pm。
(3)以惰性材料作电极,电解法制取丙烯的原理如图3所示。______ 极(填“阳”或“阴”)。
②若电解生成1mol丙烯,理论上阳极区溶液减少的质量为______ g。
直接脱氢ⅰ:
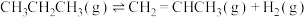
 kJ⋅mol
kJ⋅mol
氧化脱氢ⅱ:
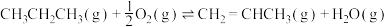
ⅲ:

 kJ⋅mol
kJ⋅mol
(1)

 。
。(2)一定条件下,在装有锌基催化剂(ZnO)的恒压密闭容器中,发生直接脱氢反应,丙烯的平衡产率x与平衡常数
 的关系可表示为:
的关系可表示为: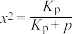 ,式中p为系统总压。p分别为a MPa和b MPa时(
,式中p为系统总压。p分别为a MPa和b MPa时( ),丙烯平衡产率与温度的关系如图1所示。
),丙烯平衡产率与温度的关系如图1所示。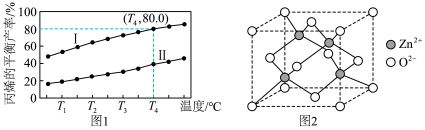
 ℃时,
℃时,
②实验证明,系统总压不变,在丙烷中混入一些水蒸气,丙烷的平衡转化率增大,其原因是
③立方ZnO的晶胞如下图2所示,则该晶体中
 的配位数为
的配位数为 与
与 间的最小距离为
间的最小距离为(3)以惰性材料作电极,电解法制取丙烯的原理如图3所示。
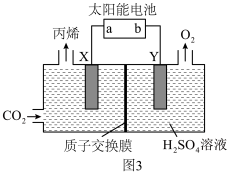
②若电解生成1mol丙烯,理论上阳极区溶液减少的质量为
您最近半年使用:0次
6 . 氮化镓(GaN)是具有优异光电性能的第三代半导体材料。利用炼锌矿渣[主要含铁酸锌 、铁酸镓
、铁酸镓 、
、 ]制备GaN并回收金属元素的一种工艺流程如下图:
]制备GaN并回收金属元素的一种工艺流程如下图: 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 。
(2)“酸浸”所得浸出液中 、
、 浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取
浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取 同时确保不混入
同时确保不混入 ,“调pH”时须:4≤pH<
,“调pH”时须:4≤pH<_______ (假设调pH时溶液体积不变)。已知常温下,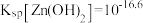 ,
, 。
。
(3)“脱铁”和“反萃取”时,所用盐酸的浓度
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(4)回收金属元素时,锌主要从_______ 中回收(填序号,后同),铁主要从_______ 中回收。
A.滤液 B.水相1 C.水相2 D.有机相
(5)由Ga制备 的部分工艺如下图:
的部分工艺如下图: (乙醚)和
(乙醚)和 (三正辛胺)均为配体;
(三正辛胺)均为配体;
(ii) 沸点:55.7℃,
沸点:55.7℃, 沸点:34.6℃,
沸点:34.6℃, 沸点:365.8℃。
沸点:365.8℃。
①比较分子中的C-Ga-C键角大小:
_____ 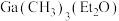 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②直接分解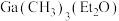 不能制备超纯
不能制备超纯 ,采用“配体交换”工艺制备超纯
,采用“配体交换”工艺制备超纯 的理由是
的理由是_______ 。
(6)MOCVD法是通过 与
与 反应得到GaN和另一种产物,写出该反应的化学方程式:
反应得到GaN和另一种产物,写出该反应的化学方程式:_______ 。
(7)GaN晶体的一种六方晶胞如下图所示。该晶体的密度为_______  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、铁酸镓
、铁酸镓 、
、 ]制备GaN并回收金属元素的一种工艺流程如下图:
]制备GaN并回收金属元素的一种工艺流程如下图: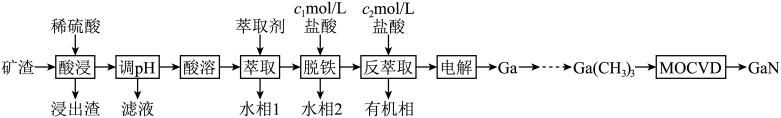
 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。| 盐酸浓度(mol/L) | 反萃取率(%) | |
 |  | |
| 2 | 86.9 | 9.4 |
| 4 | 69.1 | 52.1 |
| 6 | 17.5 | 71.3 |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)“酸浸”所得浸出液中
 、
、 浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取
浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取 同时确保不混入
同时确保不混入 ,“调pH”时须:4≤pH<
,“调pH”时须:4≤pH<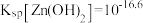 ,
, 。
。(3)“脱铁”和“反萃取”时,所用盐酸的浓度

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(4)回收金属元素时,锌主要从
A.滤液 B.水相1 C.水相2 D.有机相
(5)由Ga制备
 的部分工艺如下图:
的部分工艺如下图:
 (乙醚)和
(乙醚)和 (三正辛胺)均为配体;
(三正辛胺)均为配体;(ii)
 沸点:55.7℃,
沸点:55.7℃, 沸点:34.6℃,
沸点:34.6℃, 沸点:365.8℃。
沸点:365.8℃。①比较分子中的C-Ga-C键角大小:

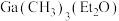 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②直接分解
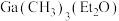 不能制备超纯
不能制备超纯 ,采用“配体交换”工艺制备超纯
,采用“配体交换”工艺制备超纯 的理由是
的理由是(6)MOCVD法是通过
 与
与 反应得到GaN和另一种产物,写出该反应的化学方程式:
反应得到GaN和另一种产物,写出该反应的化学方程式:(7)GaN晶体的一种六方晶胞如下图所示。该晶体的密度为
 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。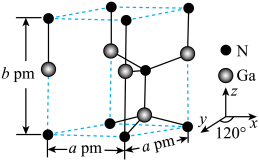
您最近半年使用:0次
2024-04-18更新
|
111次组卷
|
2卷引用:2024届”3+3+3“高考备考诊断性联考卷(二)理综试题-高中化学
7 . 新型钙钛矿材料可用于太阳能电池。一种钙钛矿晶体由Sn2+、I-和有机阳离子( )构成,其立方晶胞结构如图所示。下列说法错误的是
)构成,其立方晶胞结构如图所示。下列说法错误的是
 )构成,其立方晶胞结构如图所示。下列说法错误的是
)构成,其立方晶胞结构如图所示。下列说法错误的是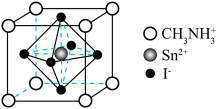
| A.晶体的最简化学式为CH3NH3SnI3 | B.基态碘原子的价层电子排布式为5s25p5 |
| C.晶体中Sn2+的配位数是8 | D.晶胞中Sn2+和I-构成的是正八面体 |
您最近半年使用:0次
2024-04-18更新
|
162次组卷
|
2卷引用:2024届贵州省高三下学期二模化学试题
名校
解题方法
8 . 已知A、B、C、D、E是周期表中前四周期原子序数依次增大的五种元素,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体;含E元素的硫酸盐溶液是制备波尔多液的原料之一,按要求回答下列问题:
(1)五种元素中第一电离能最大的是___________ ,电负性最大的是___________ 。(以上两空均填元素名称)
(2)E元素所在周期中基态原子的单电子数最多的元素是___________ 。(填元素符号)
(3)M分子中B原子的轨道杂化类型为___________ ,M分子中两种键角的大小关系是___________ 。(用∠XYZ表示,X、Y、Z代表元素符号)
(4) 的空间构型为
的空间构型为___________ ;化合物CA3的沸点比BA4的高,其主要原因是___________ 。
(5)向E元素的硫酸盐溶液中通入过量的CA3,得到深蓝色的透明溶液,在此溶液中加入乙醇,析出深蓝色的晶体,此晶体中存在的化学键类型有___________ 。(填代号)
A.离子键 B.σ键 C.非极性共价键 D.配位键 E.金属键 F.氢键
(6)如图是D、E两种元素形成的化合物的晶胞结构示意图,D的配位数为___________ ,已知晶胞中最近两个D原子间距离为a nm,阿伏加德罗常数用NA表示,则该晶体的密度为___________ g/cm3。(用含a、NA的表达式表示)
(1)五种元素中第一电离能最大的是
(2)E元素所在周期中基态原子的单电子数最多的元素是
(3)M分子中B原子的轨道杂化类型为
(4)
 的空间构型为
的空间构型为(5)向E元素的硫酸盐溶液中通入过量的CA3,得到深蓝色的透明溶液,在此溶液中加入乙醇,析出深蓝色的晶体,此晶体中存在的化学键类型有
A.离子键 B.σ键 C.非极性共价键 D.配位键 E.金属键 F.氢键
(6)如图是D、E两种元素形成的化合物的晶胞结构示意图,D的配位数为

您最近半年使用:0次
解题方法
9 . 实验室制取HF的原理为CaF2+H2SO4(浓) CaSO4+2HF↑,氢氟酸可用来刻蚀玻璃,发生反应:SiO2+4HF=SiF4↑+2H2O。CaF2的立方晶胞如图所示,其晶胞参数为a pm,下列说法错误的是
CaSO4+2HF↑,氢氟酸可用来刻蚀玻璃,发生反应:SiO2+4HF=SiF4↑+2H2O。CaF2的立方晶胞如图所示,其晶胞参数为a pm,下列说法错误的是
 CaSO4+2HF↑,氢氟酸可用来刻蚀玻璃,发生反应:SiO2+4HF=SiF4↑+2H2O。CaF2的立方晶胞如图所示,其晶胞参数为a pm,下列说法错误的是
CaSO4+2HF↑,氢氟酸可用来刻蚀玻璃,发生反应:SiO2+4HF=SiF4↑+2H2O。CaF2的立方晶胞如图所示,其晶胞参数为a pm,下列说法错误的是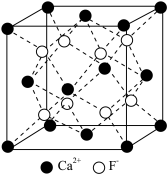
| A.HF需要密封保存于塑料瓶 |
B.SiF4和 的中心原子杂化方式相同 的中心原子杂化方式相同 |
C.CaF2晶体中F-与Ca2+之间的最近距离为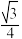 a pm a pm |
| D.CaF2的晶胞中F-与Ca2+的配位数比为2:1 |
您最近半年使用:0次
解题方法
10 . 碳和硫的化合物种类繁多,应用广泛。例如 是一种优良的溶剂,也是用于制造黏胶纤维、玻璃的重要原材料。回答下列问题。
是一种优良的溶剂,也是用于制造黏胶纤维、玻璃的重要原材料。回答下列问题。
Ⅰ. 曾广泛用作溶剂、灭火剂。
曾广泛用作溶剂、灭火剂。
(1)基态氯原子核外电子的空间运动状态有______ 种。基态碳原子的价电子排布是否可以表示为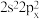 ,
,______ (填“是”或“否”),原因为______ 。
(2) 在
在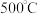 以上时可以与水反应,产生有毒的光气
以上时可以与水反应,产生有毒的光气 常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有
常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有______ (填标号)。
a. 的原子半径更大 b.
的原子半径更大 b. 键的键能更大 c.
键的键能更大 c. 键的极性更大d.
键的极性更大d. 有更多的价层轨道
有更多的价层轨道
光气分子中 的键角
的键角______ (填“大于”、“小于”或“等于”)甲醛分子中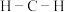 的键角,原因为
的键角,原因为______ 。
Ⅱ.硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(3)硫代硫酸根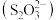 中心原子的杂化方式为
中心原子的杂化方式为______ 。硫代硫酸盐用于矿石提取银时形成 ,该配合物中提供孤电子对的原子为
,该配合物中提供孤电子对的原子为______ (填标号),原因为______ 。
a.端基硫原子 b.中心硫原子 c.氧原子
(4)某硫代硫酸盐的晶胞结构如图。 的
的
______ 。原子 的分数坐标为
的分数坐标为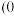 ,
, ,则原子
,则原子 的分数坐标为
的分数坐标为______ 。
 是一种优良的溶剂,也是用于制造黏胶纤维、玻璃的重要原材料。回答下列问题。
是一种优良的溶剂,也是用于制造黏胶纤维、玻璃的重要原材料。回答下列问题。Ⅰ.
 曾广泛用作溶剂、灭火剂。
曾广泛用作溶剂、灭火剂。(1)基态氯原子核外电子的空间运动状态有
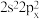 ,
,(2)
 在
在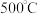 以上时可以与水反应,产生有毒的光气
以上时可以与水反应,产生有毒的光气 常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有
常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有a.
 的原子半径更大 b.
的原子半径更大 b. 键的键能更大 c.
键的键能更大 c. 键的极性更大d.
键的极性更大d. 有更多的价层轨道
有更多的价层轨道光气分子中
 的键角
的键角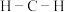 的键角,原因为
的键角,原因为Ⅱ.硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(3)硫代硫酸根
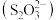 中心原子的杂化方式为
中心原子的杂化方式为 ,该配合物中提供孤电子对的原子为
,该配合物中提供孤电子对的原子为a.端基硫原子 b.中心硫原子 c.氧原子
(4)某硫代硫酸盐的晶胞结构如图。
 的
的
 的分数坐标为
的分数坐标为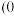 ,
, ,则原子
,则原子 的分数坐标为
的分数坐标为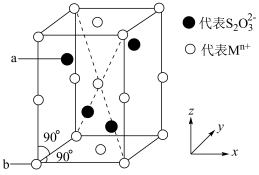
您最近半年使用:0次



