名校
解题方法
1 . 我国科学家利用过渡金属碳化物(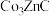 )合成了钴单质催化剂(
)合成了钴单质催化剂(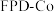 ),其晶胞转化如图所示。
),其晶胞转化如图所示。 ,底长为
,底长为 、宽为
、宽为 、高为
、高为 ;
;
② 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
下列说法错误的是
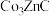 )合成了钴单质催化剂(
)合成了钴单质催化剂(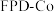 ),其晶胞转化如图所示。
),其晶胞转化如图所示。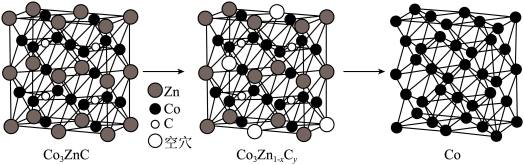
 ,底长为
,底长为 、宽为
、宽为 、高为
、高为 ;
;②
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。下列说法错误的是
A.同周期基态原子,与 原子中所含单电子数相同的原子有2种 原子中所含单电子数相同的原子有2种 |
B.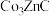 晶胞中与C原子距离最近的 晶胞中与C原子距离最近的 原子形成正八面体结构 原子形成正八面体结构 |
C. 晶胞中 晶胞中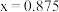 |
D.钴晶胞的密度为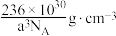 |
您最近半年使用:0次
2 . 某种离子型铁的氧化物晶胞如图所示,它由A、B两种正方体单元构成,且两种正方体单元中氧离子的空间位置相同。通过Li+嵌入或脱嵌该晶胞的棱心和体心,可将该晶体设计为纳米硅基锂电池的正极材料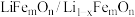 (m、n为正整数)。已知:脱嵌率=
(m、n为正整数)。已知:脱嵌率=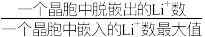 ×100%。
×100%。
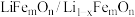 (m、n为正整数)。已知:脱嵌率=
(m、n为正整数)。已知:脱嵌率=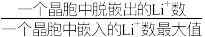 ×100%。
×100%。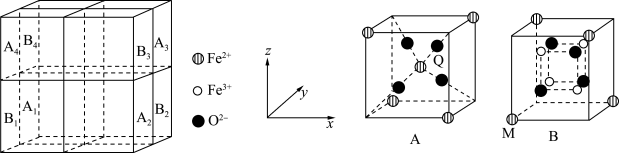
| A.电负性:Fe<O |
| B.该晶胞中Fe3+周围等距最近的O2-有6个 |
| C.正方体单元A的体心处的Fe2+位于O2-形成的正四面体空隙中 |
D.以B1单元中M点为原点,建立如上图坐标系,则A3单元中Q的分数坐标为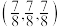 |
您最近半年使用:0次
名校
解题方法
3 .  、
、 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:
(1)基态Co原子的价电子中,两种自旋状态的电子数之比为___________ 。
(2)Co(Ⅲ)可形成多种配合物。
①已知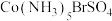 中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加
中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加 溶液无明显现象,滴加
溶液无明显现象,滴加 溶液有淡黄色沉淀生成,则该配合物可表示为
溶液有淡黄色沉淀生成,则该配合物可表示为______________________ 。
② 结构如图所示,
结构如图所示, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则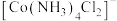 的空间结构有
的空间结构有___________ 种。 的结构如下图,该配合物中存在的作用力类型有
的结构如下图,该配合物中存在的作用力类型有___________ (填标号)。
(3) 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。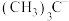 的空间结构为
的空间结构为___________ ;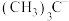 、
、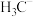 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是______________ 。
(4)①正极材料 的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有
的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有___________ 个O;充电时, 脱出部分
脱出部分 ,形成
,形成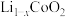 ,结构如图(b)则
,结构如图(b)则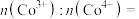
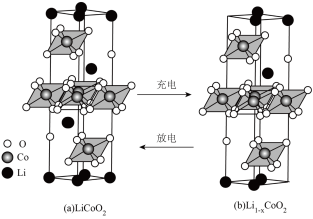
___________ 。 晶胞结构如图(c),
晶胞结构如图(c), 原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为
原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为______________________  (用
(用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
 、
、 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:(1)基态Co原子的价电子中,两种自旋状态的电子数之比为
(2)Co(Ⅲ)可形成多种配合物。
①已知
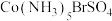 中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加
中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加 溶液无明显现象,滴加
溶液无明显现象,滴加 溶液有淡黄色沉淀生成,则该配合物可表示为
溶液有淡黄色沉淀生成,则该配合物可表示为②
 结构如图所示,
结构如图所示, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则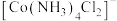 的空间结构有
的空间结构有
 的结构如下图,该配合物中存在的作用力类型有
的结构如下图,该配合物中存在的作用力类型有
(3)
 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。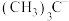 的空间结构为
的空间结构为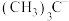 、
、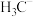 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是(4)①正极材料
 的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有
的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有 脱出部分
脱出部分 ,形成
,形成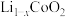 ,结构如图(b)则
,结构如图(b)则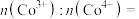
 晶胞结构如图(c),
晶胞结构如图(c), 原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为
原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为 (用
(用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
您最近半年使用:0次
解题方法
4 . 硅、硒、铜、镍及其化合物在生产和生活中有着广泛的应用。请回答下列问题:
(1)基态硅原子中电子占据最高能级的电子云轮廓图的形状为_______ (用文字表述)。
(2)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、② 、③
、③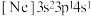 ,有关这些微粒的叙述,正确的是_______。
,有关这些微粒的叙述,正确的是_______。
(3)在硅酸盐中, 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为_______ 。
_______  (填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠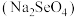 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。 的空间结构为
的空间结构为_______ 。
(5)在周期表中Cu与Ni位置相邻,但两种金属元素的第二电离能为I2(Cu)>I2(Ni),其原因是_______ 。
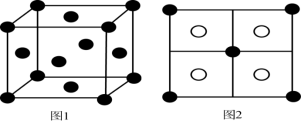
(6)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心。它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为 。
。_______ 。Cu2S晶体的密度为_______ g·cm-3(列出计算式即可)。
(1)基态硅原子中电子占据最高能级的电子云轮廓图的形状为
(2)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、② 、③
、③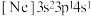 ,有关这些微粒的叙述,正确的是_______。
,有关这些微粒的叙述,正确的是_______。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为

 (填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠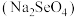 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。 的空间结构为
的空间结构为(5)在周期表中Cu与Ni位置相邻,但两种金属元素的第二电离能为I2(Cu)>I2(Ni),其原因是
(6)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心。它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为
 。
。
您最近半年使用:0次
名校
解题方法
5 . 超高硬度生物材料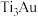 合金是理想的人工髋关节和膝关节材料,其晶体有
合金是理想的人工髋关节和膝关节材料,其晶体有 (图甲)、
(图甲)、 (图乙)两种结构,如下图所示。下列说法错误的是
(图乙)两种结构,如下图所示。下列说法错误的是
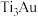 合金是理想的人工髋关节和膝关节材料,其晶体有
合金是理想的人工髋关节和膝关节材料,其晶体有 (图甲)、
(图甲)、 (图乙)两种结构,如下图所示。下列说法错误的是
(图乙)两种结构,如下图所示。下列说法错误的是
| A.图甲中,Ti原子距离最近且等距的Ti原子有8个 |
| B.图乙中,Ti原子位于Au原子构成的四面体空隙中 |
C.图乙中,若M的坐标为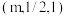 ,则N的坐标为 ,则N的坐标为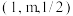 |
D.图乙中,晶胞边长为dpm,晶体的密度为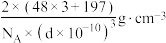 |
您最近半年使用:0次
解题方法
6 . 配合物在许多尖端领域如激光材料、超导材料、抗癌药物的研究、催化剂的研制、自组装超分子等方面有广泛的应用。回答下列问题:
(1)Ni与CO形成的配合物 为无色液体,易溶于
为无色液体,易溶于 、
、 等有机溶剂。
等有机溶剂。 为
为_____ (填“极性”或“非极性”)分子,分子中σ键与π键个数之比为_____ 。
(2)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。 溶液中滴加
溶液中滴加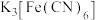 溶液后,经提纯、结晶可得到
溶液后,经提纯、结晶可得到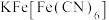 蓝色晶体。实验表明,
蓝色晶体。实验表明, 、
、 、
、 通过配位键构成了晶体的骨架。其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。
通过配位键构成了晶体的骨架。其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。_____ 实验,可确定该晶体结构(填标号)。
a.核磁共振 b.红外光谱 c.X射线衍射 d.质谱
②若 位于Ⅱ型立方结构的棱心和体心上,则
位于Ⅱ型立方结构的棱心和体心上,则 位于Ⅱ型立方结构的
位于Ⅱ型立方结构的_____ 上;一个Ⅱ型立方结构中含_____ 个 ;若
;若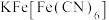 的摩尔质量为
的摩尔质量为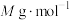 ,该蓝色晶体密度为
,该蓝色晶体密度为 ,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为_____ 。
(1)Ni与CO形成的配合物
 为无色液体,易溶于
为无色液体,易溶于 、
、 等有机溶剂。
等有机溶剂。 为
为(2)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的
 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。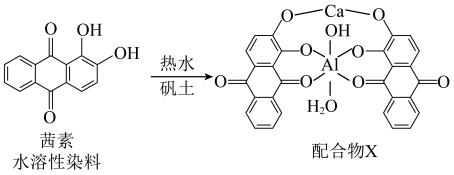
基态 的核外电子的运动状态有
的核外电子的运动状态有 的配体除
的配体除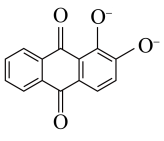 外还有
外还有
 溶液中滴加
溶液中滴加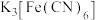 溶液后,经提纯、结晶可得到
溶液后,经提纯、结晶可得到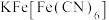 蓝色晶体。实验表明,
蓝色晶体。实验表明, 、
、 、
、 通过配位键构成了晶体的骨架。其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。
通过配位键构成了晶体的骨架。其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。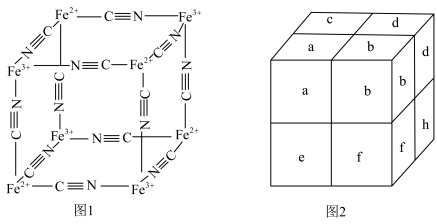
a.核磁共振 b.红外光谱 c.X射线衍射 d.质谱
②若
 位于Ⅱ型立方结构的棱心和体心上,则
位于Ⅱ型立方结构的棱心和体心上,则 位于Ⅱ型立方结构的
位于Ⅱ型立方结构的 ;若
;若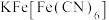 的摩尔质量为
的摩尔质量为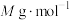 ,该蓝色晶体密度为
,该蓝色晶体密度为 ,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
您最近半年使用:0次
名校
解题方法
7 . 氮及其化合物应用广泛。回答下列问题:
(1)基态 原子处于最高能级的电子云轮廓图为
原子处于最高能级的电子云轮廓图为___________ 形,能量最低的激发态 的核外电子排布式为
的核外电子排布式为___________ 。
(2)胍( )为平面形分子,存在大
)为平面形分子,存在大 键
键 。胍属于
。胍属于___________ 分子(填“极性”或“非极性”), 原子的杂化轨道方式为
原子的杂化轨道方式为___________ ,①号 原子
原子 键角
键角___________ ②号 原子
原子 键角(填“>”“<”或“=”),胍易吸收空气中
键角(填“>”“<”或“=”),胍易吸收空气中 和
和 ,其原因是
,其原因是___________ 。
(3)氮化钴属于立方晶系,经 掺杂得催化剂
掺杂得催化剂 ,经
,经 掺杂得催化剂
掺杂得催化剂 。
。 属于立方晶系,晶胞参数为
属于立方晶系,晶胞参数为 ,距离最近
,距离最近 原子的核间距为
原子的核间距为___________  ,若
,若 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, 的密度为
的密度为___________  (用含
(用含 的代数式表示)。
的代数式表示)。 属于六方晶系,晶胞参数为
属于六方晶系,晶胞参数为 ,
, ,
, (
( 轴与
轴与 轴夹角),1个
轴夹角),1个 原子周围距离相等且最近的
原子周围距离相等且最近的 原子数目为
原子数目为___________ 。
(1)基态
 原子处于最高能级的电子云轮廓图为
原子处于最高能级的电子云轮廓图为 的核外电子排布式为
的核外电子排布式为(2)胍(
 )为平面形分子,存在大
)为平面形分子,存在大 键
键 。胍属于
。胍属于 原子的杂化轨道方式为
原子的杂化轨道方式为 原子
原子 键角
键角 原子
原子 键角(填“>”“<”或“=”),胍易吸收空气中
键角(填“>”“<”或“=”),胍易吸收空气中 和
和 ,其原因是
,其原因是(3)氮化钴属于立方晶系,经
 掺杂得催化剂
掺杂得催化剂 ,经
,经 掺杂得催化剂
掺杂得催化剂 。
。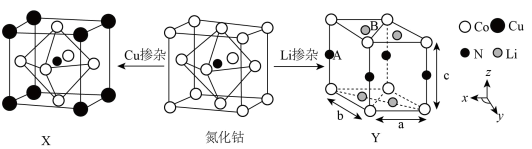
 属于立方晶系,晶胞参数为
属于立方晶系,晶胞参数为 ,距离最近
,距离最近 原子的核间距为
原子的核间距为 ,若
,若 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, 的密度为
的密度为 (用含
(用含 的代数式表示)。
的代数式表示)。 属于六方晶系,晶胞参数为
属于六方晶系,晶胞参数为 ,
, ,
,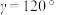 (
( 轴与
轴与 轴夹角),1个
轴夹角),1个 原子周围距离相等且最近的
原子周围距离相等且最近的 原子数目为
原子数目为
您最近半年使用:0次
名校
解题方法
8 . 含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为___________ ;
(2)已知 具有对称的空间构型,
具有对称的空间构型, 中的两个
中的两个 被
被 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为___________ ; 还可形成
还可形成 ,其中
,其中 代表
代表 。该配合物中,
。该配合物中, 模型为四面体的非金属原子共有
模型为四面体的非金属原子共有___________ 个。
(3)一种由 、
、 、
、 组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为 ,晶体中
,晶体中 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如 点,
点, 点原子的分数坐标分别为
点原子的分数坐标分别为 、
、 ,则
,则 点原子的分数坐标为
点原子的分数坐标为___________ ,晶胞中 、
、 间距离
间距离
___________  。
。 是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价
是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价 原子)。
原子)。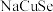 晶胞中0价
晶胞中0价 原子个数为
原子个数为___________ ,每个 晶胞完全转化为
晶胞完全转化为 晶胞,转移电子数为
晶胞,转移电子数为___________ 。
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为(2)已知
 具有对称的空间构型,
具有对称的空间构型, 中的两个
中的两个 被
被 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为 还可形成
还可形成 ,其中
,其中 代表
代表 。该配合物中,
。该配合物中, 模型为四面体的非金属原子共有
模型为四面体的非金属原子共有(3)一种由
 、
、 、
、 组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为 ,晶体中
,晶体中 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为 点,
点, 点原子的分数坐标分别为
点原子的分数坐标分别为 、
、 ,则
,则 点原子的分数坐标为
点原子的分数坐标为 、
、 间距离
间距离
 。
。
 是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价
是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价 原子)。
原子)。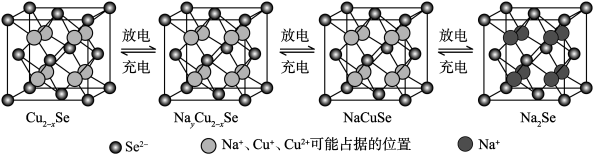
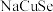 晶胞中0价
晶胞中0价 原子个数为
原子个数为 晶胞完全转化为
晶胞完全转化为 晶胞,转移电子数为
晶胞,转移电子数为
您最近半年使用:0次
9 .  具有和石墨相似的层状结构,其二维平面结构如图所示,实线圈部分代表一个基本结构单元。研究表明,非金属掺杂(
具有和石墨相似的层状结构,其二维平面结构如图所示,实线圈部分代表一个基本结构单元。研究表明,非金属掺杂( 、
、 等)能提高其光催化活性。下列关于
等)能提高其光催化活性。下列关于 的说法不正确的是
的说法不正确的是
 具有和石墨相似的层状结构,其二维平面结构如图所示,实线圈部分代表一个基本结构单元。研究表明,非金属掺杂(
具有和石墨相似的层状结构,其二维平面结构如图所示,实线圈部分代表一个基本结构单元。研究表明,非金属掺杂( 、
、 等)能提高其光催化活性。下列关于
等)能提高其光催化活性。下列关于 的说法不正确的是
的说法不正确的是
A. 原子的第三电离能大于 原子的第三电离能大于 原子的第三电离能 原子的第三电离能 |
B.晶体中存在的微粒间作用力有极性键、 键、范德华力 键、范德华力 |
C.配位数为2的 原子与配位数为3的 原子与配位数为3的 原子数目之比为 原子数目之比为 |
D.每个基本结构单元中两个 原子(图中虚线圈)被 原子(图中虚线圈)被 原子替代所得物质化学式为 原子替代所得物质化学式为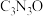 |
您最近半年使用:0次
名校
解题方法
10 . 钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(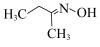 )。回答下列问题:
)。回答下列问题:
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
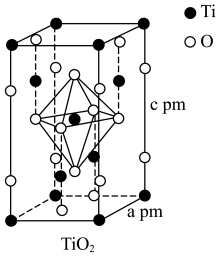
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因
(4)TiO2晶胞如图所示,若其晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=
您最近半年使用:0次



