1 . 氟化钾镁是一种具有优良光学性能的材料,主要应用于激光领域,其立方晶胞结构如图。 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是
 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是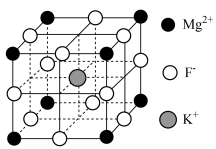
A. 的配位数为12 的配位数为12 |
B.每个 位于距其最近且等距的 位于距其最近且等距的 构成的正四面体空隙中 构成的正四面体空隙中 |
C.若 位于晶胞的体心,则 位于晶胞的体心,则 位于晶胞的面心 位于晶胞的面心 |
D.若晶胞参数为a nm,则晶体的密度是 |
您最近半年使用:0次
7日内更新
|
649次组卷
|
5卷引用:东北三省2024届高三下学期三校二模联考化学试题
东北三省2024届高三下学期三校二模联考化学试题黑龙江省哈尔滨市三校联考2024届高三二模化学试题东北三省2024届高三下学期三校二模联考化学试题(已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
名校
解题方法
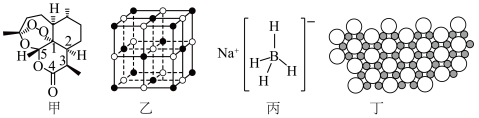
2 . 2015年10月,我国著名药学家屠呦呦因发现治疗疟疾新型药物青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖,成为首位获得诺贝尔科学奖的华人女科学家,震惊世界,感动中国。青蒿素(C₁₅H₂₂O₅)的结构如图甲所示。请回答下列问题:___________ 对自旋方向相反的电子。若将C原子的电子排布式写成 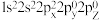 ,则违背了
,则违背了 ___________
(2)下列关于青蒿素的说法正确的是___________ (填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其他原子成键
(3)在确定青蒿素结构的过程中,可采用硼氢化钠(NaBH4)作为还原剂,其制备方法为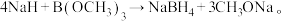
①NaH为___________ 晶体,图乙是 NaH晶胞结构,则 NaH晶体的配位数是___________ ; 若晶胞棱长为a,则Na原子间最小核间距为___________ 。
②NaBH4结构如图丙所示, BH4 “中 B采用杂化类型___________
1mol NH4BH4含有___________ mol配位键,立方氮化硼是超硬材料,熔点为3300°C.氮化铝(AlN)的熔点为2250℃,其熔点低于氮化硼的原因是 ___________ 。
(4)硼酸(H3BO3)晶体结构为层状,其二维平面结构如下图所示。
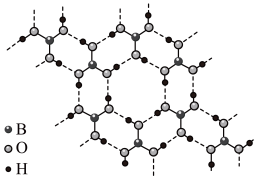
1mol H3BO3晶体中含有___________ mol氢键。
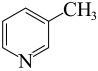
(5)硼(B)及其化合物在化学中有重要的地位。科学家发现硼化镁在39k时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图丁是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同-平面上。根据图示确定硼化镁的化学式为___________ 。
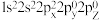 ,则违背了
,则违背了 (2)下列关于青蒿素的说法正确的是
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其他原子成键
(3)在确定青蒿素结构的过程中,可采用硼氢化钠(NaBH4)作为还原剂,其制备方法为
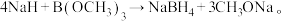
①NaH为
②NaBH4结构如图丙所示, BH4 “中 B采用杂化类型
1mol NH4BH4含有
(4)硼酸(H3BO3)晶体结构为层状,其二维平面结构如下图所示。

1mol H3BO3晶体中含有
(5)硼(B)及其化合物在化学中有重要的地位。科学家发现硼化镁在39k时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图丁是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同-平面上。根据图示确定硼化镁的化学式为
您最近半年使用:0次
名校
解题方法
3 . 硼、碳、氮元素形成的化合物极为丰富。
(1)吡啶( )是一种常见的配体,其中含有与苯类似的大
)是一种常见的配体,其中含有与苯类似的大 键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
(2) 、
、 、
、 均可作为配体,则三者中配位能力最弱的是
均可作为配体,则三者中配位能力最弱的是__________ ,其原因为__________ 。
(3)某种新型储氢材料的晶胞如图所示,其中八面体中心为 ,顶点均为配体
,顶点均为配体 ;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则
;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则__________ ,晶体类型是__________ , 与硼原子间的最短距离为
与硼原子间的最短距离为__________ cm(用含a代数式表示)。
(4)下列有关说法正确的是__________。
(1)吡啶(
 )是一种常见的配体,其中含有与苯类似的大
)是一种常见的配体,其中含有与苯类似的大 键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。A. 轨道 轨道 | B. 轨道 轨道 | C. 杂化轨道 杂化轨道 | D. 杂化轨道 杂化轨道 |
(2)
 、
、 、
、 均可作为配体,则三者中配位能力最弱的是
均可作为配体,则三者中配位能力最弱的是(3)某种新型储氢材料的晶胞如图所示,其中八面体中心为
 ,顶点均为配体
,顶点均为配体 ;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则
;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则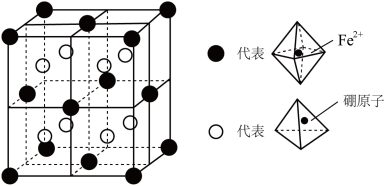
 与硼原子间的最短距离为
与硼原子间的最短距离为(4)下列有关说法正确的是__________。
| A.电负性:N>H>B | B.沸点:吡啶>苯 |
| C.第一电离能:N>C>O | D.基态 的简化电子排布式: 的简化电子排布式: |
您最近半年使用:0次
解题方法
4 . 硅、硒、铜、镍及其化合物在生产和生活中有着广泛的应用。请回答下列问题:
(1)基态硅原子中电子占据最高能级的电子云轮廓图的形状为_______ (用文字表述)。
(2)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、② 、③
、③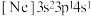 ,有关这些微粒的叙述,正确的是_______。
,有关这些微粒的叙述,正确的是_______。
(3)在硅酸盐中, 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为_______ 。
_______  (填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠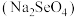 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。 的空间结构为
的空间结构为_______ 。
(5)在周期表中Cu与Ni位置相邻,但两种金属元素的第二电离能为I2(Cu)>I2(Ni),其原因是_______ 。
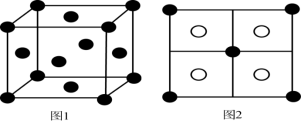
(6)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心。它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为 。
。_______ 。Cu2S晶体的密度为_______ g·cm-3(列出计算式即可)。
(1)基态硅原子中电子占据最高能级的电子云轮廓图的形状为
(2)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、② 、③
、③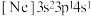 ,有关这些微粒的叙述,正确的是_______。
,有关这些微粒的叙述,正确的是_______。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为

 (填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠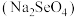 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。 的空间结构为
的空间结构为(5)在周期表中Cu与Ni位置相邻,但两种金属元素的第二电离能为I2(Cu)>I2(Ni),其原因是
(6)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心。它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为
 。
。
您最近半年使用:0次
解题方法
5 . 废定影液的主要成分为 ,以废定影液为原料制备
,以废定影液为原料制备 的工艺流程如图:
的工艺流程如图: )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
②常温下, 稳
稳 ;
; 。
。
(1)硫化钠溶液显碱性,其原因为___________ (用离子方程式表示)。
(2)比较S原子和O原子的电负性大小,并从原子结构的角度说明理由:___________ 。
(3) 的空间结构是
的空间结构是___________ 。
(4)常温下,“沉淀”时发生的反应为 ,平衡时,
,平衡时,
___________ (列出计算式即可)。
(5)“反应”时有淡黄色固体生成,发生反应的化学方程式为___________ 。
(6)MgS2O3·6H2O的晶胞形状为长方体,结构如图所示。 个数为
个数为___________ 。晶体中微粒间作用力有___________ (填标号)。
a.氢键 b.离子键 c.极性共价键 d.配位键
 ,以废定影液为原料制备
,以废定影液为原料制备 的工艺流程如图:
的工艺流程如图: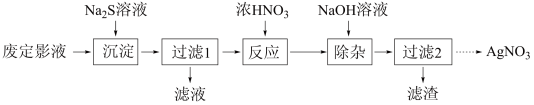
 )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。②常温下,
 稳
稳 ;
; 。
。(1)硫化钠溶液显碱性,其原因为
(2)比较S原子和O原子的电负性大小,并从原子结构的角度说明理由:
(3)
 的空间结构是
的空间结构是(4)常温下,“沉淀”时发生的反应为
 ,平衡时,
,平衡时,
(5)“反应”时有淡黄色固体生成,发生反应的化学方程式为
(6)MgS2O3·6H2O的晶胞形状为长方体,结构如图所示。
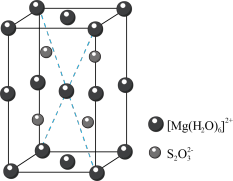
 个数为
个数为a.氢键 b.离子键 c.极性共价键 d.配位键
您最近半年使用:0次
6 . I.按构成晶体的粒子和粒子间作用力的不同,将以下晶体进行分类:
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:___________ ;属于分子晶体的有:___________ ;属于离子晶体的有:___________ ;属于金属晶体的有:___________ 。
Ⅱ.比较:
(2)熔点:金刚石___________ 干冰(填“>”或“<”),原因是___________ 。
(3)键角:CH4___________ H2O(填“>”或“<”),原因是___________ 。
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:___________ 。
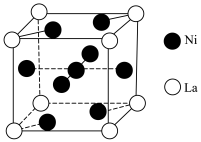
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。___________ 。
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:
Ⅱ.比较:
(2)熔点:金刚石
(3)键角:CH4
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

②与Cu原子等距离且最近的Cu原子有
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:
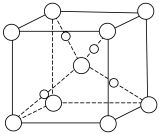
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。
您最近半年使用:0次
7 . MgO、BeO、CsCl、金刚石四种晶体的结构模型如图所示,下列说法正确的是

| A.MgO晶体中,每个晶胞含有4个MgO分子,CsCl晶胞含有1个CsCl分子 |
| B.BeO晶体中,每个Be2+周围与其最近且等距的O2-有4个 |
C.金刚石晶体中,碳原子之间的最短距离为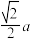 |
| D.MgO晶体熔点比BeO晶体的高 |
您最近半年使用:0次
名校
解题方法
8 . 下列说法错误的是
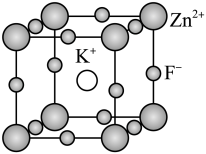
| A.MgO的离子键的键能大于CaO的 | B.BF3键角为120°,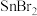 的键角大于120° 的键角大于120° |
C.如图所示的晶胞的化学式为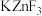 | D.DNA双螺旋的两个螺旋链通过氢键相互结合 |
您最近半年使用:0次
9 . 氮化硼、磷化硼均是受到高度关注的耐磨涂料。磷化硼的晶胞及某些原子的分数坐标如图所示,下列说法正确的是
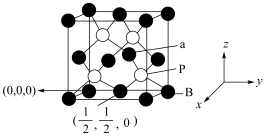
| A.磷化硼中P的价层电子对数为4 | B.熔点:BN<BP |
| C.磷化硼不溶于水,但可能溶于苯 | D.a原子的分数坐标为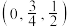 |
您最近半年使用:0次
解题方法
10 . 近年来,我国半导体材料市场发展迅速,其中以氮化嫁、碳化硅、氧化锌、金刚石等为主的材料备受关注。回答下列问题:
(1)基态Ga原子的价电子轨道表示式为___________ ,基态N原子核外电子有___________ 种空间运动状态。Zn在元素周期表中位于___________ 区。
(2)C,N、O的第一电离能由大到小的顺序为___________ 。 的空间结构为
的空间结构为___________ 。
(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为( ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为___________ ,C和Si原子的最短距离为___________ pm。
①GaN晶体中N原子的杂化轨道类型为___________ 。
②GaN晶体的密度为___________ g/cm3(列出计算式,用含b、c、NA的代数式表示)。
(1)基态Ga原子的价电子轨道表示式为
(2)C,N、O的第一电离能由大到小的顺序为
 的空间结构为
的空间结构为(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为(
 ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
①GaN晶体中N原子的杂化轨道类型为
②GaN晶体的密度为
您最近半年使用:0次



