解题方法
1 . 模拟工业上用黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量FeO、Fe3O4、Fe2O3)生产Cu(NO3)2溶液的流程如下图所示。
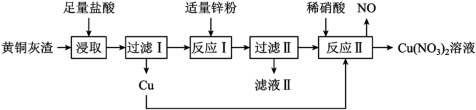
回答下列问题:
(1)写出“浸取”时Fe3O4反应的离子方程式:_______ 。
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由_______ 。
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是_______ 。
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。若要获得100mL1.4mol·L-1的稀硝酸,需要用_____ 量取浓硝酸的体积为________ mL。
(5)金属材料的使用见证了人类文明发展过程,铝合金是目前用途广泛的合金之一、例如,硬铝(一种铝合金)中含Cu 4%、Mg 0.5%、______ 0.5%、Si 0.7%,它的密度小、强度高、具有较强的抗腐蚀能力。(填元素符号)
(6)工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mL FeCl3溶液中使铜全部溶解得到浸泡液(电路板上其他物质均不发生反应),测得电路板质量减少了6.4g,在浸泡液中加足量的铁粉并使之充分反应,过滤并干燥固体,固体质量比加入的铁粉质量减少了4.8g,请回答下列问题:
①浸泡液中的溶质是________ (写化学式)。
②参与反应的铁粉的质量是______ g。
③假设溶液的体积不变,最后所得溶液c(Fe2+)=_____ mol·L-1。

回答下列问题:
(1)写出“浸取”时Fe3O4反应的离子方程式:
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。若要获得100mL1.4mol·L-1的稀硝酸,需要用
(5)金属材料的使用见证了人类文明发展过程,铝合金是目前用途广泛的合金之一、例如,硬铝(一种铝合金)中含Cu 4%、Mg 0.5%、
(6)工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mL FeCl3溶液中使铜全部溶解得到浸泡液(电路板上其他物质均不发生反应),测得电路板质量减少了6.4g,在浸泡液中加足量的铁粉并使之充分反应,过滤并干燥固体,固体质量比加入的铁粉质量减少了4.8g,请回答下列问题:
①浸泡液中的溶质是
②参与反应的铁粉的质量是
③假设溶液的体积不变,最后所得溶液c(Fe2+)=
您最近一年使用:0次
名校
解题方法
2 . 铁是人类较早使用的金属之一,FeSO4和FeCl3是重要的化工原料。
(I)硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。
(1)为防止FeSO4溶液变质,应在溶液中加入少量_______ (填标号,下同);向FeSO4溶液加入_______ 可验证该溶液是否变质。
A.铜片 B.KSCN溶液 C.氯气 D.铁粉
(2)该补血剂与维生素C同时服用,有利于Fe2+的吸收。某同学设计如下实验探究维生素C的作用:取少量Fe2(SO4)3溶液于试管中,加入维生素C片2片,振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论是_______ 。(已知:Fe2+遇铁氰化钾溶液产生蓝色沉淀)
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有FeCl3、FeCl2和CuCl2,且c(Fe3+)=c(Fe2+)。
(3)从废液中可回收铜,并获得FeCl3溶液,设计如下方案:
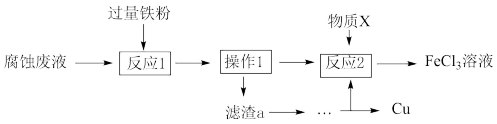
①滤渣a为_______ 。
②物质X为_______ 。
A.HCl B.酸性KMnO4溶液 C.Cl2
(4)取该废液20mL并加入mg铁粉,充分反应。
①对反应后的溶液分析错误的是_______
A.溶液中一定含有Fe2+
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有Cu2+,则可能有固体析出
D.溶液若有Fe3+剩余,则一定没有固体析出
②若m=2.72,则充分反应后得到20mL3.0mol/L氯化亚铁溶液和2.24g固体混合物。则原废液中Fe3+的物质的量浓度为_______ 。
(I)硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。
(1)为防止FeSO4溶液变质,应在溶液中加入少量
A.铜片 B.KSCN溶液 C.氯气 D.铁粉
(2)该补血剂与维生素C同时服用,有利于Fe2+的吸收。某同学设计如下实验探究维生素C的作用:取少量Fe2(SO4)3溶液于试管中,加入维生素C片2片,振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论是
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有FeCl3、FeCl2和CuCl2,且c(Fe3+)=c(Fe2+)。
(3)从废液中可回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣a为
②物质X为
A.HCl B.酸性KMnO4溶液 C.Cl2
(4)取该废液20mL并加入mg铁粉,充分反应。
①对反应后的溶液分析错误的是
A.溶液中一定含有Fe2+
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有Cu2+,则可能有固体析出
D.溶液若有Fe3+剩余,则一定没有固体析出
②若m=2.72,则充分反应后得到20mL3.0mol/L氯化亚铁溶液和2.24g固体混合物。则原废液中Fe3+的物质的量浓度为
您最近一年使用:0次
2023-02-14更新
|
299次组卷
|
3卷引用:吉林省长春外国语学校2023-2024学年高一下学期开学化学试题
3 . 铟(In)是一种主要用于液晶显示屏和半导体生产的重要稀有金属。从铅、锌的冶炼过程中产生的高铟烟灰(主要含ZnO、PbO、Fe2O3、In2O3、In2S3)中提取铟的流程如图:

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是____ 。
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是____ (用化学方程式表示)。
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有____ (填化学式)。
(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=____ (已知lg19=1.28忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为____ mol•L-1。

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为____ 。

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO
 ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2
 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为
您最近一年使用:0次
2022-10-29更新
|
608次组卷
|
3卷引用:吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题
名校
解题方法
4 . 草酸亚铁晶体(FeC2O4•2H2O)常用作生产锂电池、涂料、着色剂以及感光材料的原材料,难溶于水,受热易分解。
I.制备草酸亚铁晶体:
①称取硫酸亚铁铵晶体5g,放入250mL三颈烧瓶中,加入10滴左右1.0mol•L-1H2SO4溶液和15mL蒸馏水加热溶解;
②加入25mL饱和草酸溶液,加热搅拌至沸腾停止加热,静置;
③待黄色晶体FeC2O4•2H2O沉淀后倾析,洗涤,加入约20mL蒸馏水搅拌并温热5min,静置,弃去上层清液,即得黄色草酸亚铁晶体。

(1)B的名称是____ ;B的出水口是____ (填“上口”或“下口”)。
(2)硫酸亚铁铵晶体中可能混有Fe3+,检验其是否含有Fe3+的试剂是____ 溶液,若混有Fe3+,观察到的现象是____ 。
II.将一定质量的草酸亚铁晶体(FeC2O4•2H2O)在氩气气氛中进行热重分析示意图(TG%表示残留固体质量占原样品总质量的百分数)。

(3)B处时残留物的化学式为____ 。
(4)取上述分解得到的600℃时的固体放在空气中继续加热时其质量增加,发生反应的化学方程式为____ 。
I.制备草酸亚铁晶体:
①称取硫酸亚铁铵晶体5g,放入250mL三颈烧瓶中,加入10滴左右1.0mol•L-1H2SO4溶液和15mL蒸馏水加热溶解;
②加入25mL饱和草酸溶液,加热搅拌至沸腾停止加热,静置;
③待黄色晶体FeC2O4•2H2O沉淀后倾析,洗涤,加入约20mL蒸馏水搅拌并温热5min,静置,弃去上层清液,即得黄色草酸亚铁晶体。

(1)B的名称是
(2)硫酸亚铁铵晶体中可能混有Fe3+,检验其是否含有Fe3+的试剂是
II.将一定质量的草酸亚铁晶体(FeC2O4•2H2O)在氩气气氛中进行热重分析示意图(TG%表示残留固体质量占原样品总质量的百分数)。

(3)B处时残留物的化学式为
(4)取上述分解得到的600℃时的固体放在空气中继续加热时其质量增加,发生反应的化学方程式为
您最近一年使用:0次
2022-10-29更新
|
177次组卷
|
4卷引用:吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题
名校
解题方法
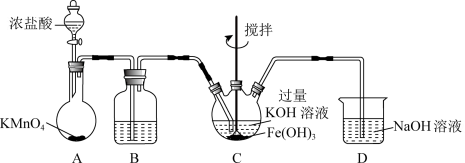
5 . 实验小组制备高铁酸钾(K2FeO4) 并探究其性质。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
I. 制备K2FeO4 (夹持装置略)_____ 。
(2)装置B的作用是除杂,所用试剂为______ 。
(3)C中得到紫色固体和溶液。C中主要反应的化学方程式为:____ ,此反应表明:氧化性Cl2____  (填“>”或“<”)。
(填“>”或“<”)。
(4)C中除了发生(3)中的反应,还可能发生的化学反应(离子方程式):_____ 。
II. 探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
(5)此实验可证明氧化Cl-的物质只能是 。用KOH溶液洗涤的目的是
。用KOH溶液洗涤的目的是_____ 。
(6)此实验得出Cl2和 的氧化性强弱关系与制备实验时得出的结论相反,原因是
的氧化性强弱关系与制备实验时得出的结论相反,原因是___ 。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
I. 制备K2FeO4 (夹持装置略)
(2)装置B的作用是除杂,所用试剂为
(3)C中得到紫色固体和溶液。C中主要反应的化学方程式为:
 (填“>”或“<”)。
(填“>”或“<”)。(4)C中除了发生(3)中的反应,还可能发生的化学反应(离子方程式):
II. 探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
(5)此实验可证明氧化Cl-的物质只能是
 。用KOH溶液洗涤的目的是
。用KOH溶液洗涤的目的是(6)此实验得出Cl2和
 的氧化性强弱关系与制备实验时得出的结论相反,原因是
的氧化性强弱关系与制备实验时得出的结论相反,原因是
您最近一年使用:0次
2020-10-24更新
|
723次组卷
|
3卷引用:吉林省辽源市第五中学2019-2020学年高一下学期期中考试化学试题
名校
解题方法
6 . 利用下图所示装置(酒精灯、铁架台等未画出)制取氯气并用氯气制备PCl3,将氯气持续通入耐热反应器中与白磷接触发生剧烈反应,放出大量的热,产生火焰。

已知:PCl3和PCl5的一些物理性质如下:
回答下列问题:
(1)N2的电子式___________ ;反应前充入足量N2目的是___________ 。
(2)写出浓盐酸和MnO2反应的离子方程式____________ 。
(3)恒温热交换槽控制最适宜的温度为_____________ ℃。
(4)试剂M是__________ ,其作用是__________ 。
(5)PCl3在潮湿的空气中迅速水解,生成二元酸H3PO3。写出PCl3与过量NaOH溶液反应的离子方程式为__________ 。

已知:PCl3和PCl5的一些物理性质如下:
| 熔点/℃ | 沸点/℃ | |
| PCl3 | - 93.6 | 76 |
| PCl5 | 148 | 160 |
回答下列问题:
(1)N2的电子式
(2)写出浓盐酸和MnO2反应的离子方程式
(3)恒温热交换槽控制最适宜的温度为
(4)试剂M是
(5)PCl3在潮湿的空气中迅速水解,生成二元酸H3PO3。写出PCl3与过量NaOH溶液反应的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 次氯酸溶液由于其具有极强的氧化性,可以使病毒的核酸物质发生氧化反应,从而杀灭病毒,是常用的消毒剂和漂白剂。已知:
Ⅰ.常温常压下,Cl2O 为棕黄色气体,沸点为 3.8℃,42 ℃以上会分解生成 Cl2 和 O2,Cl2O 易溶于水并与水立即反应生成 HClO。
Ⅱ.将氯气和空气(不参与反应)按体积比1∶3 混合通入潮湿的碳酸钠中生成Cl2O 气体,用水吸收Cl2O(不含 Cl2)制得次氯酸溶液。某实验室利用以下装置制备浓度不小于 0.8mol/L 的次氯酸溶液。
A. B.
B.  C.
C.  D.
D.  E.
E. 
回答下列问题:
(1)装置D 的作用为_______________ 。
(2)配平装置 B 中的反应___________ :Cl2+Na2CO3+H2O = Cl2O+NaCl+NaHCO3。写出Cl2O 的结构式为_____ 。
(3)装置C 中加入的试剂X 为CCl4,其作用是__________ 。
(4)各装置的连接顺序为 A→____________ →____________ →______________ →E。
(5)此方法相对于氯气直接溶于水制备次氯酸溶液的优点是__________ 。(答出 1 条即可)
(6)若装置 B 中生成的 Cl2O 气体有 20%滞留在E 前各装置中,其余均溶于装置E 的水中,装置E 所得 500mL 次氯酸溶液浓度为 0.8mol/L,则至少需要含水 8%的碳酸钠的质量为_____ g。
Ⅰ.常温常压下,Cl2O 为棕黄色气体,沸点为 3.8℃,42 ℃以上会分解生成 Cl2 和 O2,Cl2O 易溶于水并与水立即反应生成 HClO。
Ⅱ.将氯气和空气(不参与反应)按体积比1∶3 混合通入潮湿的碳酸钠中生成Cl2O 气体,用水吸收Cl2O(不含 Cl2)制得次氯酸溶液。某实验室利用以下装置制备浓度不小于 0.8mol/L 的次氯酸溶液。
A.
 B.
B.  C.
C.  D.
D.  E.
E. 
回答下列问题:
(1)装置D 的作用为
(2)配平装置 B 中的反应
(3)装置C 中加入的试剂X 为CCl4,其作用是
(4)各装置的连接顺序为 A→
(5)此方法相对于氯气直接溶于水制备次氯酸溶液的优点是
(6)若装置 B 中生成的 Cl2O 气体有 20%滞留在E 前各装置中,其余均溶于装置E 的水中,装置E 所得 500mL 次氯酸溶液浓度为 0.8mol/L,则至少需要含水 8%的碳酸钠的质量为
您最近一年使用:0次
2020-04-23更新
|
222次组卷
|
2卷引用:吉林省长春市2020届高三第二次质量监测理科理综化学试题
8 . 甲、乙、丙分别是由Na、O、H形成的单质,A、B、C是由H、0、Na三种元素中的两种或三种组成的化合物,各种单质与化合物之间存在如图所示的转化笑系:

请回答:
(1)写出下列物质的化学式A________ ,B_________ ,C_______ 。
(2)写出下列反应的化学方程式:
①单质甲+化合物B_____________________________ 。
②化合物A+化合物B___________________________ 。

请回答:
(1)写出下列物质的化学式A
(2)写出下列反应的化学方程式:
①单质甲+化合物B
②化合物A+化合物B
您最近一年使用:0次
2018-09-23更新
|
323次组卷
|
3卷引用:吉林省长春汽车经济开发区第六中学2017-2018学年高一上学期期中考试化学试题
吉林省长春汽车经济开发区第六中学2017-2018学年高一上学期期中考试化学试题(已下线)【走进新高考】(人教版必修一)高一上学期期中复习模拟(A卷)(基础篇)02福建省厦门市湖滨中学2018-2019学年高一上学期期中考试化学试题
解题方法
9 . X、Y、Z、W四种常见化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去):
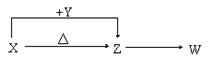
请回答:
⑴W的化学式是____________________ 。
⑵X与Y在溶液中反应的离子方程式是________________________ 。
⑶①将4.48 L(已折算为标准状况)W通入100 mL 3 mol/L的Y的水溶液后,溶液中的溶质是_________ 。
②自然界中存在X、Z和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为____________ g。
⑷选用X所含有的四种元素中的两种或三种组成的化合物,并利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色助燃性气体。
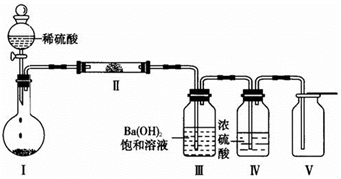
①装置Ⅰ中反应的化学方程式是___________________________________ ,
装置Ⅱ中物质的化学式是_____________ 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是_______________ ,所需仪器装置是________________ (从上图选择必要装置,填写编号)。

请回答:
⑴W的化学式是
⑵X与Y在溶液中反应的离子方程式是
⑶①将4.48 L(已折算为标准状况)W通入100 mL 3 mol/L的Y的水溶液后,溶液中的溶质是
②自然界中存在X、Z和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为
⑷选用X所含有的四种元素中的两种或三种组成的化合物,并利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色助燃性气体。

①装置Ⅰ中反应的化学方程式是
装置Ⅱ中物质的化学式是
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是
您最近一年使用:0次
12-13高一上·海南·期末
解题方法
10 . 按图所示实验过程填空:

(1)写出上述反应的离子方程式:
①______
②______
③______
(2)填空:a______ b ______ c______ d ______

(1)写出上述反应的离子方程式:
①
②
③
(2)填空:a
您最近一年使用:0次



