解题方法
1 . 镁及其化合物是实验设计的热点载体。某学习小组设计实验探究镁与二氧化氮反应的产物,实验装置如图所示。 能与水反应;②反应完后E中有
能与水反应;②反应完后E中有 。
。
回答下列问题:
(1)仪器a的名称为___________ ;a中试剂是___________ 。
(2)实验时,为了防止Mg与空气中氧气等反应,操作为___________ 。
(3)实验测得Mg与 反应生成MgO、
反应生成MgO、 和
和 ,其中
,其中 和
和 的物质的量相等,则C中反应的化学方程式为
的物质的量相等,则C中反应的化学方程式为___________ 。装置D的作用是___________ 。
(4)E装置中发生反应的离子方程式为___________ 。
(5)写出氮化镁与水反应的化学方程式___________ 。
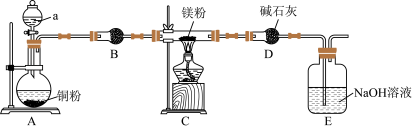
(6)已知浓硝酸分解反应为: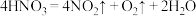 ,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出
,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出 气体能支持燃烧的说法,你认为该说法正确吗?并说明理由
气体能支持燃烧的说法,你认为该说法正确吗?并说明理由___________ 。
 能与水反应;②反应完后E中有
能与水反应;②反应完后E中有 。
。回答下列问题:
(1)仪器a的名称为
(2)实验时,为了防止Mg与空气中氧气等反应,操作为
(3)实验测得Mg与
 反应生成MgO、
反应生成MgO、 和
和 ,其中
,其中 和
和 的物质的量相等,则C中反应的化学方程式为
的物质的量相等,则C中反应的化学方程式为(4)E装置中发生反应的离子方程式为
(5)写出氮化镁与水反应的化学方程式
(6)已知浓硝酸分解反应为:
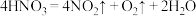 ,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出
,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出 气体能支持燃烧的说法,你认为该说法正确吗?并说明理由
气体能支持燃烧的说法,你认为该说法正确吗?并说明理由
您最近一年使用:0次
2 .  可用于制取
可用于制取 和
和 ,实验室制取纯净、干燥的
,实验室制取纯净、干燥的 的装置如下图。
的装置如下图。
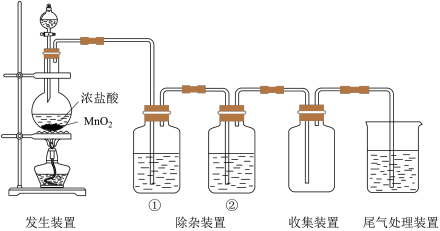
(1)实验室制取 的化学方程式是
的化学方程式是_______ 。
(2)除杂装置①中的试剂是_______ 。
(3)实验室加热 和
和 的固体混合物制取
的固体混合物制取 ,同时生成
,同时生成 ,反应中
,反应中 是催化剂,化学方程式是
是催化剂,化学方程式是_______ 。
 可用于制取
可用于制取 和
和 ,实验室制取纯净、干燥的
,实验室制取纯净、干燥的 的装置如下图。
的装置如下图。
(1)实验室制取
 的化学方程式是
的化学方程式是(2)除杂装置①中的试剂是
(3)实验室加热
 和
和 的固体混合物制取
的固体混合物制取 ,同时生成
,同时生成 ,反应中
,反应中 是催化剂,化学方程式是
是催化剂,化学方程式是
您最近一年使用:0次
解题方法
3 . 下面是用36.5%的浓盐酸(ρ=1.18g/cm3)配制成1mol/L的稀盐酸500mL的操作,请按要求填空:
(1)所需浓盐酸的体积为_____ mL(保留一位小数)。
(2)如果实验室应选用_________ mL 量筒最好。
(3)将量取的浓盐酸沿烧杯内壁慢慢注入盛有约 200mL 水的烧杯里,并不断搅拌。
(4)将冷却至室温的上述溶液沿玻璃棒注入______________ 中,并用 50mL 蒸馏水洗涤烧杯2~3 次,洗涤液要注入上述仪器中,并摇匀。
(5)加水至距刻度 1~2cm 时,改用胶头滴管加水,使溶液的凹液面正好跟刻度相平。
(6)误差分析:请用“偏高”“偏低”或“无影响”进行填空
①定容时,观察液面俯视,则浓度_____ ,
②定容时,水加多了,用滴管吸出,则浓度_____ 。
(1)所需浓盐酸的体积为
(2)如果实验室应选用
(3)将量取的浓盐酸沿烧杯内壁慢慢注入盛有约 200mL 水的烧杯里,并不断搅拌。
(4)将冷却至室温的上述溶液沿玻璃棒注入
(5)加水至距刻度 1~2cm 时,改用胶头滴管加水,使溶液的凹液面正好跟刻度相平。
(6)误差分析:请用“偏高”“偏低”或“无影响”进行填空
①定容时,观察液面俯视,则浓度
②定容时,水加多了,用滴管吸出,则浓度
您最近一年使用:0次
名校
解题方法
4 . 某化学课外小组在制备Fe(OH)2实验过程中观察到生成的白色沉淀迅速变为灰绿色,一段时间后变为红褐色。该小组同学对产生灰绿色沉淀的原因,进行了实验探究。
Ⅰ.甲同学猜测灰绿色沉淀是Fe(OH)2和Fe(OH)3的混合物,设计并完成实验1和实验2。
(1)实验中产生红褐色沉淀的化学方程式为_____ 。
(2)实验1中加入维生素C溶液是利用该物质的_____ 性。
(3)实验2中加入的试剂a为_____ (填写化学式,下同)溶液,试剂b为_____ 溶液。实验2的现象说明甲同学的猜测_____ 。(填“正确”或“不正确”)
Ⅱ.乙同学查阅资料得知,Fe(OH)2沉淀具有较强的吸附性,猜测灰绿色可能是Fe(OH)2吸附Fe2+引起的,设计并完成了实验3﹣实验5。
(4)依据乙同学的猜测,实验4中沉淀无灰绿色的原因为_____ 。
(5)该小组同学依据实验5的实验现象,间接证明了乙同学猜测的正确性,则实验5的实验现象可能为_____ 。
Ⅲ.该小组同学发现当溶液中存在Fe3+或溶解较多O2时,白色沉淀更容易变成灰绿色。经过再次查阅资料得知当沉淀形成时,若得到的沉淀单一,则沉淀结构均匀,也紧密:若有杂质固体存在时,得到的沉淀便不够紧密,与溶液的接触面积会更大。因此,当Fe(OH)2沉淀中混有Fe(OH)3时,沉淀不够紧密,与溶液接触面积更大,更容易吸附Fe2+。
(6)根据上述实验该小组同学得出结论:制备Fe(OH)2时能较长时间观察到白色沉淀的适宜的条件和操作为_____ ,并除去溶液中的Fe3+和溶解O2。
Ⅰ.甲同学猜测灰绿色沉淀是Fe(OH)2和Fe(OH)3的混合物,设计并完成实验1和实验2。
编号 | 实验操作 | 实验现象 |
实验1 | 向2mL 0.1mol•L﹣1FeSO4溶液中滴0.1mol•L﹣1NaOH溶液(两溶液中均先加几滴维生C溶液) | 液面上方出现白色沉淀,一段时间后变为灰绿色,长时间后变为红褐色 |
实验2 | 取实验1中少量灰绿色沉淀,洗净后加盐酸溶解,分成两份。①中加入试剂a,②中加入试剂b | ①中出现蓝色沉淀,②中溶液未变成红色 |
(2)实验1中加入维生素C溶液是利用该物质的
(3)实验2中加入的试剂a为
Ⅱ.乙同学查阅资料得知,Fe(OH)2沉淀具有较强的吸附性,猜测灰绿色可能是Fe(OH)2吸附Fe2+引起的,设计并完成了实验3﹣实验5。
编号 | 实验操作 | 实验现象 |
实验3 | 向10mL 4mol•L﹣1NaOH溶液中逐滴加入0.1mol•L﹣1FeSO4溶液(两溶液中均先加几滴维生素C溶液) | 液面上方产生白色沉淀(带有较多灰绿色)。沉淀下沉后,部分灰绿色沉淀变为白色 |
实验4 | 向10mL 8mol•L﹣1NaOH溶液中逐滴加入0.mol•L﹣1FeSO4溶液(两溶液中均先加几滴维生素C溶液) | 液面上方产生白色沉淀(无灰绿色)。沉淀下沉后,仍为白色 |
实验5 | 取实验4中白色沉淀,洗净后放在潮湿的空气中 |
(5)该小组同学依据实验5的实验现象,间接证明了乙同学猜测的正确性,则实验5的实验现象可能为
Ⅲ.该小组同学发现当溶液中存在Fe3+或溶解较多O2时,白色沉淀更容易变成灰绿色。经过再次查阅资料得知当沉淀形成时,若得到的沉淀单一,则沉淀结构均匀,也紧密:若有杂质固体存在时,得到的沉淀便不够紧密,与溶液的接触面积会更大。因此,当Fe(OH)2沉淀中混有Fe(OH)3时,沉淀不够紧密,与溶液接触面积更大,更容易吸附Fe2+。
(6)根据上述实验该小组同学得出结论:制备Fe(OH)2时能较长时间观察到白色沉淀的适宜的条件和操作为
您最近一年使用:0次
2020-12-14更新
|
262次组卷
|
4卷引用:贵州省安顺市 镇宁布依族苗族自治县第一高级中学(镇宁实验学校)2023-2024学年高一上学期12月月考化学试题
解题方法
5 . 已知铝土矿的主要成分是A12O3,含有杂质SiO2(不溶于盐酸和水)、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)溶液A转化为溶液D发生的离子方程式为___________ ;
(2)加热沉淀F分解出物质M的化学方程式为___________ ;
(3)由物质M制取铝的化学方程式__________ ;
(4)沉淀B的成分是_________ ,沉淀C的颜色为____________ 。

请回答下列问题:
(1)溶液A转化为溶液D发生的离子方程式为
(2)加热沉淀F分解出物质M的化学方程式为
(3)由物质M制取铝的化学方程式
(4)沉淀B的成分是
您最近一年使用:0次
6 . 草木灰中富含钾盐,主要成分是碳酸钾。现从草木灰中提取钾盐,并用实验检验其中的 、
、 和Cl-。
和Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解和沉淀,③________ ,④对滤液进行蒸发,⑤冷却结晶。
(2)将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在三支试管里。
①在第一支试管里加入HCl溶液,可观察有________ 生成,证明溶液中有 。
。
②在第二支试管里加入足量稀_____ 后,再加入_____ 溶液,可观察有白色沉淀生成,证明溶液中有 。
。
③在第三支试管里加入足量______ 后,再加入AgNO3溶液,可观察有白色沉淀生成,证明溶液中有Cl-。
 、
、 和Cl-。
和Cl-。(1)从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解和沉淀,③
(2)将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在三支试管里。
①在第一支试管里加入HCl溶液,可观察有
 。
。②在第二支试管里加入足量稀
 。
。③在第三支试管里加入足量
您最近一年使用:0次
2020-10-16更新
|
103次组卷
|
2卷引用:贵州省安顺市平坝第一高级中学2020-2021学年高一9月月考化学试题
11-12高一下·四川成都·阶段练习
7 . 某同学利用如图所示的实验装置进行铁跟水蒸气反应的实验,并研究铁及其化合物的部分性质。请回答下列问题:
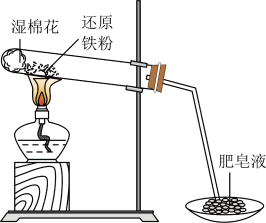
(1)硬质试管中发生反应的化学方程式为_______________________________ 。
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有_________ ,可能有__________________ ;若溶液未变红色,则说明硬质试管中固体物质的成分是_____________________________________ 。
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是________________________________ (用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:__________________________________ 。
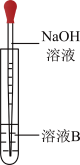
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明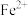 具有
具有_________ 性。由此可知,实验室中含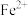 的盐溶液需现用现配制的原因是
的盐溶液需现用现配制的原因是__________ ,并且配制含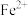 的盐溶液时应加入少量
的盐溶液时应加入少量___________________ 。

(1)硬质试管中发生反应的化学方程式为
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明
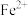 具有
具有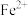 的盐溶液需现用现配制的原因是
的盐溶液需现用现配制的原因是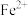 的盐溶液时应加入少量
的盐溶液时应加入少量
您最近一年使用:0次
2020-04-29更新
|
117次组卷
|
10卷引用:贵州省安顺市普定县第一中学2018-2019学年高一上学期12月份考试化学试题
贵州省安顺市普定县第一中学2018-2019学年高一上学期12月份考试化学试题(已下线)2011-2012学年四川省成都铁中高一下学期2月学业检测化学试卷(已下线)2013学年江西省德兴一中、横峰中学、铅山一中、弋阳一中高一第三次月考化学试卷云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题云南省玉溪市江川区第二中学2018-2019学年高一上学期期末考试化学试题云南省文山州广南一中2019-2020学年高一上学期期中考试化学试题四川省广元市川师大万达中学2019-2020学年高一上学期11月月考化学试题步步为赢 高一化学寒假作业:作业十七 综合评估(一)吉林省长春市九台区第四中学2019-2020高一上学期期末测试化学试题云南省镇沅县第一中学校2021-2022学年高一下学期开学考试化学试题
解题方法
8 . 卤素及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
①氧化剂与还原剂的物质的量比是_______ ;如果反应生成0.3mol的单质碘,则转移的电子数目是_______ 。
②先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,这时候,观察到的现象是_____ ;
③若采用下图实验装置将四氯化碳和I2的混合溶液分离。
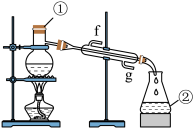
写出图中仪器的名称:①_____ ;该装置还缺少的仪器是_____ ;冷凝管的进水口是:_____ (填g或f)。
(2)实验室常用MnO2和浓盐酸制氯气,反应原理:MnO2+4HCl(浓)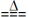 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①实验室用MnO2和浓盐酸制氯气的离子方程式:__________________________
②上述反应中氧化剂:__________ ,还原剂:__________ ,被氧化的HCl和未被氧化的HCl的比值______________ 。
③a : Cl2+2I-=I2+2Cl-;b: Cl2+2Fe2+=2Fe3++Cl-;c:2Fe3++2I-=I2+2Fe2+。Cl2、I2、Fe3+的氧化性由强到弱的顺序:_________________________
(1)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
①氧化剂与还原剂的物质的量比是
②先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,这时候,观察到的现象是
③若采用下图实验装置将四氯化碳和I2的混合溶液分离。

写出图中仪器的名称:①
(2)实验室常用MnO2和浓盐酸制氯气,反应原理:MnO2+4HCl(浓)
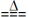 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O①实验室用MnO2和浓盐酸制氯气的离子方程式:
②上述反应中氧化剂:
③a : Cl2+2I-=I2+2Cl-;b: Cl2+2Fe2+=2Fe3++Cl-;c:2Fe3++2I-=I2+2Fe2+。Cl2、I2、Fe3+的氧化性由强到弱的顺序:
您最近一年使用:0次
2019-11-27更新
|
119次组卷
|
2卷引用:贵州省安顺市平坝第一高级中学2019-2020学年高一上学期期中考试化学试题



