1 . 实验室需配制 的
的 溶液,请回答下列问题:
溶液,请回答下列问题:
(1)需用托盘天平称取 固体的总质量为
固体的总质量为_______ g。
(2)在此溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作是_______ (填序号)。
①称量(用托盘天平) ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(3)配制 的
的 溶液用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需要用到的玻璃仪器有
溶液用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需要用到的玻璃仪器有_______ 、_______ 。
(4)配制 的
的 溶液,配制过程中所涉及的下列相关操作正确的是
溶液,配制过程中所涉及的下列相关操作正确的是_______ 。
 的
的 溶液,请回答下列问题:
溶液,请回答下列问题:(1)需用托盘天平称取
 固体的总质量为
固体的总质量为(2)在此溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作是
①称量(用托盘天平) ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(3)配制
 的
的 溶液用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需要用到的玻璃仪器有
溶液用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需要用到的玻璃仪器有(4)配制
 的
的 溶液,配制过程中所涉及的下列相关操作正确的是
溶液,配制过程中所涉及的下列相关操作正确的是a.  b.
b.  c.
c. 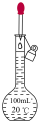 d.
d.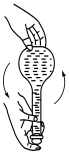
A.用蒸馏水溶解 固体后,立即转入容量瓶中 固体后,立即转入容量瓶中 |
B.称量 固体时,将药品和砝码放反了 固体时,将药品和砝码放反了 |
| C.定容时俯视刻度线 |
| D.定容后发现溶液的凹液面最低点高于刻度线,用胶头滴管将多余的液体吸出 |
您最近一年使用:0次
2 . 磷酸亚铁锂(LiFePO4)是生产锂电池的重要材料。实验室中用如图装置制备LiFePO4:在仪器A中加入40mL蒸馏水、少量抗坏血酸,再加入0.01molH3PO4和0.01molFeSO4•7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH•H2O,继续搅拌5min。快速将反应液装入反应釜中,保持170℃恒温5h。
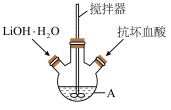
(1)仪器A的名称是___________ ;实验所用蒸馏水若未经煮沸直接使用,则可能发生反应的离子方程式为 ___________ 。
(2)实验中可用Na2SO3代替抗坏血酸,其原理是___________ (用离子方程式表示);不能用铁粉代替抗坏血酸的原因是 ___________ 。
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是___________ 、 ___________ 、过滤、洗涤、干燥。
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是___________ 。
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率约为 ___________。

(1)仪器A的名称是
(2)实验中可用Na2SO3代替抗坏血酸,其原理是
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率约为 ___________。
| A.85% | B.80% | C.75% | D.70% |
您最近一年使用:0次
解题方法
3 . 元素周期表是学习化学的重要工具。下表列出了①~⑩十种元素在周期表中的位置:
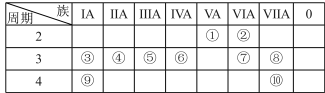
请按要求回答下列问题:
(1)写出元素①单质的电子式是______ ,元素②简单氢化物的结构式_____ 。
(2)③、④、⑨三种元素按原子半径由大到小的顺序排列为______ 。(用元素符号表示)
(3)元素⑥、⑦、⑧三种元素最高价氧化物对应水化物的酸性最强的为______ 。(用化学式表示)
(4)向元素③的单质与水反应后的溶液中加入元素⑤的单质,发生反应的化学方程式为_________ 。
(5)小组利用如图所示装置探究卤族元素的非金属性强弱。
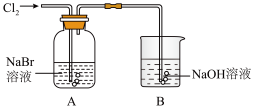
①写出装置A中发生的离子反应方程_________ 。
②取2mL A中橙黄色溶液于试管中,再滴入几滴KI淀粉溶液,观察到溶液变为蓝色。通过以上实验,不能得出非金属性:Br>I,理由________ 。

请按要求回答下列问题:
(1)写出元素①单质的电子式是
(2)③、④、⑨三种元素按原子半径由大到小的顺序排列为
(3)元素⑥、⑦、⑧三种元素最高价氧化物对应水化物的酸性最强的为
(4)向元素③的单质与水反应后的溶液中加入元素⑤的单质,发生反应的化学方程式为
(5)小组利用如图所示装置探究卤族元素的非金属性强弱。

①写出装置A中发生的离子反应方程
②取2mL A中橙黄色溶液于试管中,再滴入几滴KI淀粉溶液,观察到溶液变为蓝色。通过以上实验,不能得出非金属性:Br>I,理由
您最近一年使用:0次
名校
4 . 某化学兴趣实验小组同学在实验室利用如图所示装置制取NH3。

已知:①浓氨水中的溶质为NH3•H2O;②浓氨水与氧化钙反应会放出大量的热。
回答下列问题:
(1)仪器a的名称为________ 。
(2)浓氨水属于________ (填“混合物”、“氧化物”或“盐”),________ (填“能”或“不能”)导电,判断理由为________ 。
(3)圆底烧瓶中发生的反应为NH3•H2O+CaO═NH3↑+Ca(OH)2。
①写出Ca(OH)2白的一种用途:________ 。
②由图可知,NH3的密度________ (填“大于”、“小于”或“等于”)空气,判断的理由为________ 。
(4)烧杯中发生的反应为2NH3+H2SO4(稀)=(NH4)2SO4。
①该反应的离子方程式为________ 。
②反应一段时间后,烧杯中溶液的导电能力随时间变化的曲线可能为________ (填标号)。

已知:①浓氨水中的溶质为NH3•H2O;②浓氨水与氧化钙反应会放出大量的热。
回答下列问题:
(1)仪器a的名称为
(2)浓氨水属于
(3)圆底烧瓶中发生的反应为NH3•H2O+CaO═NH3↑+Ca(OH)2。
①写出Ca(OH)2白的一种用途:
②由图可知,NH3的密度
(4)烧杯中发生的反应为2NH3+H2SO4(稀)=(NH4)2SO4。
①该反应的离子方程式为
②反应一段时间后,烧杯中溶液的导电能力随时间变化的曲线可能为
 |  |  |  |
| A | B | C | D |
您最近一年使用:0次
2023-11-10更新
|
126次组卷
|
3卷引用:贵州省遵义市2023-2024学年高一上学期10月月考化学试题
名校
5 . 粗盐中常含有MgCl2、CaCl2等杂质,提纯粗盐的工艺流程如图所示。回答下列问题:

(1)粗盐水中含有NaCl、CaCl2和MgCl2:
①CaCl2从组成的阳离子来看,属于________ 盐。
②常温下,仅由MgCl2形成的水溶液,________ (填“能”或“不能”)发生丁达尔效应。
(2)步骤Ⅰ中MgCl2与氢氧化钠溶液发生反应的离子方程式为________ 。
(3)步骤Ⅱ中的生成物为CaCO3,该物质中氧元素的质量分数为________ 。
(4)进行操作a时,所用到的装置如图所示(滤纸已略去):
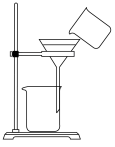
①该装置的错误有________ 处,请指出其错误:________ (写一处即可)。
②过滤后,若往漏斗下端的烧杯中滴入几滴红色石蕊试液,可观察到的现象为________ 。
(5)操作b为蒸发浓缩、冷却结晶,该过程中除了能将水蒸发,还能将过量的稀盐酸除去,主要利用了稀盐酸的________ (填“易挥发性”或“酸性”)。

(1)粗盐水中含有NaCl、CaCl2和MgCl2:
①CaCl2从组成的阳离子来看,属于
②常温下,仅由MgCl2形成的水溶液,
(2)步骤Ⅰ中MgCl2与氢氧化钠溶液发生反应的离子方程式为
(3)步骤Ⅱ中的生成物为CaCO3,该物质中氧元素的质量分数为
(4)进行操作a时,所用到的装置如图所示(滤纸已略去):

①该装置的错误有
②过滤后,若往漏斗下端的烧杯中滴入几滴红色石蕊试液,可观察到的现象为
(5)操作b为蒸发浓缩、冷却结晶,该过程中除了能将水蒸发,还能将过量的稀盐酸除去,主要利用了稀盐酸的
您最近一年使用:0次
2023-11-10更新
|
185次组卷
|
4卷引用:贵州省遵义市2023-2024学年高一上学期10月月考化学试题
名校
解题方法
6 . 有一包固体,可能含有镁粉、炭粉、氧化铜、氢氧化钠、氯化钾中的一种或几种。为探究固体的组成,某化学兴趣小组进行了如图所示实验:
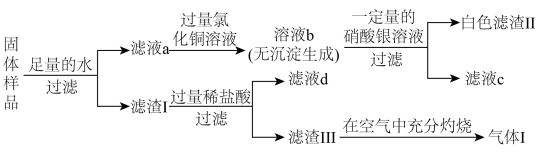
已知:①常温下,镁粉不与冷水反应;②滤液d的颜色为蓝色。
回答下列问题:
(1)滤渣Ⅰ的主要成分为炭粉、氧化铜和镁粉。
①写出一组碳元素的同素异形体:___________ 。
②少量的炭粉与氧化铜在高温条件下反应的化学方程式为___________ ,该反应中氧化剂与还原剂的质量之比为___________ 。
③查阅资料可知,镁粉在空气中燃烧会生成一种化学式为 的物质,该物质能与水发生反应,生成氢氧化镁和氨气,
的物质,该物质能与水发生反应,生成氢氧化镁和氨气, 与水发生反应的化学方程式为
与水发生反应的化学方程式为___________ 。
(2)由滤液a→溶液b可知,该固体中一定不含___________ (填化学式)。
(3)白色滤渣Ⅱ为___________ (填名称),___________ (填“能”或“不能”)判断该固体中含有氯化钾,判断的理由为___________ 。
(4)写出气体Ⅰ的一种用途:___________ 。

已知:①常温下,镁粉不与冷水反应;②滤液d的颜色为蓝色。
回答下列问题:
(1)滤渣Ⅰ的主要成分为炭粉、氧化铜和镁粉。
①写出一组碳元素的同素异形体:
②少量的炭粉与氧化铜在高温条件下反应的化学方程式为
③查阅资料可知,镁粉在空气中燃烧会生成一种化学式为
 的物质,该物质能与水发生反应,生成氢氧化镁和氨气,
的物质,该物质能与水发生反应,生成氢氧化镁和氨气, 与水发生反应的化学方程式为
与水发生反应的化学方程式为(2)由滤液a→溶液b可知,该固体中一定不含
(3)白色滤渣Ⅱ为
(4)写出气体Ⅰ的一种用途:
您最近一年使用:0次
2023-10-15更新
|
126次组卷
|
3卷引用:贵州省遵义市2023-2024学年高一上学期10月月考化学试题
解题方法
7 . 下表是元素周期表的一部分,请参照元素①~⑦在表中的位置,回答下列问题。
(1)元素①的原子结构示意图为____________ 。
(2)在这些元素的最高价氧化物对应的水化物中,碱性最强的物质是_________ (填化学式)。
(3)元素②⑤的原子半径最小的是_________ (填元素符号)。
(4)元素③⑥⑦的简单气态氢化物的稳定性由强到弱的顺序为_________________ (填化学式)。
(5)元素⑦的单质的电子式为_________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ |
(2)在这些元素的最高价氧化物对应的水化物中,碱性最强的物质是
(3)元素②⑤的原子半径最小的是
(4)元素③⑥⑦的简单气态氢化物的稳定性由强到弱的顺序为
(5)元素⑦的单质的电子式为
您最近一年使用:0次
2014高三·全国·专题练习
名校
解题方法
8 . 某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)。

(1)MgCO3的分解产物为____________________________________________________ 。
(2)装置C的作用是__________________________ ,处理尾气的方法为_____________ 。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
①乙组得到的黑色粉末是____________ 。
②甲组步骤1中反应的离子方程式为_________________________________________ 。
③乙组步骤4中,溶液变血红的原因为_______________________________________ ;溶液褪色可能的原因及其验证方法为________________________________________ 。
④从实验安全考虑,上图装置还可采取的改进措施是__________________________ 。

(1)MgCO3的分解产物为
(2)装置C的作用是
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变血红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变血红,后褪色 |
②甲组步骤1中反应的离子方程式为
③乙组步骤4中,溶液变血红的原因为
④从实验安全考虑,上图装置还可采取的改进措施是
您最近一年使用:0次
2023-07-06更新
|
666次组卷
|
12卷引用:贵州省习水县一中2018-2019学年高一上学期12月份考试化学试题
贵州省习水县一中2018-2019学年高一上学期12月份考试化学试题(已下线)2014届高考化学二轮冲刺非选择题增分专练 综合实验设计练习卷2015届广东省广州市十三中高三上学期期中理综化学试卷2016届广西桂林市第十八中学高三第一次月考化学试卷云南省玉溪市新平彝族傣族自治县第三中学2019-2020学年高一上学期期中考试化学试题云南省永平县第二中学2019-2020学年高一上学期期末考试化学试题人教版高中化学必修一第三章《金属及其化合物》测试卷2贵州省惠水县第一高级中学2019-2020学年高一上学期期末考试化学试题(已下线)第2讲 离子反应和离子方程式(已下线)第6讲 铁及其重要化合物(已下线)专题突破卷12 化学实验基础(一)-2024年高考化学一轮复习考点通关卷(新教材新高考)江西省宜春市百树学校2023-2024学年高三上学期暑期阶段测试化学试卷
解题方法
9 . 以废铁屑(含少量 、
、 、
、 等杂质)为原料制备硫酸亚铁晶体的流程如图所示:
等杂质)为原料制备硫酸亚铁晶体的流程如图所示:

已知:酸性溶液中的 容易被空气氧化
容易被空气氧化
(1)实验室需要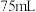 该硫酸,用质量分数为98%、密度为
该硫酸,用质量分数为98%、密度为 的浓硫酸进行配制,需要用到的玻璃仪器有烧杯、玻璃棒、量筒和
的浓硫酸进行配制,需要用到的玻璃仪器有烧杯、玻璃棒、量筒和___________ (填仪器名称),用量筒量取V(浓硫酸)=___________  。
。
(2)“滤渣”的主要成分是___________ (填化学式),“溶液Ⅰ”中的阳离子是___________ (填离子符号)。
(3)写出流程中生成 的反应的化学方程式:
的反应的化学方程式:___________ 。向“溶液Ⅰ”中加入过量 时发生反应的离子方程式为
时发生反应的离子方程式为___________ 。
(4)“操作Ⅲ”的过程是蒸发浓缩、___________ 、___________ 、洗涤、干燥,检验“溶液Ⅱ”中不存在 的试剂是
的试剂是___________ 。
 、
、 、
、 等杂质)为原料制备硫酸亚铁晶体的流程如图所示:
等杂质)为原料制备硫酸亚铁晶体的流程如图所示:
已知:酸性溶液中的
 容易被空气氧化
容易被空气氧化(1)实验室需要
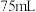 该硫酸,用质量分数为98%、密度为
该硫酸,用质量分数为98%、密度为 的浓硫酸进行配制,需要用到的玻璃仪器有烧杯、玻璃棒、量筒和
的浓硫酸进行配制,需要用到的玻璃仪器有烧杯、玻璃棒、量筒和 。
。(2)“滤渣”的主要成分是
(3)写出流程中生成
 的反应的化学方程式:
的反应的化学方程式: 时发生反应的离子方程式为
时发生反应的离子方程式为(4)“操作Ⅲ”的过程是蒸发浓缩、
 的试剂是
的试剂是
您最近一年使用:0次
名校
10 . 如图是元素周期表的一部分,表中列出了八种元素的位置:
请回答下列问题:
(1)①元素的简单氢化物的电子式为______ 。
(2)在元素①-⑧中,金属性最强的元素是______ (填元素符号),最高价含氧酸酸性最强的是______ (填化学式)。
(3)②、④、⑥三种元素的简单离子半径由大到小的顺序是______ (填元素符号),③和⑦的简单氢化物的稳定性较强的是______ (填化学式)。
(4)④和⑤所形成的化合物属于______ (填“离子”或“共价”)化合物。
(5)⑤和⑥的最高价氧化物对应的水化物之间发生反应的离子方程式为______ 。
| 族周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①元素的简单氢化物的电子式为
(2)在元素①-⑧中,金属性最强的元素是
(3)②、④、⑥三种元素的简单离子半径由大到小的顺序是
(4)④和⑤所形成的化合物属于
(5)⑤和⑥的最高价氧化物对应的水化物之间发生反应的离子方程式为
您最近一年使用:0次



